2—氨基磷酸茚处理对新疆紫草悬浮细胞次生代谢物积累的影响
吕朝耕+王升+杨婉珍+刘谈+郭兰萍
[摘要] 用不同濃度2-氨基磷酸茚(AIP),并结合茉莉酸甲酯(MeJA)处理新疆紫草悬浮细胞,测定不同处理组、不同处理时间细胞中迷迭香酸及乙酰紫草素、脱氧紫草素、β,β′-二甲基丙烯酰紫草素、异戊酰紫草素等次生代谢物的含量,考察AIP抑制苯丙氨酸通路后对紫草悬浮细胞中次生代谢物合成、积累的影响。结果显示MeJA处理能够明显促进新疆紫草细胞中次生代谢物的合成积累;AIP处理能够抑制新疆紫草细胞中上述次生代谢物的积累,并在二者联合处理时能一定程度上抵消MeJA的促进作用,且抑制作用的强弱与处理剂量、处理时间存在正相关性。表明苯丙氨酸途径在紫草素类化合物生物合成中具有重要作用,可为通过细胞培养方式生产紫草素类化合物的代谢调控及紫草素类化合物生物合成等进一步研究提供参考。
[关键词] 新疆紫草;2-氨基磷酸茚;次生代谢;紫草素
Secondary metabolic responses to treatment of 2-aminoindan-2-
phosphonic acid in cell lines from Arnebia euchroma
LV Chao-geng1, WANG Sheng1, YANG Wan-zhen1,2, LIU Tan 1, GUO Lan-ping1*
(1. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences,
State Key Laboratory Breeding Base of Dao-di Herbs,Beijing 100700, China;
2. School of Traditional ChineseMedicine,Capital Medical University,Beijing 100069, China)
[Abstract] The accumulation of rosmarinic acid, acetylshikonin, deoxyshikonin, β, β′-dimethylacrylshikonin and isovalerylshikonin was investigated in cell suspension cultures of Arnebia euchroma (Royle) Johnst under the influence of 2-aminoindan-2-phosphonic acid (AIP), an inhibitor of phenylalanine ammonia lyase (PAL), and of the effector methyl jasmonate (MeJA). The results showed that methyl jasmonate promoted the accumulation of rosmarinic acid and shikonin derivatives. Conversely, 2-aminoindan-2-phosphonic acid suppressed the formation of rosmarinic acid, which indicated that AIP, indeed, was able to inhibit the phenylpropanoid pathway in A. euchroma. Meanwhile, the content of total shinkonins and other four kinds of shikonin derivatives, though varied in degrees, was also inhibited. And the inhibition was dose-dependent and time-dependent. Acetylshikonin responsed most rapidly to the treatment of AIP, the content reduced after 24 h of treatment and decreased to only half of those untreated control 48 h after teratment. β, β′-Dimethylacrylshikonin, difffer from acetylshikonin, responded much slowly to the treatment, inhibition could only be observed 96 h later. These suggest that phenylpropanoid pathway plays an important role in the shikoninsbiosynthesis, and this study provides a reference for the further research in metabolic regulation of producing shikonins by cell culture technology and biosynthesis pathways of shikonin derivatives. Still, shikonins biosynthesis pathways is complicated, the exact dose- and time-effect relationship of AIP and interaction between AIP and other effectors like MeJA need further research.
[Key words] Arnebia euchroma;2-aminoindan-2-phosphonic acid;secondary metabolites;shikonin
紫草科軟紫草属新疆紫草Arnebia euchroma (Royle) Johnst是传统中药材紫草Arnebiae Radix的重要来源,其有效成分的含量高,临床疗效好,具有广泛的药理作用[1]。
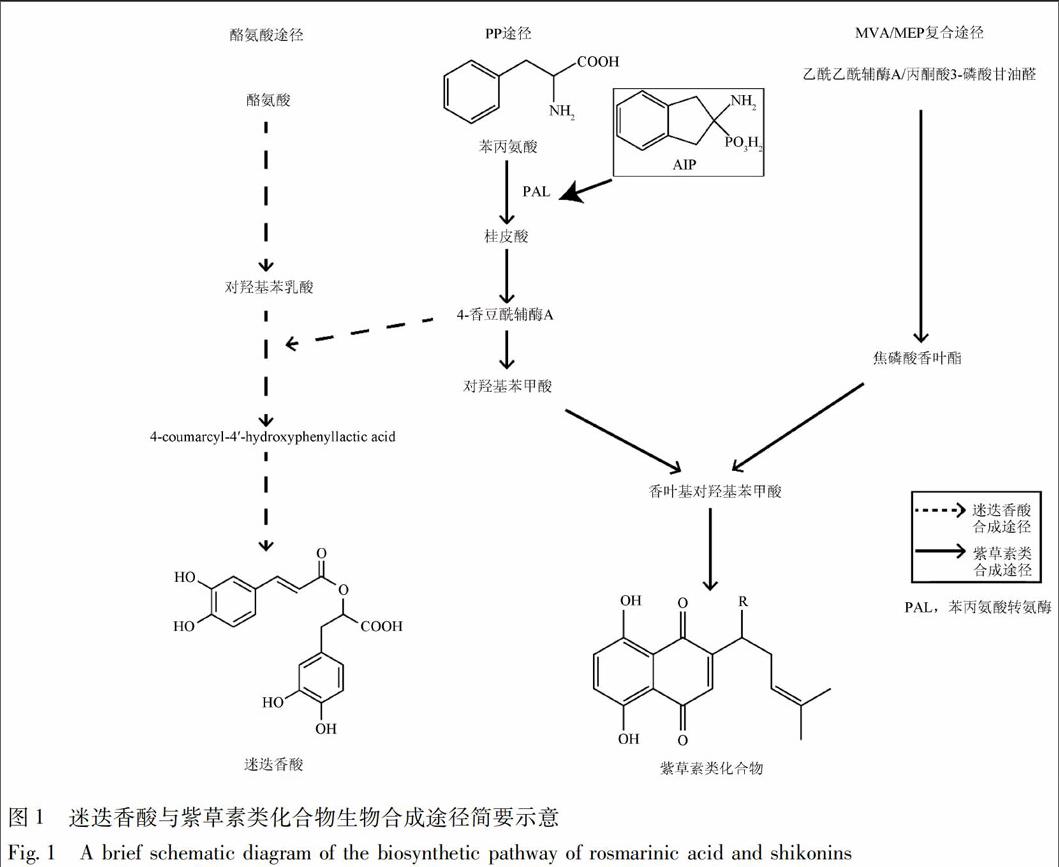
新疆紫草中主要次生代谢物包括萘醌类的紫草素类化合物,紫草呋喃等呋喃类化合物和迷迭香酸等酚酸类化合物[1],其中紫草素类化合物为其主要活性成分。通常认为紫草素类化合物生物合成途径为苯丙氨酸(PP)途径-甲羟戊酸(MVA)途径/甲基磷酸赤藓糖醇(MEP)途径的复合途径,紫草呋喃来自于紫草素类衍生物生物合成的中间产物。迷迭香酸生物合成途径在丹参、紫苏等植物中研究更为清晰,目前认为迷迭香酸生物合成途径包含了2条平行的苯丙氨酸支路和酪氨酸支路[2-4](图1)。
2-氨基磷酸茚(AIP)是一种苯丙氨酸的结构类似物,可以通过竞争性结合而特异性地抑制苯丙氨酸解氨酶(PAL)活性,从而达到对PP途径的抑制性调控[5-6]。在已有报道AIP处理可以抑制硬紫草中迷迭香酸合成[7]的基础上,本实验通过AIP处理新疆紫草红色系悬浮细胞,考察抑制PP途径对新疆紫草细胞中紫草素类化合物合成、积累的影响,探索PP途径在新疆紫草紫草素合成中发挥的作用。考虑到悬浮细胞材料本身培养状态与酶活性的不稳定,避免出现PP途径本身处于低活性状态下AIP处理后出现假阴性结果,根据文献报道茉莉酸甲酯(MeJA)可以增强PP途径活性、促进新疆紫草细胞次生代谢物合成与积累[2,8]的现象,本研究设计考察了AIP结合MeJA处理悬浮细胞后,AIP对活性上调状态下PP途径的调控作用,作为参考。
1 材料
新疆紫草愈伤细胞取自中国科学院植物研究所叶和春研究员处,并由本实验室保存并继代为悬浮细胞。
超高效液相色谱仪(UPLC):Waters ACQUITY UPLCTM系统(美国Waters公司,包括四元高压梯度泵、真空脱气机、自动进样器、柱温箱、二极管阵列检测器、Empower 3色谱工作站);UPLC Column:ACQUITY UPLC HSS T3 C18(2.1 mm × 100 mm,1.8 μm);荧光酶标仪(Thmeral,Varioskan Flash);电子精密天平(SartoriusBS2202S);球磨仪(Retsch公司,MM 400混合型球磨仪);电热干燥箱(上海恒科仪器有限公司,DHG-9145AZ);超声波清洗机(宁波新芝生物科技有限公司);及其他常规组织培养所需设备等。
AIP(购自爱拓化学有限公司,纯度97%);茉莉酸甲酯(购自Aldrich化学试剂公司,纯度95%);迷迭香酸、β,β′-二甲基丙烯酰紫草素(购自中国食品药品检定研究院),乙酰紫草素(购自上海同田生物科技公司),脱氧紫草素、异戊酰紫草素(购自日本TCI化成株式会社),纯度均 ≥ 98%;色谱纯甲醇、乙腈(购自Fisher Chemical公司);培养基配制所需试剂等为国药集团化学试剂有限公司产品。
2 方法
2.1 材料处理
参照已有报道及预实验,选定20 μmol·L-1为MeJA处理浓度,20 μmol·L-1为低浓度AIP处理,200 μmol·L-1为高浓度AIP处理。AIP,MeJA以甲醇配制成母液并稀释。以培养至第13天的新疆紫草红色系悬浮细胞为材料,分别以终浓度20 μmol·L-1AIP,200 μmol·L-1 AIP,20 μmol·L-1 AIP+20 μmol·L-1 MeJA,200 μmol·L-1 AIP+20 μmol·L-1 MeJA,20 μmol·L-1 MeJA,甲醇(CK)为6个处理组处理。于处理后0,24,48,72,96 h分别取样,真空抽滤,置平皿中于电热干燥箱40 ℃烘干。每组设3个重复。
2.2 供试品制备
精密称取0.02 g新疆紫草干细胞,研磨粉碎后加入1.5 mL甲醇,25 ℃超声提取60 min,离心,取上清液,0.22 μm滤膜过滤制样。
2.3 含量测定
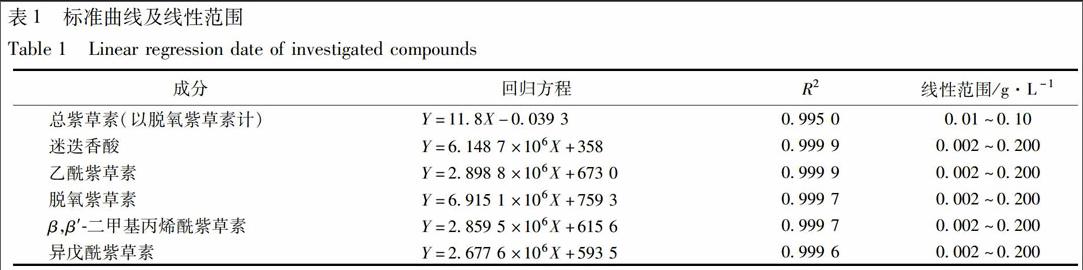
2.3.1 总紫草素测定 以脱氧紫草素标定总萘醌,测定新疆紫草细胞中紫草素类化合物的含量。以2.2项中制得供试品适量,稀释一定倍数,以紫外-可见分光光度法在520 nm处测定吸光度,按脱氧紫草素所得标准曲线(表1)计算,即得。
2.3.2 UPLC测定各成分含量 参照本实验室建立的新疆紫草次生代谢物测定方法[2],测定悬浮细胞中迷迭香酸、乙酰紫草素、脱氧紫草素、β,β′-二甲基丙烯酰紫草素、异戊酰紫草素含量。系统为ACQUITY UPLC;色谱柱为HSS T3超高效液相柱(Waters Corporation,Milford,MA,USA,2.1 mm×100 mm,1.8 μm);流动相为乙腈(A)-0.1%甲酸-水(B);梯度洗脱:10%~35% A,0~4 min;35%~60% A,4~4.3 min;60%~72% A,4.3~10 min;72%~80% A,10~11 min;流速0.5 mL·min-1,柱温30 ℃,进样量1 μL。标准曲线及线性范围见表1。
2.4 数据处理
使用Microsoft Excel 2013和OriginPro 8.0进行数据整理与处理。
3 结果与分析
3.1 各处理对新疆紫草细胞中总紫草素合成积累影响
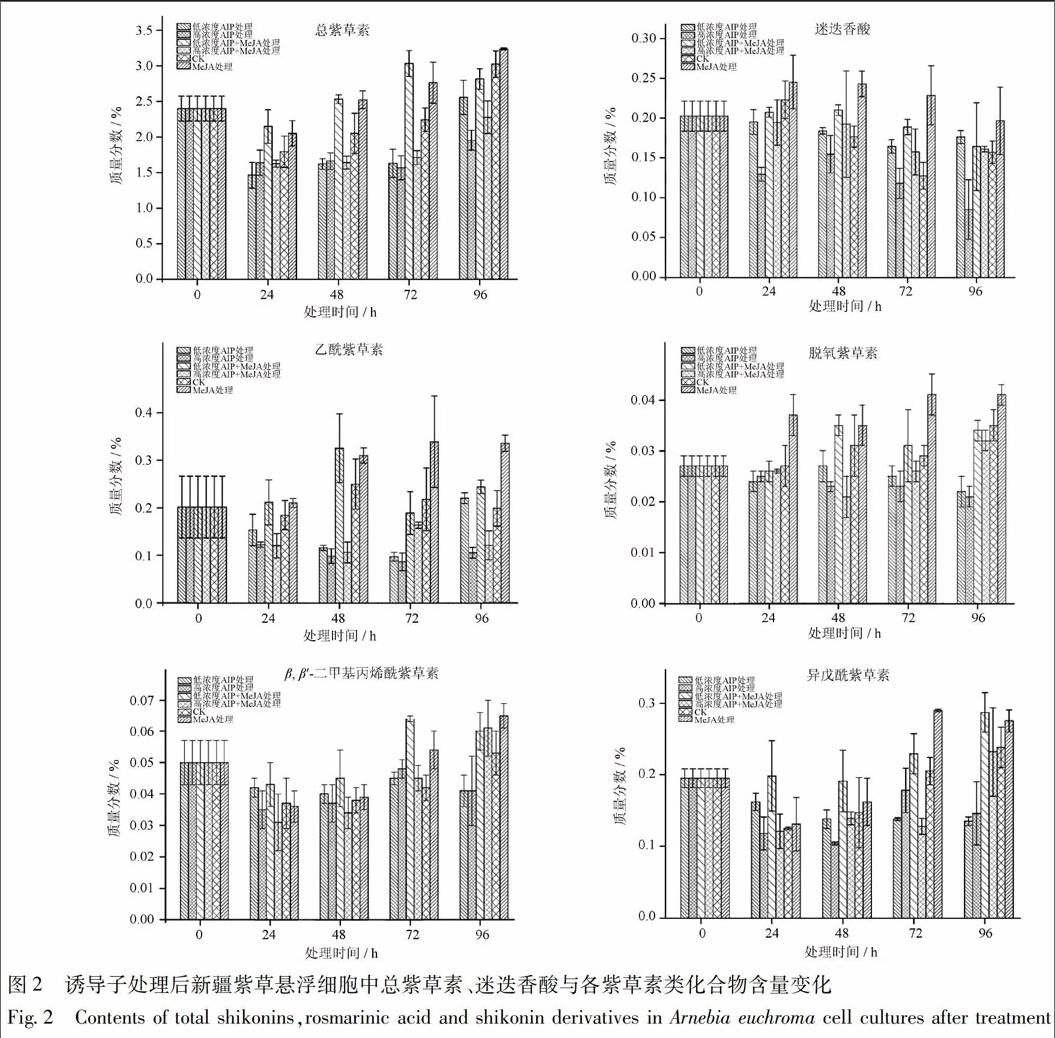
各测定结果见图2。CK组中总紫草素含量在24~96 h随时间而升高,各处理组处理24 h内即表现出相应作用。其中,MeJA可以促进新疆紫草红色系悬浮细胞中紫草素的合成与积累,与已有报道相一致,24 h取样中MeJA处理组总紫草素含量即达到2.05%,高于CK组的1.79%,且处理后72 h内促进作用随时间增强,最高时MeJA处理组相比CK组含量提高0.52%。比较AIP处理组与CK组,48 h后AIP处理组逐渐表现出明显的抑制作用,且抑制作用随时间而增强,最高时含量相差达1.08%。AIP处理组与AIP+MeJA处理组相比,后者总紫草素含量则高于前者,而AIP+MeJA处理组与MeJA处理组比较,MeJA处理组的总紫草素含量更高,表明AIP处理可以部分消除MeJA的促进作用。AIP处理组内部比较,高浓度处理组相比低浓度处理组在96 h表现出更强的抑制作用,而在72 h之前,二者并无明显差异。
3.2 各处理对新疆紫草细胞中迷迭香酸合成积累影响
对照组新疆紫草悬浮细胞中迷迭香酸含量96 h内存在先降低后升高的波动。MeJA处理可以明显提高迷迭香酸含量,最高時质量分数由0.128%提高至0.228%,增幅超过75%。迷迭香酸对AIP处理反应灵敏,高浓度AIP处理后24 h即能明显抑制细胞系中迷迭香酸的合成积累,且抑制作用随处理时间增加而增强,96 h时高浓度处理组含量0.085%相比CK组0.153%降低接近一半。低浓度AIP处理则并没有表现出明显的抑制作用,表明AIP对新疆紫草中迷迭香酸合成积累的抑制可能存在剂量相关性。AIP+MeJA处理组与CK组、MeJA单独处理组相比,AIP+MeJA处理组与CK组迷迭香酸含量基本持平,而低于MeJA单独处理组,同样表明AIP可部分抵消MeJA的促进作用。
3.3 各处理对新疆紫草细胞中各紫草素类化合物合成积累影响
乙酰紫草素、脱氧紫草素、β,β′-二甲基丙烯酰紫草素、异戊酰紫草素四类紫草素类化合物对处理的反应有所差异。其中乙酰紫草素对各处理反应最为灵敏,脱氧紫草素、异戊酰紫草素灵敏度稍低,β,β′-二甲基丙烯酰紫草素变化不明显。
乙酰紫草素对处理反应灵敏,MeJA处理24 h后即表现出促进作用,处理48 h后质量分数达到0.3%以上并保持稳定,相比CK组最高提高0.12%,提高近一半。无论低浓度AIP处理组还是高浓度AIP处理组,乙酰紫草素含量均明显低于CK组,且高浓度处理组含量均低于低浓度处理组,表明AIP对乙酰紫草素合成积累有明显的抑制作用,且抑制作用强弱可能存在剂量正相关性。低浓度AIP+MeJA处理组乙酰紫草素含量均高于AIP处理组,与CK组接近,低于MeJA处理组。而高浓度AIP+MeJA处理组含量与高浓度AIP处理组含量相近,低于低浓度AIP+MeJA处理组,表明200 μmol·L-1的AIP处理浓度对乙酰紫草素合成积累的抑制作用可能已超过20 μmol·L-1MeJA的促进作用。
脱氧紫草素与异戊酰紫草素在MeJA处理后均表现出促进作用,在AIP处理48 h后开始表现出较明显的抑制作用,且抑制作用随时间而增强。低浓度与高浓度AIP处理组相比,脱氧紫草素高浓度处理组表现出更强的抑制作用,但差别并不明显;异戊酰紫草素在处理后48 h内高浓度组比低浓度组含量更低,48 h后差异消失。AIP+MeJA处理组脱氧紫草素与异戊酰紫草素含量72 h后表现出高于AIP处理组,低于MeJA处理组的现象。
β,β′-二甲基丙烯酰紫草素对各处理反应均较迟缓,处理0~72 h内各组均未表现出明显差异,72 h后MeJA处理组开始相对CK组表现出一定促进作用,96 h后AIP处理组表现出抑制作用,且AIP+MeJA处理组β,β′-二甲基丙烯酰紫草素含量高于AIP处理组而低于MeJA单独处理组。
整体看来,迷迭香酸在AIP处理后表现出明显的合成、积累量下降现象且高浓度处理组抑制强于低浓度处理组,表明AIP处理的确对紫草悬浮细胞次生代谢的苯丙氨酸途径表现出抑制作用,进而抑制了迷迭香酸的合成与积累,且抑制作用的强弱与处理时间、处理剂量呈正相关性。在总紫草素含量分析中发现,AIP处理组相对CK组同样表现出一定的抑制作用,72 h后抑制作用表现更为明显。更进一步,不同紫草素类化合物对AIP处理在反应强度、敏感性上表现有较大差异,其中乙酰紫草素对抑制作用表现尤为明显;脱氧紫草素与异戊酰紫草素反应相似,弱于乙酰紫草素;β,β′-二甲基丙烯酰紫草素AIP处理组相对CK组没有表现出明显的抑制作用,但可以部分抵消MeJA的促进作用。探讨上述现象出现的原因,笔者初步认为可能与各成分在细胞中含量、生理所用及细胞的自我调控有关。即,紫草细胞本身可能仅需要一定量的某种成分来维持自身生理功能,而此成分自身含量与需求量相接近,则该成分的合成积累会在各种调控下表现出更强的稳定性,如β,β′-二甲基丙烯酰紫草素;而有的成分自身需求量较高,且其含量高于自身需求量,则对各种调控的反应可能会更为敏感,如乙酰紫草素等,但出现此现象的真正内在原因与其具体调控机制尚需进一步深入研究。
4 讨论
由于新疆紫草紫草药用及工业上的价值,近年来被大量采集,加上本来就分布狭窄,资源严重受损[9],而利用细胞培养、微生物合成等生物工程技术生产紫草素是当前解决紫草素供应问题的重要研究方向,近年来在紫草细胞系培养调控、功能基因鉴定[10-12]等方面研究已有很多进展。
苯丙氨酸途径在植物次生代谢中有重要作用,与水杨酸、黄酮、萜类等的合成密切相关。而AIP作为苯丙氨酸途径中关键酶PAL的特异性抑制剂,通过AIP处理调节PP途径的代谢,进而探索该通路在植物整体次生代谢中的作用也有相关报道,如Ren等[13]利用AIP处理抑制经PP途径合成的水杨酸合成,考察内生菌在白术根腐病保护方面的作用;王逸文等[14]考察了AIP与MeJA处理对高山红景天愈伤组织生长和红景天苷积累的影响,发现AIP处理可控制PP途径碳流,间接提高其他通路碳流量,提高红景天苷的合成等。
本研究通过结合AIP与MeJA处理,考察AIP对新疆紫草悬浮细胞中PP途径的抑制作用带来的次生代谢物合成积累的变化,为进一步了解新疆紫草中PP途径在紫草素合成中的功能及特性奠定基础,同时还可为各代谢途径之间的相互作用以及代谢通路的代谢分流等问题的研究提供参考。本研究中选用高、低2种AIP处理浓度,发现AIP的抑制作用与处理浓度、处理时间有正相关性,但具体的量效、时效关系仍有待进一步研究。同时AIP与MeJA等诱导子间的相互作用关系也有待进一步挖掘。
[参考文献]
[1] 詹志来,胡峻,刘谈,等.紫草化学成分与药理活性研究进展[J].中国中药杂志,2015,40(21):4127.
[2] Wang S, Guo L P, Xie T, et al. Different secondary metabolic responses to MeJA treatment in shikonin-proficient and shikonin-deficient cell lines from(Royle) Johnst[J]. Plant Cell Tiss Org Cult,2014,119(3):587.
[3] 王升,李璇,蔣超,等.紫草素及其衍生物合成相关基因及信号传导研究进展[J].中草药,2012(6):1219.
[4] 宋婕.丹参迷迭香酸合成途径相关基因的功能研究[D].西安:陕西师范大学,2010.
[5] Zoń J, Miziak P, Amrhein N, et al. Inhibitors of phenylalanine ammonia-lyase (PAL): synthesis and biological evaluation of 5-substituted 2-aminoindane-2-phosphonic acids[J]. Chem Biodiver, 2005,2(9):1187.
[6] Appert C, Zon J, Amrhein N. Kinetic analysis of the inhibition of phenylalanine ammonia-lyase by 2-aminoindan-2-phosphonic acid and other phenylalanine analogues[J]. Phytochemistry,2003,62(3):415.
[7] Gaisser S, Heide L. Inhibition and regulation of shikonin biosynthesis in suspension cultures of Lithospermum[J]. Phytochemistry,1996,41(4):1065.
[8] Hao H, Lei C, Dong Q, et al. Effects of exogenous methyl jasmonate on the biosynthesis of shikonin derivatives in callus tissues of Arnebia euchroma[J]. Appl Biochem Biotechnol,2014,173(8):2198.
[9] 王升,李璇,周良云,等.新疆紫草繁育生物学及人工栽培[J].中国现代中药,2011,13(11):18.
[10] 刘谈,吕朝耕,王升,等.基于新疆紫草转录组的对羟基苯甲酸香叶基转移酶(PGT)基因的挖掘及生物信息学分析[J].中国中药杂志,2016,41(8):1422.
[11] 王升, 谢腾, 叶和春,等.新疆紫草2种悬浮细胞生长及紫草素类化合物积累的动力学研究[J].中国中药杂志,2013,38(8):1138.
[12] 黄文虎,葛锋,刘迪秋,等.紫草素及其衍生物的调控策略[J].中国生物工程杂志,2010,30(11):100.
[13] Ren C G, Chen F, Dai C C. Fungal endophyte protects Atractylodes lancea from root rot caused by Fusarium oxysporum[J]. Plant Pathol,2016,doi: 10.1111/ppa.12567.
[14] 王逸文,胡高升,贾景明.2-氨基磷酸茚和茉莉酸甲酯对高山红景天愈伤组织生长和红景天苷积累的影响[J].沈阳药科大学学报,2012(9):718.
[责任编辑 吕冬梅]

