离体法及在体法对黄连水煎液中肠吸收多成分的初步研究
刘洋+隗丽+李雪莲+潘孟+王子禹+董玲

[摘要] 药物药效的发挥与其在机体内始终处在吸收、分布、代谢、排泄这种动态变化的过程密不可分,而吸收作为口服药物进入机体的首要环节格外受到重视。中药作为多成分与多靶点的药物,单一成分的性质与其在多成分环境中所表现出来的性质会有差别。该文以黄连提取物中的生物碱为主要研究对象,建立黄连中生物碱成分含量测定的分析方法。并通过离体翻转肠囊实验及肠道灌流并行采血实验初步锁定黄连水提液中可透过肠壁吸收并吸收入血的成分,为后续对黄连多成分的吸收代谢研究提供数据参考与支持。
[关键词] 黄连水煎液;多成分;离体法;在体法;中药生物药剂学分类系统
In vitro and in vivo intestinal absorption of Huanglian decoction in
multi-component environment
LIU Yang,WEI Li,LI Xue-lian,PAN Meng,WANG Zi-yu,DONG Ling*
(Beijing University of Chinese Medicine,Beijing 100102,China)
[Abstract] The effect of drugs in the body is always inseparable with the dynamic processes of absorption, distribution, metabolism and excretion. For oral drug, absorption, as the first link to enter the body, is particularly valued. Traditional Chinese medicine has multiple components and multiple targets, and the nature of its single composition is different from that in the multicomponent environment. Alkaloids in Huanglian extract was used as the main object in this study to establish an analytical method for determining the content of alkaloids in Huanglian. In addition, the compositions of the Huanglian aqueous extract solution which can be absorbed through intestinal wall into blood, were initially determined by the means of everted gut sac and in intestinal perfusion with venous sampling experiment. This paper can provide data reference and support for the further study on the absorption and metabolism of Huanglian.
[Key words] Huanglian decoction; multiple components; in vitro; in vivo;biopharmaceutics classification system of chinese materia medica
中药多成分多靶点显效的特点已被广泛认同,且近年来质效关联等理念在中药质量控制方面的应用已日渐深入,综合考虑中药特点及其临床疗效进行质量控制及评价成为研究热点。药物药效的发挥与其在机体内始终处在吸收、分布、代谢、排泄这种动态变化的过程密不可分,而吸收作为口服药物进入机体的首要环节格外受到重视。根据 BCS 在生物药剂学研究范围中指向于药物吸收的特征,并结合中药多成分的复杂性与临床疗效实际,课题组提出的“中药生物药剂学分类系统”(biopharmaceutics classification system of chinese materia medica,CMMBCS)[1]将 BCS 以吸收为核心的分类理念贯彻,并遵循定性为先、定量跟进的研究思路,以吸收与否为界,分别定性与定量研究吸收成分与非吸收成分,并做CMMBCS分类。
在定性研究时,中药成分的吸收完全是一个动态过程,首先要在此过程中对要吸收的目标成分进行锁定,其次再充分考虑多成分环境下其他成分对目标成分的影响。然后再对吸收成分的吸收程度进行系统分析和定量研究,对可吸收成分的溶解性和肠渗透性数据进行科学归类,并通过建立溶出度和溶解度的关联关系而完善CMMBCS。基于“多成分层次差异比较法”的理论,课题组前期已经对葛根芩连方中君药葛根的主要成分葛根素进行了多成分环境下的模拟研究[2-3],及臣药黄连的主要成分小檗碱在黄连水煎液多成分环境下的CMMBCS研究[4]。本文在前期研究基础上,采用离体法及在体法,深入到中药整体肠吸收的目标成分锁定,为多成分环境对目标成分的影响研究及后续的CMMBCS分类提供研究基础,同时也为其他中药CMMBCS的定性研究提供参考依据。
黄连在中医药传统方剂中使用广泛,《伤寒论》在12方中均用到黄连,约占同时期方数的86%[5],据统计,宋以前13部方书中含黄连的方剂约为5%[6]。近年来,黄连降血脂、降血糖及抗癌等疗效的深入研究以及新发现,引起了人们的广泛关注。有研究[7]考察了小檗碱在黄连解毒汤模拟体系及全方中的肠吸收情况,发现在模拟体系及全方中小檗碱的吸收显著增加,也从侧面说明了复杂环境中的成分对小檗碱确有影响,也显现出了复方的优势。Yan等[8]对口服黄连和左金丸后血中的小檗碱、巴马汀和药根碱的药代动力学进行了研究,在這2种给药方式中每个成分的药代动力学曲线都不同,也说明了不同多成分环境对目标成分的吸收代谢等行为有着不同的影响。因此,更进一步地对黄连多成分的吸收进行研究,有重要的参考价值。
1 材料
1.1 仪器
LC-20AT高效液相色谱仪(SPD-20A型紫外检测器,SIL-20A自动进样器,日本岛津公司);BT-25S电子分析天平(北京赛多利斯仪器有限公司);DZKW-4电热恒温水浴锅(北京中兴伟业仪器有限公司);98-1-B型电子调温电热套(天津市泰斯特仪器有限公司);KH7200DB型数控超声波清洗器(昆山超声仪器有限公司);STARTER 2100实验室pH计(奥豪斯仪器上海有限公司);蠕动泵驱动器(BT100-1F,保定兰格恒流泵有限公司);注射泵(LSP02-1B,保定兰格恒流泵有限公司);高速冷冻离心机(SIGMA,德国)。
1.2 药物与试剂
盐酸小檗碱对照品(批号110713-201212,中国食品药品检定研究院);木兰花碱对照品(批号M2903S1,上海源叶生物科技有限公司);非洲防己碱对照品(批号Y13M6W1,上海源叶生物科技有限公司);表小檗碱对照品(批号H25F3X1,上海源叶生物科技有限公司);盐酸药根碱对照品(批号Z15T4B1,上海源叶生物科技有限公司);盐酸黄连碱对照品(批号ZS0924BE14,上海源叶生物科技有限公司);盐酸巴马汀对照品(批号KS0922CF14,上海源叶生物科技有限公司);盐酸小檗碱原料(批号130808,陕西中鑫生物技术有限公司);乙腈(色谱级,美国Fisher公司);纯净水(娃哈哈集团公司);黄连药材购于北京同仁堂,经北京中医药大学王晶娟副教授鉴定为毛茛科植物黄连Coptis chinensis Franch.的干燥根茎;其他试剂均为分析纯。
1.3 动物
SD大鼠,雄性,体重200~250 g,北京维通利华试验动物技术有限公司提供,许可证号SCXK(京)2014-0004。
2 方法
2.1 溶液的制备
2.1.1 对照品溶液的配制
2.1.1.1 盐酸小檗碱对照品溶液的配制 精密称定盐酸小檗碱对照品适量置于5 mL量瓶中,加甲醇溶解并定容至刻度,摇匀后得盐酸小檗碱储备液,精密移取1 mL盐酸小檗碱储备液置于25 mL量瓶中,加甲醇稀释并定容至刻度,摇匀后得盐酸小檗碱对照品溶液。
2.1.1.2 混合对照品溶液的配制 分别精密称定木兰花碱、非洲防己碱、表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸巴马汀、盐酸小檗碱对照品适量置于5 mL量瓶中,加甲醇溶解并定容至刻度,摇匀后得各对照品储备液。精密移取木兰花碱、非洲防己碱、表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸巴马汀、盐酸小檗碱对照品溶液适量置于同一10 mL量瓶中,加甲醇稀释并定容至刻度,摇匀备用,得混合对照品母液。
2.1.2 供试品溶液的制备
精密称取黄连粉末(过60目筛)0.2 g,精密称定,加50 mL甲醇-盐酸(100∶1),称定质量,加热回流提取30 min,放冷,再称定质量,用甲醇补足失重,摇匀,滤过,取续滤液,精密移取续滤液2 mL置于10 mL量瓶中,加甲醇稀释并定容至刻度,摇匀,即得供试品溶液。
2.1.3 Krebs-Ringer′s营养液(K-R液)
称取NaCl 7.80 g,KCl 0.35 g,CaCl2 0.37 g,NaHCO3 1.37 g,NaH2PO4 0.32 g,MgCl2 0.02 g,葡萄糖1.40 g;加蒸馏水定容至1 000 mL,调节pH到7.39~7.41,放置备用。
2.1.4 黄连水煎液的制备
取适量黄连药材加10倍量水,常温浸泡30 min,煎煮保持微沸30 min,趁热滤過;药渣加8倍量的水煎煮保持微沸30 min,趁热滤过,合并2次滤液,浓缩,冷至常温,加水定容得生药质量浓度为60 g·L-1的黄连水煎液。
2.1.5 灌流液制备
取黄连水煎液用K-R液稀释至生药浓度为3 g·L-1的灌流液。
2.2 含量测定方法的建立
2.2.1 色谱条件与适用性试验
2.2.1.1 最大吸收波长的确定 分别取2.1项下供试品溶液与盐酸小檗碱对照品溶液,适当稀释后,在200~600 nm进行紫外扫描。
2.2.1.2 色谱条件 Waters Atlantis T3色谱柱(4.6 mm×250 mm,5 um);检测波长265 nm;流速0.6 mL·min-1;柱温30 ℃;进样量10 μL;流动相乙腈(A)-水(B,含0.3%磷酸,0.5%三乙胺,调pH 3.0),梯度洗脱(0~2 min,13%A;2~4 min,13%~20%A;4~50 min,20%~25%A;50~55 min,25%~30%A;55~63 min,30%~70%A;63~65 min,70%~95%A;65~70 min,95%~13%A;70~80 min,68%~13%A)。
2.2.2 供试品溶液制备方法的确定
分别对提取方法、提取溶剂、提取溶剂用量、提取时间进行考察。通过超声提取、加热回流提取及加热回流后超声提取,筛选制备黄连供试品溶液的方法;通过水、水-盐酸(100∶1)、甲醇、甲醇-盐酸(100∶1)、乙醇、乙醇-盐酸(100∶1)条件筛选提取溶剂制备黄连供试品溶液;通过25,50,75 mL筛选溶剂用量制备黄连供试品溶液;通过30,60,90 min筛选提取时间制备黄连供试品溶液。
2.2.3 方法学考察
2.2.3.1 标准曲线制备 精密移取2.1.1项下混合对照品母液0.15,0.25,0.50,0.75,1.0,2.0 mL分别置于5 mL量瓶中,加甲醇稀释并定容至刻度,摇匀,配制成一系列浓度的混合对照品溶液。过0.22 μm微孔滤膜,精密吸取上述溶液10 μL注入液相色谱仪,记录峰面积。分别以木兰花碱、非洲防己碱、表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸巴马汀、盐酸小檗碱各对照品溶液的浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线并进行回归。
2.2.3.2 精密度试验 取混合对照品溶液,按上述色谱条件分别重复进样6次,测定峰面积。
2.2.3.3 重复性试验 取同一批黄连粉末(过60目筛)6份,按2.1.2项下方法操作,平行制备6份供试品溶液,按上述色谱条件测定峰面积。
2.2.3.4 稳定性试验 精密吸取新配制的供试品溶液,分别在0,2,4,8,12,24 h按上述色谱条件测定峰面积。
2.2.3.5 加样回收率试验 精密称取黄连粉末0.1 g,分别加入精密称定的7种生物碱对照品,按2.1.2项下方法操作,平行操作6份,按上述色谱条件测定峰面积并计算加样回收率。
2.3 离体法及在体法对黄连水煎液中肠吸收多成分研究
2.3.1 大鼠离体翻转肠囊研究
大鼠禁食不禁水12~18 h,腹腔注射10%水合氯醛麻醉,打开腹腔,迅速取出约(10±2) cm 长各肠段(十二指肠、空肠、回肠及结肠),将大鼠肠管与肠系膜剥离,生理盐水冲洗干净后将肠段翻转,使黏膜层在外,浆膜层在内,用手术线结扎肠段一端形成囊状。向小囊中加入2 mL空白Krebs-Ringer′s营养液,将肠囊置于含药营养液的锥形瓶中,并置于水浴锅中37 ℃保温。期间向锥形瓶中持续通入氧及二氧化碳的混合气体以保持离体肠囊的活性。60 min后取出肠囊内液体,0.45 μm微孔滤膜过滤,注入高效液相色谱仪进行检测。
2.3.2 肠道灌流并行采血研究
大鼠禁食不禁水12~18 h,腹腔注射10%水合氯醛麻醉,右侧颈静脉插管连接到蠕动泵进行供血。打开腹部,选取肠段,用37 ℃的生理盐水冲洗干净,结扎实验用肠段以外的血管。对所取灌流肠段对应的肠系膜静脉插管,并连接到蠕动泵,收集肠系膜静脉流出血液。肠段进口端与注射泵相连,将注射泵流速调为0.2 mL·min-1,灌流药液,约30 min后吸收达到稳定状态。开始计时收集流出的药液和血液。每隔15 min更换肠液和血液的收集管,采用质量法进行水分校正。试验结束后,用生理盐水冲洗肠段,将所用肠段剪下,测量其长度和内径,并处死大鼠。所取血液样品3 500 r·min-1离心15 min,取上层血浆,加入3倍量的甲醇沉淀蛋白,涡旋2 min,1万r·min-1离心15 min,取上清液氮吹至干后200 μL甲醇复溶,1万 r·min-1离心10 min,取上清液注入高效液相色谱仪进行检测;灌流液样品经适当稀释后过0.45 μm的微孔滤膜过滤,注入高效液相色谱仪进行检测。
2.4 数据分析[9]
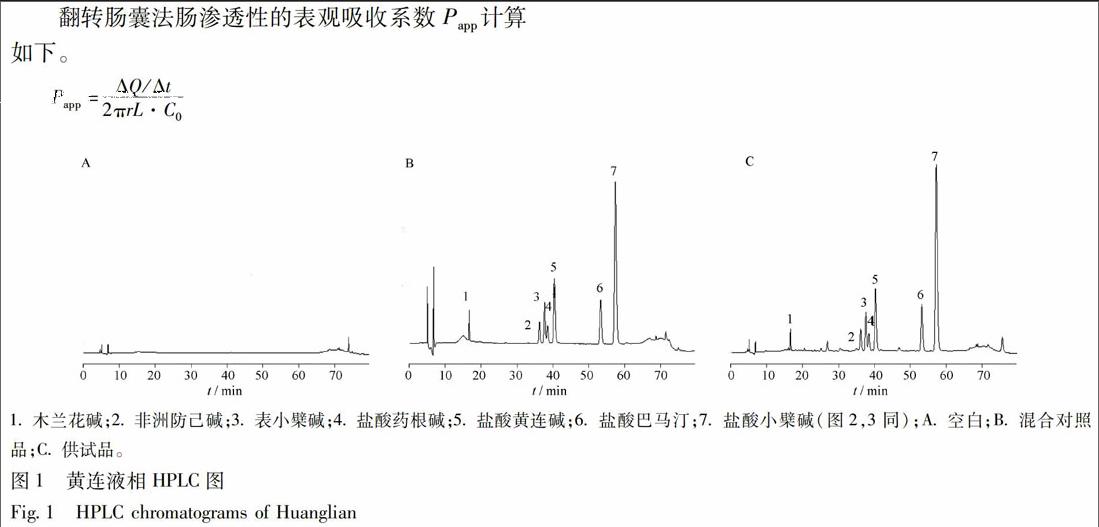
翻转肠囊法肠渗透性的表观吸收系数Papp计算如下。
Papp=ΔQ/Δt2πrL·C0
C0为小檗碱初始浓度(mg·L-1);ΔQ/Δt为60 min内肠囊内溶液中小檗碱的量(μg·s-1);L为肠段长度(cm);r为肠半径(cm)。
3 结果
3.1 黄连多成分HPLC图的建立
3.1.1 黄连多成分HPLC图
结果显示,盐酸小檗碱对照品溶液在429,349,265,230 nm处有吸收,黄连供试品溶液在435,348,265,228 nm处有吸收,由于在348 nm处样品吸收干扰较小,应选择348 nm作为检测波长。但是,在液相图谱中,265 nm波长下色谱峰较多,尤其是木兰花碱色谱峰在348 nm波长下无吸收,而在265 nm波长下能检测到。因此,本实验选择265 nm为检测波长来同时测定多个生物碱的含量。
在2.2.1.2色谱条件下,系统适应性良好,见图1。
3.1.2 黄连供试品溶液
最终确定用50 mL甲醇-盐酸(100∶1)加热回流提取30 min时提取效果最好,且有良好的重复性。
3.1.3 方法学分析
结果表明,本方法线性良好,仪器精密度及方法重复性良好,样品在24 h内稳定,加样回收率99.53%~104.0%,RSD均小于3.0%。
3.2 黄连水煎液离体法的肠吸收测定
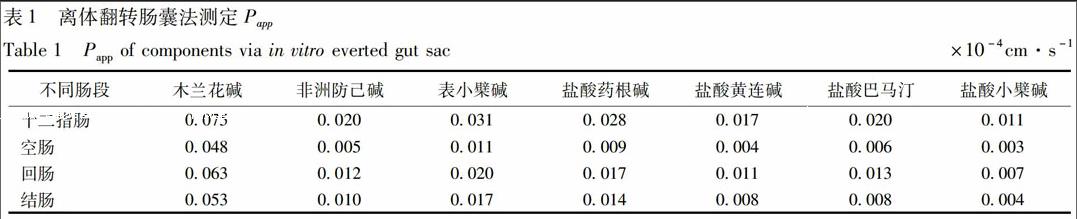
黄连水煎液离体翻转肠囊实验中空白K-R试液、经适当稀释后的黄连水煎液以及肠囊中样品测定图谱见图2,空白K-R液对各肠段测定无干扰。肠渗透系数Papp计算结果见表1。
由以上结果可知,黄连水煎液中有7个生物碱类成分均能透过肠壁吸收,但在各肠段吸收程度各不相同,总体而言,各生物碱以十二指肠吸收为最好,其次是回腸、结肠,空肠吸收最差。
3.3 黄连水煎液在体法的肠吸收测定
黄连水煎液大鼠在体实验中血液样品定性测定结果见图3,空白血浆对样品测定无干扰。
由以上结果可知,在翻转肠囊实验中吸收入肠的成分在血液样品中同样能够检测到,但与灌流原液相比,入血含量微量。
4 讨论
离体翻转肠囊法可用于初步研究药物的肠吸收情况,尤其是药物在不同肠段的吸收差异,也可用于生物膜转运机制的研究。该法是从体积相对较小的浆膜内取液进行测定以考察药物透过肠壁吸收的量,对于溶解性较差的药物的检测尤其适用。由于离体肠组织活性的限制,除了在操作过程中持续供氧以外,取样时间也不宜过长[10-11]。本研究中采用离体法考察了黄连水煎液在不同肠段内的吸收情况,结果检测到7个生物碱成分能入肠吸收,分别为木兰花碱、非洲防己碱、表小檗碱、盐酸药根碱、盐酸黄连碱、盐酸巴马汀和盐酸小檗碱。通过计算发现此类成分的表观渗透系数Papp数量级在10-5~10-6级别,渗透性较差,其中木兰花碱在各个肠段内的吸收均比其他成分好,而其他成分的吸收情况相差不大,推测可能是由于结构不同所致,其中木兰花碱为阿朴菲型生物碱,而其他成分为原小檗碱型生物碱,也可能是在多成分环境中相互影响而致,具体需要通过单成分及成分配比等进一步研究。
离体实验中成分需要透过肌肉层和基底膜层才能进入肠囊,且肠囊内液体停滞不动,与生理条件不同,适于初步定性研究。鉴于此,为了更真实的反映药物的吸收情况,还需要通过在体法进一步考察透过肠壁吸收的成分能否吸收进入血液循环。大鼠肠灌流并行采血法保证了实验动物的组织器官完整,更为接近体内状态,以药物实际入血量为其吸收的量,更能真实反映药物真正吸收进入肝门静脉的情况[12-13]。本文中采用该法进行肠吸收入血的定性研究,结果显示上述7个成分均能入血吸收,但检测到的成分含量均较少,具体入血含量的多少需要进一步定量分析。
目前对中药单一成分的吸收、分布、代谢、排泄研究较多,中药作为多成分与多靶点的药物,是一个复杂的系统,其中单一成分的性质与其在多成分环境中所表现出来的性质会有差别。CMMBCS的研究分为定性研究和定量研究2个层次,中药多成分研究所面临的问题是在研究工作前期,中药中的“多成分组成未知”,所以在 CMMBCS 研究中应以吸收与否为界,分别定性研究吸收成分与非吸收成分。本文采用离体法及在体法对黄连水煎液中肠吸收多成分做初步研究,通过单一成分与提取物环境中各成分的吸收参数的比较,可解释多成分环境对药物吸收的影响并描述中药的吸收特征,进一步说明中药的科学性及合理性,为CMMBCS开展多成分的研究提供参考及示范,有利于对之后整个中药或者复方的吸收及代谢研究提供数据支持,同时也为中药进行质量评价及质量控制提供了新的研究思路,对实现中药现代化具有重要意义。
[参考文献]
[1] 刘洋,隗丽,董玲,等.多成分体系下中药生物药剂学分类系统的构建分析[J]. 中国中药杂志,2014, 39(23): 4479.
[2] 侯成波,汪国鹏,张强,等. 中药生物药剂学分类系统中多成分环境对葛根素溶解度的影响[J]. 中国中药杂志,2014, 39(23): 4499.
[3] 隗丽,汪国鹏,董玲,等. 中药生物药剂学分类系统的多成分溶出评价方法在葛根芩连片中的应用[J]. 中国中药杂志,2014, 39(23): 4494.
[4] 隗丽,朱美玲,董月柳,等. 盐酸小檗碱在黄连水煎液中的生物药剂学分类系统属性研究[J]. 中国中药杂志,2016, 41(7): 1192.
[5] 陳西平.影响黄连在复方中功效发挥方向的多因素研究[D]. 成都:成都中医药大学,2011.
[6] 陈馥馨,高晓山.含黄连方剂及黄连配伍药的文献统计[J]. 中成药, 1997(8): 40.
[7] 张燕, 朱华旭, 郭立玮. 在体单向肠灌流模型研究小檗碱及其在复方配伍环境中的大鼠肠吸收特性[J]. 药学学报,2012, 47(2): 233.
[8] Yan R, Wang Y, Liu Y P, et al. Comparative pharmacokinetics of berberine, palmatine and jatrorrhizine in rat plasma after oral administration of Rhizoma Coptidis and Zuojinwan using liquid chromatography-tandem mass spectrometry [J]. Iran J Pharm Res, 2012, 11(3): 949.
[9] Li H, Dong L, Liu Y, et al. Comparison of two approaches of intestinal absorption by puerarin [J]. J Pharm Toxicol Methods, 2014, 70(1):6.
[10] Barthe L, Bessouet M, Woodley J F, et al. The improved everted gut sac: a simple method to study intestinal P-glycoprotein [J]. Int J Pharm, 1998, 173: 255.
[11] Alam M A, Al-Jenoobi F I, Al-Mohizea A M. Everted gut sac model as a tool in pharmaceutical research: limitations and application [J]. J Pharm Pharmacol, 2012, 64(3): 326.
[12] Cummins C L, Salphati L, Reid M J, et al. In vivo modulation of intestinal CYP3A metabolism by P-glycoprotein: studies using the rat single-pass intestinal perfusion model [J]. J Pharmacol Exp Ther, 2003, 305(1): 306.
[13] Zhang L, Lin G, Chang Q, et al. Role of intestinal first-pass metabolism of baicalein in its absorption process [J]. Pharm Res, 2005, 22(7): 1050.
[责任编辑 孔晶晶]

