高迁移率族蛋白B 1在三阴性乳腺癌中的表达及与临床特征的关系研究
秦文华,杨宝军,张芳,张明芳
平煤神马医疗集团总医院病理科,河南 平顶山 467000
乳腺癌是女性常见的恶性肿瘤之一,具有高度的异质性,严重威胁女性身心健康。调查显示,中国每年女性乳腺癌新增病例高达200万例,占女性恶性肿瘤的1/4以上,且近年来发病率呈明显上升趋势。研究发现,乳腺癌均起源于乳腺导管上皮及腺上皮组织,但不同类型的乳腺癌预后存在明显的异质性。随着基因技术的发展,专家从分子表型对乳腺癌进行了分类,即Luminal A型、Luminal B型、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过表达型、三阴性乳腺癌。虽然临床上三阴性乳腺癌占比较小,约为15%,但其具有侵袭性强、发病早、复发率高、转移率高、预后差的特点,而且没有确定的分子靶点,给其治疗带来了一定的难度。因此,寻找新的分子靶点,对于改善三阴性乳腺癌的疗效及预后具有重要意义。近年研究发现,高迁移率族蛋白 B1(high mobility group box 1,HMGB1)在乳腺癌中高表达,认为其可能与肿瘤的发生、增殖、侵袭及转移相关。因此,本研究探讨HMGB1在三阴性乳腺癌中的表达及与患者临床特征的关系,以期为寻找治疗三阴性乳腺癌的新分子靶点提供参考,现报道如下。
1 对象与方法
1.1 研究对象
选取2017年1月至2020年1月平煤神马医疗集团总医院收治的98例三阴性乳腺癌患者作为研究对象。纳入标准:①经病理组织学、细胞学、影像学等检查确诊为三阴性乳腺癌;②年龄18~80岁;③采取手术治疗,且手术前未进行其他抗肿瘤治疗;④临床资料齐全,石蜡组织完整。排除标准:①合并重要器官功能障碍;②合并其他恶性肿瘤;③妊娠期或哺乳期女性。98例三阴性乳腺癌患者中,年龄≤50岁38例,﹥50岁60例;伴有淋巴结转移55例,无淋巴结转移43例;肿瘤直径:≤35 mm 40例,﹥35 mm 58例;临床分期:Ⅰ~Ⅱ期42例,Ⅲ~Ⅳ期56例;组织学分级:Ⅰ~Ⅱ级41例,Ⅲ级57例;绝经61例,未绝经37例;有脉管侵犯29例,无脉管侵犯69例。本研究经医院伦理委员会审批通过,所有患者及家属均对本研究知情并签署知情同意书。
1.2 三阴性乳腺癌诊断标准
根据免疫组织化学法检测的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2的表达情况,三者均为阴性则确定为三阴性乳腺癌。ER、PR均定位于细胞核,以10%肿瘤细胞出现黄褐色颗粒为阳性。HER2定位于细胞膜,根据细胞膜染色程度进行判定,0:无细胞膜染色;+:﹤10%的细胞膜弱染色,且呈间断分布;++:10%~30%的细胞膜存在弱到强染色,且强性染色环绕整个细胞膜;+++:﹥30%的细胞膜呈强染色;染色程度0~+判定为阴性,++~+++判定为阳性。
1.3 检测方法
收集患者肿瘤组织及癌旁正常组织石蜡块进行组织切片,采用免疫组织化学法检测组织中HMGB1的表达情况。具体过程如下:①将石蜡包埋的三阴性乳腺癌组织和癌旁正常组织用切片机连续切片,厚度约3 μm,将准备好的玻片涂抹上0.01%多聚赖氨酸,再将切片置在玻片上,60~62℃烤片3 h,之后放置在37℃的恒温箱中保存,待第二天染色。②切片常规脱蜡,用纯化水冲洗5 min,再用磷酸盐缓冲液(phosphate buffered solution,PBS)清洗3次,每次3 min。③抗原修复,将抗原修复液(Tris-EDTA)在95~100℃的水浴锅中预热,将切片浸泡在修复液中并预热15 min,然后取出冷却至室温后,用PBS冲洗3次,每次3 min。之后将切片置于3%双氧水(HO)中10 min,目的是阻断内源性HO酶,再次用PBS冲洗3次。④滴加抗体孵育,配置工作浓度的第一抗体(Anti-HMGB1),室温孵育2 h,PBS冲洗3次。一抗用PBS代替作为阴性对照。⑤加入二抗goat anti-rabbit IgG-HRP(ab6721),室温孵育1 h,用PBS冲洗5次。⑥二氨基联苯胺(diaminobenzidine,DAB)染色,将切片置入新鲜配置的DAB显色液中染色2 min,用纯化水冲洗2 min,加入苏木素复染核2 min,用中性树胶封片,待统一镜检。
1.4 结果判定
HMGB1阳性染色为细胞核或细胞质内有棕黄色或黄褐色颗粒,且定位明确、结构清晰。每张切片在荧光显微镜下随机选取5个视野,对阳性细胞染色程度及阳性细胞所占比例进行评分。染色程度:切片无染色或接近背景色计为0分,切片染色为浅黄色且略深于背景色计为1分,切片染色为棕黄色且明显深于背景色计为2分,切片染色为深棕黄色计为3分。阳性细胞所占比例:无阳性细胞计为0分,阳性细胞所占比例﹤10%计为1分,10%~50%计为2分,51%~75%计为3分,﹥75%计为4分。根据切片染色程度评分和阳性细胞所占比例评分的乘积对结果予以判定:阴性(-)0~2分,弱阳性(+)3~4分,中度阳性(++)5~8分,强阳性(+++)9~12分;分数≥3分定义为阳性,分数﹤3分定义为阴性。结果由同一组具有高级职称的医师采用双盲法阅片,意见不统一且协商不一致时,由上级医师判定。
1.5 统计学分析
采用SPSS 22.0软件对数据进行分析,计数资料以例数及率(%)表示,组间比较采用χ检验,以P﹤0.05为差异有统计学意义。
2 结果
2.1 HMGB 1表达情况的比较
HMGB1在三阴性乳腺癌组织中的阳性表达率为66.33%(65/98),明显高于癌旁正常组织的27.55%(27/98),差异有统计学意义(χ=29.580,P﹤0.01)。
2.2 不同临床特征的三阴性乳腺癌患者肿瘤组织中HMGB 1表达情况的比较
有淋巴结转移、组织学分级为Ⅲ级、Ki-67≥14%的三阴性乳腺癌患者的肿瘤组织中HMGB1阳性表达率分别高于无淋巴结转移、组织学分级为Ⅰ~Ⅱ级、Ki-67﹤14%的患者,差异均有统计学意义(P﹤0.05)。不同年龄、肿瘤直径、临床分期、月经状态及脉管侵犯情况的三阴性乳腺癌患者的肿瘤组织中HMGB1阳性表达率比较,差异均无统计学意义(P﹥0.05)。(表1)
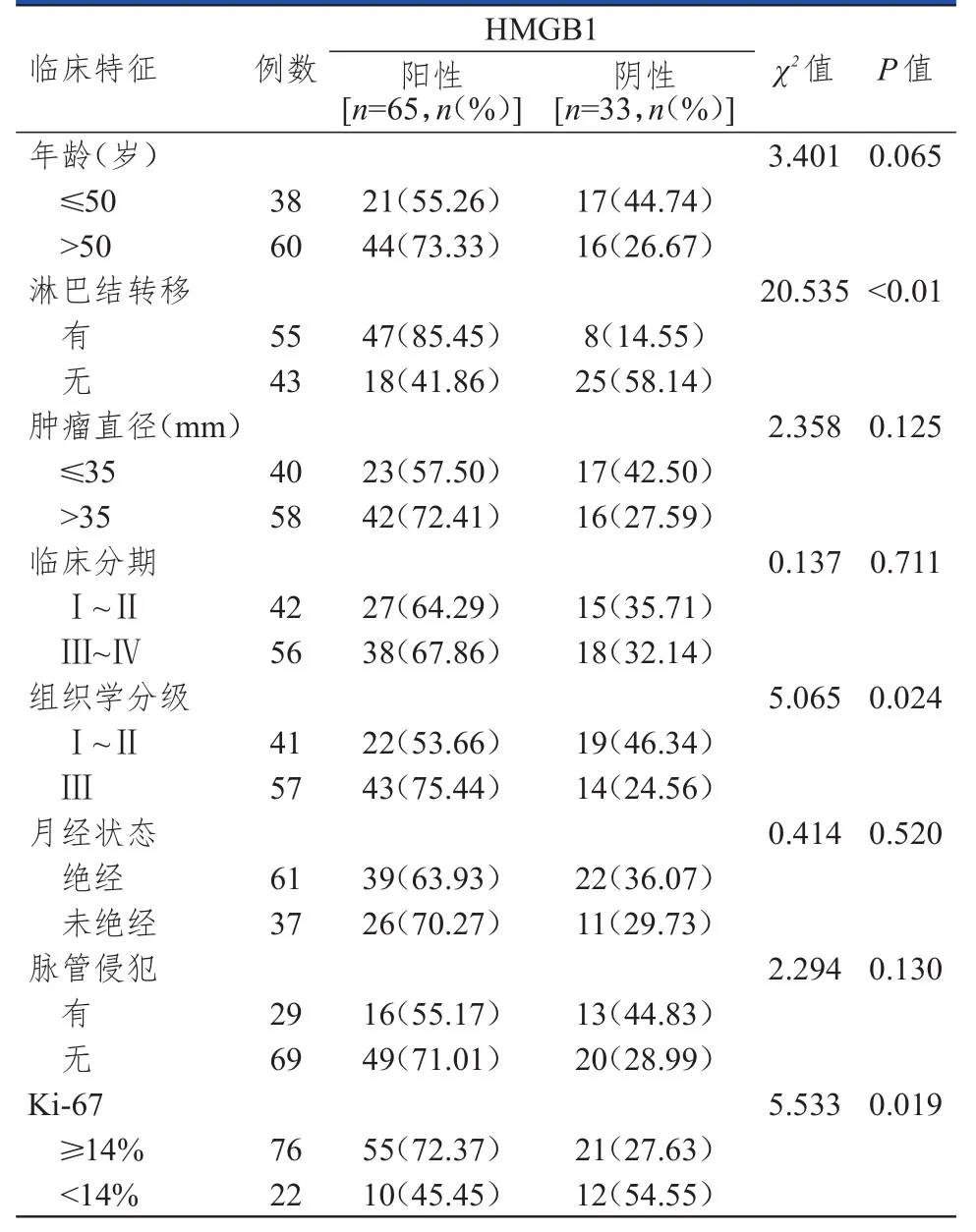
表1 不同临床特征的三阴性乳腺癌患者肿瘤组织中HMGB 1表达情况的比较
3 讨论
高迁移率族蛋白(high mobility group,HMG)是Goodwin等在1973年研究牛的胸腺时发现的一种细胞核蛋白,其在聚丙烯酰胺凝胶电泳中迁移速度高于其他蛋白,并因此命名。HMGA、HMGB、HMGN均属于HMG家族成员,HMGB1是HMGB家族成员之一,其氨基酸序列高度保守,真核生物间的氨基酸序列同源性高达80%。而人的HMGB1基因位于13号染色体上,分子量为25 000 kD,由A盒、B盒、C末端3个结构域构成,不仅可与DNA结合,作为基因和转录调控因子参与细胞核内的多种生命活动,其分子还参与炎性反应及促进肿瘤细胞生长、增殖、分化等病理过程。正常情况下,HMGB1基因在细胞及组织中的表达被精确调控于一个基础水平,当细胞或组织发生增殖、分化后,其表达有所上升,而在部分肿瘤细胞中高表达,尤其是肝癌、乳腺癌、结直肠癌及胃癌。
本研究结果显示,三阴性乳腺癌组织中HMGB1阳性表达率明显高于癌旁组织,提示HMGB1在三阴性乳腺癌组织中呈高表达。这与HMGB1的功能密切相关,研究显示,晚期糖基化终末产物受体(the receptor of advanced glycation endproducts,RAGE)是HMGB1对应的配体,可在乳腺癌中高表达;配体高表达会使得HMGB1表达上调,二者结合可触发核因子κB(nuclear factor-κB,NF-κB)、Racl/cdc42、促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)等多条信号通路,使细胞信号调控机制受到干扰,从而促进肿瘤细胞的生长及增殖,故HGMB1表达水平提高与肿瘤细胞增殖程度提升相关。
本研究结果显示,HMGB1的表达与三阴性乳腺癌患者的淋巴结转移情况、组织学分级及Ki-67表达有关,而与年龄、临床分期、肿瘤直径、月经状态、脉管侵犯情况无关。这与HMGB1以下几个方面的作用有关:①HMGB1与其配体RAGE及其他受体如 Toll样受体 2(toll-like receptor 2,TLR2)、Toll样受体4(toll-like receptor 4,TLR4)结合后,可激活NF-κB、MAPK等信号通路,使得基质金属蛋白酶(matrix metalloproteinase,MMP)被活化,细胞外基质被降解,导致肿瘤细胞的浸润和转移更容易发生;②HMGB1激活NF-κB信号通路可促进血管内皮生长因子(vascular endothelial growth factor,VEGF)表达上调,从而促进肿瘤新生血管生成,使肿瘤细胞发生转移;③HMGB1参与细胞骨架肌动蛋白调节进而促进细胞分裂和运动,提高肿瘤细胞迁移能力。Ki-67是细胞核增殖抗原,相关动物实验发现Ki-67受到抑制后肿瘤生长也受到抑制,认为Ki-67与肿瘤的生长密切相关。进一步研究显示,Ki-67在包括乳腺癌等多种恶性肿瘤组织中高表达,可作为分子标志物评估患者的预后。本研究中,Ki-67高表达的三阴性乳腺癌患者HMGB1阳性表达率较高,Ki-67高表达提示肿瘤细胞增长旺盛、肿瘤病情进展加快、患者预后不良,故Ki-67高表达的三阴性乳腺癌患者多预后不良,这类患者HMGB1阳性表达率高提示三阴性乳腺癌患者预后不良可能与HMGB1过表达有关。有研究表明,直肠癌患者中HMGB1阳性表达者中位生存时间较阴性表达者短;下调HMGB1基因表达会抑制喉癌细胞增殖水平和侵袭力,侧面提示HMGB1阳性表达会影响肿瘤患者预后,其表达水平与肿瘤增殖水平和侵袭力密切相关。
综上所述,HMGB1在三阴性乳腺癌组织中高表达,且其阳性表达与淋巴结转移、组织学分级、Ki-67表达有关,可作为治疗三阴性乳腺癌的候选靶点。本研究尚存在不足之处,因为随访时间短不能分析HMGB1表达情况与患者预后的相关性,需进一步研究加以证实。

