HIF-1α在肝癌组织中的表达及临床意义
张 晨
[摘要]目的:探讨HIF-1α在肝癌组织中的表达及临床意义。方法:采用免疫化学SABC染色检测HIF-1α表达情况。结果:HIF-1α在肝癌组织中的表达明显高于癌旁组织及正常肝组织。结论:HIF-1α的表达与肝癌的发生发展有关。
[关键词] HIF-1α;肝癌组织
[中图分类号] R735 [文献标识码]A [文章编号]1674-4721(2009)05(a)-053-02
在实体瘤的恶性增殖过程中普遍存在缺血缺氧现象,缺氧状态下,细胞内缺氧反应基因转录和表达发生改变,从而对缺氧作出应激反应,使细胞、组织和机体产生一系列适应性反应以维持供氧的平衡。肿瘤细胞的低氧适应主要由HIF-1α(Hypoxia-inducible factor 1α)介导,肿瘤内低氧可导致HIF-1α过表达,并涉及肿瘤细胞的代谢适应、凋亡抵抗、血管生成和侵袭与转移相关的基因表达[1]。本文主要探讨HIF-1α在肝癌、肝癌旁组织及正常肝组织中的表达及临床意义。
1 资料与方法
1.1一般资料
30例肝癌患者肝组织及癌旁组织、10例正常对照肝组织标本。30例肝癌患者为2007年2月~2009年1月间住院患者,术后均经病理证实为肝细胞癌。其中男性18例、女性12例,年龄34~72岁,平均年龄46岁,10例正常肝组织为肝血管瘤和肝囊肿周围的正常肝组织。
1.2 试剂和方法
兔抗人HIF-1α抗体购自美国Santa Cruz公司(工作浓度1∶100),免疫组化试剂盒、DAB显色试剂盒均购自北京中山生物技术有限公司。采用免疫化学SABC染色检测HIF-1α表达情况。分别用PBS代替一抗作为阴性对照,用已知阳性组织切片作为阳性对照。
1.3 免疫组化结果判断[2]
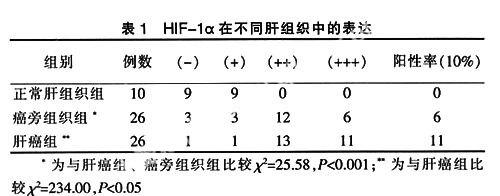
HIF-1α阳性染色定位于肝细胞浆,肝细胞核中亦有少量表达,呈棕黄色或棕褐色颗粒,表达水平采用染色强度评分与阳性细胞百分率评分的积分表示,每张切片选取5个高倍视野计数阳性细胞数和计数细胞总数,阳性细胞数/计数细胞总数x100%为阳性细胞百分率。阳性细胞百分率分0~3级:阳性细胞百分率≤5%为0分;阳性细胞百分率达6%~25%为1分;阳性细胞百分率达26%~50%为2分;阳性细胞百分率>50%为3分。染色强度分0~2级:完全阴性,与背景一致=0;染色呈淡黄色,略高于背景=1;染色呈黄色或棕黄色,明显高于背景=2。将每张片子的染色强度与阳性细胞百分率得分相乘为其最后得分。两项相乘后分4级:0~1分为(-),2分为(+),3~4分为(++),5分以上为(+++)。
1.4统计学处理
应用SPSS 14.0统计软件对数据进行统计学处理。采用X2检验。P<0.05为差异有统计学意义。
2 结果
肝癌组织和癌旁组织中均可见到HIF-1α的表达,而在正常肝组织中基本无表达。HIF-1α阳性染色主要位于肝细胞胞浆中,部分胞核中也有表达,呈棕黄色和棕褐色颗粒。HIF-1α在正常肝组织和癌旁肝组织中肝细胞胞浆中无着色或着色浅。其中30例肝细胞癌中HIF-1α的表达强于癌旁组织中HIF-1α的表达,肝癌组织、癌旁组织HIF-1α的表达明显强于正常肝组织中HIF-1α的表达见表1。
3讨论
缺氧是实质性肿瘤微环境的基本特征之一。缺氧诱导因子-1(hypoxia-inducible factor1,HIF-1)是广泛存在于动物及人体的多种肿瘤细胞中的转录因子,HIF-1通过刺激肿瘤血管新生、维持肿瘤细胞的能量代谢、促进肿瘤血管新生、维持肿瘤细胞的能量代谢、促进肿瘤增殖等作用引起肿瘤细胞的侵袭转移,HIF-1由HIF-1α和HIF-1β亚基组成。缺氧反应基因的调控主要是由HIF-1α来实现。HIF-1α在正常氧分压时极不稳定,易被泛素依赖的蛋白水解酶降解[2],常氧条件下半衰期小于10 min,但在低氧时半衰期显著延长。在多数恶性肿瘤组织内,HIF-1α都有一定程度表达,包括一些癌前病变和早期癌变,提示肿瘤细胞低氧发生在血管生成之前,并进而促进肿瘤的恶性转化[3]。HIF-1α是低氧状态下血管生成的核心调控因子,HIF-1α在组织处于低氧状态时发挥转录和基因调控作用,通过影响其他因子的表达,而直接参与血管生成的全过程。新生血管体系的形成是肿瘤解决低氧的重要途径之一,而肿瘤新生血管形成与实体瘤的发生、侵袭和转移密切相关,并影响大部分肿瘤的预后。
笔者研究结果显示,HIF-1α在肝癌组织中的表达明显高于癌旁组织及正常肝组织,说明HIF-1α的表达与肝癌的发生发展有关。考虑肝癌组织中HIF-1α的升高可能与下列因素有关[4]:①肝组织的缺血、缺氧使HIF-1α表达上调。②一些病理情况下组织结构异常和血液动力学紊乱使细胞存在缺氧微环境。③多种抑癌基因的失活如P53、癌基因的激活如Src等亦能上调HIF-1α的表达[5-9]。
缺氧引起的基因表达改变可能是肿瘤生长、侵袭转移的一个关键环节。随着对缺氧反应基因HIF-1研究的深入,相信以HIF-1为靶点治疗肿瘤将可能成为肿瘤治疗的又一重要手段。
[参考文献]
[1]Semenza GL.Targeting HIF-1 for Cancer Therapy [J].Nat Rev Cancer,2003,3(10): 721-732.
[2]Tanimoto K,makino Y,Pereira T, et al. Mechanism of regulation of the hypoxia-inducible factor-1 alpaha by the von hippel-Lindau tumor suppressor protein[J].EMBO J,2000,19:4298-4309.
[3]Birner P, Schind lM, Oberhuber G. Over expression of hypoxia-induciblefactor-1 alpha is a marker for an unfavorable prognosis in early-stage invasive cervical cancer[J].Cancer Res,2000,60(18):4693.
[4]丁磊,陈孝平,王海平.肝癌和癌旁组织中HIF-1α基因蛋白的表达及其临床意义[J].肝胆外科杂志,2004,12,10:32-35.
[5]Blagoskonny MV,An WG,Romanova LY,et al.p53 inhibits hy-poxia-inducible factor-stimulated transcription[J].JBC,1998,273:11995-11998.
[6]Gorski DH,Alejandro J,Leal BS.Inhibition of endothelial cell activation by the homeobox gene Gax[J].Surg Res,2003,111(1):91-99.
[7]张传海,许戈良,葛勇胜,等.亚砷酸对肝癌细胞增殖及PCNA,cMyc蛋白表达的影响[J].第四军医大学学报,2005,26(14):1303-1307.
[8]Oconnor DS, Wall NR, Porter AC, etal. A p34(cdc2) survival checkpoint in cancer[J].Cancer Cell,2002,2(1):43-54.
[9]杨俊.肿瘤标志物联合检测对原发性肝癌的诊断价值[J].中国现代医生,2008,46(05):12-13.
(收稿日期:2009-03-18)

