生物相容性大分子MRI造影剂的合成及性能
湛游洋, 李晓晶
(中国科学院长春应用化学研究所 中国科学院高性能合成橡胶及其复合材料重点实验室, 长春 130022)
0 引 言
自1983年Gd-DTPA成为第一个正式进入临床的磁共振成像(Magnetic resonance imaging, MRI)造影剂以来,人们对造影剂的需求量逐年增加[1-2]。目前,全球每年消耗的钆类造影剂已超过30吨,并且还在不断地增长。由于造影剂的基本要求较多、体内作用机制复杂,虽然处于研发状态的种类及数量较多,但能够在临床上应用的数量极为有限[3-6]。目前,在临床应用的MRI造影剂中,除了MultiHancey©和Evosit©具有一定的选择性外,其他造影剂属于细胞外液间隙造影剂,不具备靶向成像功能。此外,它们的弛豫效率集中在3~5 mmol-1·L·s-1,还有待于进一步提高。因此,开发具有靶向成像功能、高效低毒的MRI造影剂是一个重要的研究方向[7-11]。
根据MRI造影剂的基本原理及SBM(Solomon-Bloembergen-Morgan)方程[12-13],增大造影剂的分子尺寸从而延长旋转相关时间(τR)是提高弛豫效率的一个重要方法。聚氨基酸是一种常用的大分子药物载体,具有与蛋白质类似的酰胺结构,毒性较低、生物相容性能极佳,并且可以在机体内降解生成无毒的小分子氨基酸,最终被机体吸收、利用。聚氨基酸还可通过侧链功能化来赋予其更多的性能[14-15]。因此,利用聚氨基酸为载体合成的大分子MRI造影剂既可以满足高弛豫性能、靶向成像的要求,又可以最大程度地降低药物毒性与用药风险。同时,甘氨酸还可通过作用于细胞膜上的甘氨酸受体(GlyR)防止枯否细胞过度激活,从而对多种原因引起的肝损害起明显的抑制作用。
本文选择天门冬氨酸和甘氨酸通过热缩聚反应制备了大分子聚氨基酸载体,利用乙二胺对聚氨基酸的侧链进行改性,与小分子的MRI造影剂Gd-DOTA连接,合成大分子造影剂AGN-DOTA-Gd。从弛豫性能、大鼠体内成像效果和急性毒性等多个方面对合成的造影剂进行了综合评价。结果表明,AGN-DOTA-Gd是一种潜在的高效肝脏靶向大分子MRI造影剂。
1 实验部分
1.1 仪器与试剂
采用Bruker Avance 600型核磁共振谱仪和Bruker Vertex70 型(德国Bruker公司)红外光谱仪对样品的结构进行表征,利用Thermo Fisher X Series Ⅱ型(美国Thermo Fisher公司)电感耦合等离子体质谱仪(ICP-MS)进行配合物中钆含量的测试,采用Siemens 3.0T(德国Siemens公司)磁共振成像系统进行动物体内成像实验。
L-天门冬氨酸、L-甘氨酸、N,N-二甲基甲酰胺(DMF)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸(DOTA)、N-羟基硫代琥珀酰亚胺(sulfo-NHS)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)等均为市售分析纯试剂。
实验大鼠购于吉林大学动物实验中心,均为SPF级Wistar大鼠。
1.2 大分子造影剂AGN-DOTA-Gd的合成
将5.32 g L-天门冬氨酸、0.75 g甘氨酸、3mL 85%磷酸混合均匀,混合物在旋转蒸发仪中反应5 h(条件:165 ℃、3.19 kPa)。反应产物溶解在60 mL DMF中,用去离子水沉淀,过滤并用大量去离子水洗涤,真空干燥,得到天门冬氨酸-甘氨酸共聚物(AG)。
将1.0 g AG溶解于12 mL DMF中,将乙二胺(12 mL)与DMF(12 mL)的混合液缓慢滴加到AG溶液中,4 ℃条件下磁力搅拌反应2.5 h,之后升至室温并继续反应2 h。反应结束后,反应物在120 mL乙醚-乙醇(V乙醚∶V乙醇=1∶2)混合溶液中沉淀,过滤,用丙酮洗涤,透析后冻干,得到胺化的天门冬氨酸-甘氨酸共聚物(AGN)。
将1.0 g DOTA溶于20 mL去离子水中,加入1.0 g sulfo-NHS和1.0 g EDC·HCl,调节pH为5.2,室温下反应1.5 h,得到DOTA活化酯。将1.0 g AGN溶于10 mL去离子水中,滴加到DOTA活化酯中,调节反应溶液pH为7.5~8.5,室温下反应24 h。用半透膜透析,冻干,得到天门冬氨酸-甘氨酸共聚物修饰的DOTA大分子载体(AGN-DOTA)。
按照Gd3+∶AGN-DOTA=1.2∶1(摩尔比),将GdCl3溶液和AGN-DOTA溶液混合,在室温下搅拌过夜,除去未反应的Gd3+,用葡聚糖凝胶(Sephadex G-25)进行纯化,得到终产物大分子造影剂AGN-DOTA-Gd。
AG13C NMR谱(DMSO-d6,δ/ppm):174.00和172.17为天冬酰胺环中的羰基碳峰,167.88为甘氨酸中的羰基碳峰,47.30和32.02为天冬酰胺环中的亚甲基碳峰,34.81为甘氨酸部分的羰基碳峰。
1.3 弛豫性能测试
将AGN-DOTA-Gd溶于20%重水中,配制成钆浓度为0.8 mmol·L-1的溶液,采用逐级稀释法配制 0.4、0.2、0.1和0.05 mmol·L-1的溶液,采用反转恢复法测其弛豫时间(T1)。
1.4 动物体内成像实验
大鼠体内成像实验在Siemens 3.0 T磁共振成像系统上进行。实验采用多片多回波法,实验参数:扫描视野FOV=75 mm2,重复时间TR=596 ms,回波时间TE=18 ms,片厚SD=1.5 mm,片数为16,像素大小=(0.2×0.2×1.5)mm3。
将10%的水合氯醛(剂量:0.5 mL/100 g体重)腹腔注射,大鼠麻醉后尾静脉注射合成的造影剂AGN-DOTA-Gd,每10 min观测一次,连续观测90 min。实验结果用3次实验的平均值和标准方差表示。
1.5 安全性评价实验
1.5.1 细胞毒性试验
取对数生长期的L02细胞,按每孔2×104个细胞接种于96孔板上。在37 ℃、5% CO2培养箱中培养24 h后,加入不同浓度的造影剂AGN-DOTA-Gd溶液,继续培养48 h后,加入0.5%的噻唑蓝(MTT)溶液,再培养4 h,终止培养。每孔中加入0.15 mL DMSO,混匀,静置,用酶标仪测量OD490值。细胞存活率(CV)计算公式为:
CV(%)=(A实验/A对照)×100%
(1)
式中:A实验是实验组OD490值;A对照为对照组的OD490值。
1.5.2 大鼠脏器系数
将大鼠随机分为实验组和对照组,实验组注射AGN-DOTA-Gd(0.1 mmol Gd3+·kg-1),对照组注射相同剂量的生理盐水。分别在给药1、2、24、72和168 h后将其断头处死,取心、肝、脾、肾和肺等组织,用生理盐水冲净,滤纸吸干表面水分后精确称重。脏器系数计算公式为:
脏器系数(%)=脏器质量/大鼠体重×100%
(2)
1.5.3 组织生理切片
将大鼠随机分为实验组和对照组,实验组注射AGN-DOTA-Gd(0.1mmol Gd3+·kg-1),对照组注射相同剂量的生理盐水。在给药后第7天和第14天处死,取肝、脾、肺、肾和心放置于0.5%的甲醛溶液中固定,制作组织切片,用苏木精-伊红法(H&E)染色,用光学显微镜观察结果。
2 结果与讨论
2.1 AGN-DOTA-Gd的合成与结构表征
大分子造影剂AGN-DOTA-Gd的合成过程如图1所示。天门冬氨酸和甘氨酸通过热缩聚反应得到氨基酸共聚物,共聚物中的琥珀酰亚胺部分发生开环,利用乙二胺作为间隔臂与DOTA进行连接,最后与Gd3+络合,经过纯化、冻干后,得到大分子配合物AGN-DOTA-Gd。
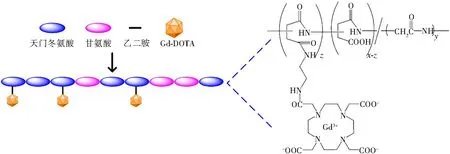
图1 大分子造影剂AGN-DOTA-Gd合成路线示意图

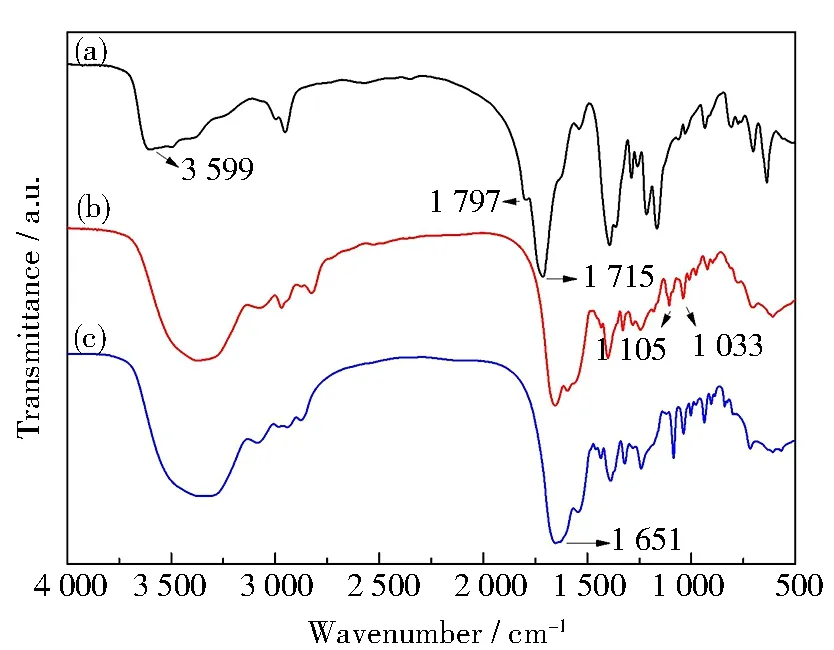
图2 AG(a), AGN-DOTA(b)和AGN-DOTA-Gd(c)的红外光谱图

图3 水质子弛豫时间与不同浓度钆离子关系
2.2 体外弛豫性能测试
弛豫效率是评价MRI造影剂性能的一个重要指标,通过测量弛豫时间(T1)计算顺磁性造影剂弛豫效率(r1),如式(3)所示。在临床应用中,正常部位与患病部位弛豫时间的差异形成了不同的成像信号,从而使患病部分得到区分。
(1/T1)obs=(1/T1)nh+r1[Gd]
(3)
式中:(1/T1)obs为观测到有造影剂时溶液弛豫时间的倒数;(1/T1)nh为观测到无造影剂时溶液弛豫时间的倒数;[Gd]为溶液中Gd3+的浓度。
根据式(3)计算得出,合成的顺磁性大分子造影剂AGN-DOTA-Gd弛豫效率为10.82 mmol-1·L·s-1,明显优于临床常用小分子造影剂Gd-DOTA(4.9 mmol-1·L·s-1)。这表明所合成的AGN-DOTA-Gd不仅可以满足MRI造影剂高弛豫性能的基本要求,同时,可以减少患者的用药量,降低药物可能带来的毒副作用。合成的AGN-DOTA-Gd表现出较高弛豫性能的原因可能包括:(1)小分子造影剂Gd-DOTA与聚氨基酸载体的共价结合延长了分子的旋转相关时间,对提高弛豫效率起着关键作用;(2)连接聚氨基酸配体后,分子的疏水性能发生改变,可能影响配位水与自由水的交换速率,从而影响造影剂的弛豫效率[5, 16-19]。
2.3 动物体内成像实验
利用Wistar大鼠体内的MRI实验评价了AGN-DOTA-Gd对于大鼠肝脏部位的信号增强作用。图4为尾静脉注射AGN-DOTA-Gd和Gd-DOTA后肝脏的成像增强效果随时间的变化趋势。由大鼠体内的成像数据可知,AGN-DOTA-Gd对肝脏的成像增强效果明显优于Gd-DOTA,并且具有更长的成像窗口时间。AGN-DOTA-Gd对肝脏的最佳成像窗口时间为20~70 min,平均信号增加值约为Gd-DOTA的3.5倍。
合成的大分子造影剂AGN-DOTA-Gd对肝脏具有良好的成像增强效果,并且成像窗口时间较长,可能的原因有:(1)AGN-DOTA-Gd的分子量较高,分子尺寸大于Gd-DOTA,其穿过毛细血管壁时受到的阻碍更多,而且部分AGN-DOTA-Gd还可能与血清白蛋白结合,进一步增大分子尺寸,延长循环时间;(2)共聚物载体中含有的天门冬氨酸和甘氨酸可以被肝脏蛋白质合成系统特异性识别,从而提高了对肝脏的选择性;(3)AGN-DOTA-Gd可能在体内发生降解,生成的小分子碎片可能扩散到肝脏的间隙里,从而增强成像效果。此外,肝脏是血液的灌注器官,AGN-DOTA-Gd在血液中的T1效应也可能影响肝脏的成像信号[13, 20-22]。
图5为注射AGN-DOTA-Gd前(a)、30 min后(b)及60 min后(c)大鼠肝脏部位的T1加权像。由该图可以直观地看出,所合成的AGN为载体的大分子MRI造影剂具有优异的肝脏成像效果。

图5 尾静脉注射AGN-DOTA-Gd前(a)、30 min后(b)和60 min后(c)大鼠肝脏部位T1加权像
2.4 安全性实验
通过细胞毒性试验、大鼠脏器系数变化趋势及组织生理切片等方法,对合成的大分子MRI造影剂AGN-DOTA-Gd进行了安全性的初步评价。
2.4.1 细胞毒性试验
图6为AGN-DOTA-Gd和Gd-DOTA的细胞毒性试验结果。如图所示,随着Gd3+浓度的增加,Gd-DOTA组细胞存活率明显下降。而AGN-DOTA-Gd组细胞存活率一直保持在较高水平,在钆离子浓度为750 μmol·L-1时,细胞的存活率仍大于70%。与临床小分子造影剂Gd-DOTA相比,AGN-DOTA-Gd对细胞的损伤程度更小,具有优异的生物相容性。
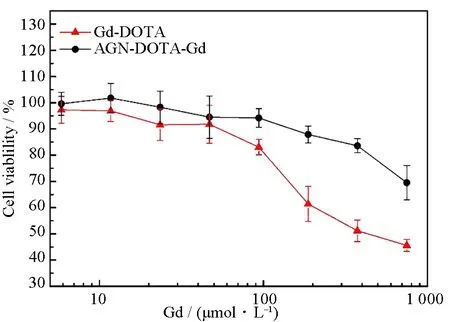
图6 Gd-DOTA和AGN-DOTA-Gd的细胞毒性试验结果
2.4.2 大鼠脏器系数分析
图7为大鼠尾静脉注射AGN-DOTA-Gd后,各器官脏器系数随时间的变化趋势。在给药不同时间后,大鼠的心、肝、脾、肺、肾这五个重要器官的脏器系数均处于正常值范围内,说明合成的造影剂AGN-DOTA-Gd对大鼠的生长没有明显的影响,对各个主要器官没有产生明显的损伤,药物的毒性较低,安全性较高。

图7 脏器系数随时间变化趋势图
2.4.3 组织生理切片
动物组织的生理切片是一种常用的评价药物毒性的方法,它可以在细胞层面上准确地发现药物对机体的损伤。通过观察给药不同时间后大鼠的组织生理切片,研究合成的AGN-DOTA-Gd在动物体内的急性毒性。图8为给药7天后大鼠的心、肝、脾、肺和肾的生理切片。由图中各细胞的形态可知,在注射临床剂量的AGN-DOTA-Gd后,大鼠的各主要器官并未出现明显异常。给药后,心脏中心肌细胞生长正常,纤维排列有序。脾脏中细胞分布均匀,形貌完好,肺中肺泡均匀排列,无纤维化等情况发生。在主要代谢器官肾脏中,整体脉络结构清晰,肾小球等结构正常。在主要成像器官肝脏中,肝细胞生长良好,分布紧密,细胞核等细胞器清晰可见。结合图9可知,在给药7天和14天后,肝细胞均未受到损伤。由此可以说明,合成的大分子MRI造影剂AGN-DOTA-Gd具有较低的毒性和较好的生物相容性。
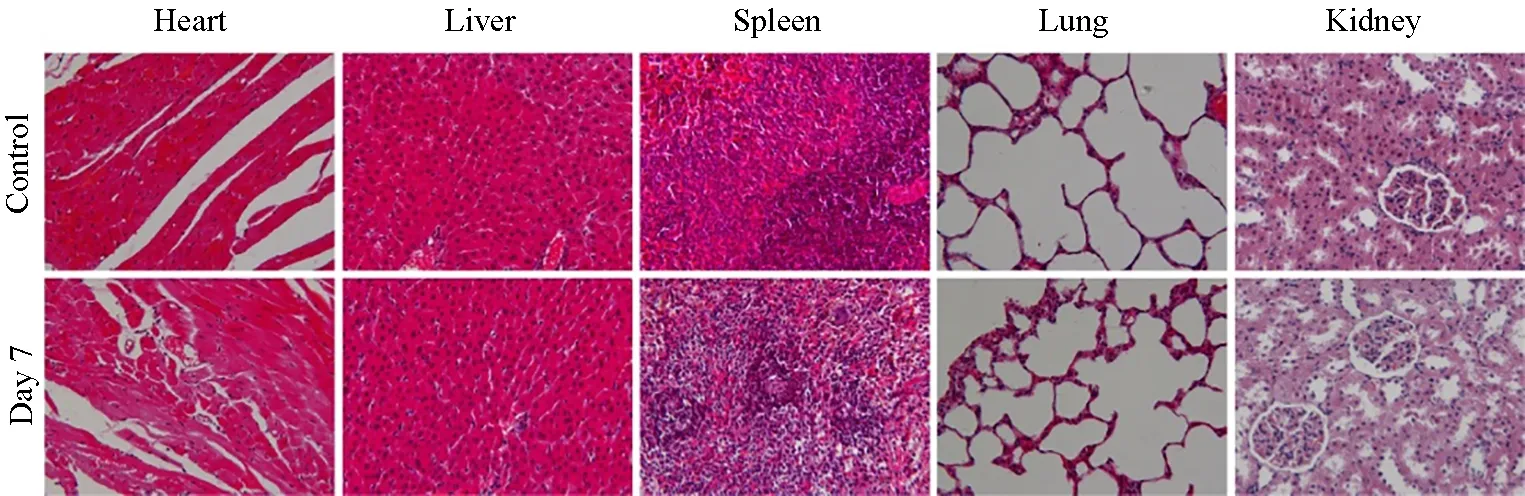
图8 尾静脉注射AGN-DOTA-Gd后大鼠的组织生理切片

图9 尾静脉注射AGN-DOTA-Gd不同时间后大鼠肝脏的组织生理切片
3 结 论
合成了天门冬氨酸-甘氨酸共聚物为载体的大分子造影剂AGN-DOTA-Gd,体外弛豫性能测试表明,其弛豫性能明显高于小分子造影剂Gd-DOTA。大鼠体内成像实验说明AGN-DOTA-Gd具有良好的肝脏靶向成像效果,并且具有较长的成像窗口时间。初步的毒性评价证明其毒性较低,生物相容性优异,具备进一步开发的潜力。

