Cu对CumNi0.1-mTiOx氧化物低温氨催化选择性还原氮氧化物性能的影响
李莹莹, 张天瑞, 朱宇君
(黑龙江大学 化学化工与材料学院 功能无机材料化学教育部重点实验室,哈尔滨 150080)
0 引 言
固定源和移动源尾气中排放的NOx给人类健康和环境带来许多危害[1],因此,催化消除NOx具有重要的意义。V2O5-WO3(WO3)/TiO2是目前大型发电厂应用的氨选择性还原(NH3-SCR)脱硝催化剂,其适用于烟气温度为300~400 ℃,但不适合现有工业燃煤锅炉烟气除尘和脱硫后温度偏低的实际情况。因而,对于治理工业烟气给环境带来的污染等问题,研究开发低温高效脱硝催化剂具有重要的现实意义。
研究发现,Ni基氧化物催化剂因在中高温区具有一定的NH3-SCR催化活性,而且Ni掺入到其他金属氧化物中可以与其他金属发生相互作用,从而调节催化剂的氧化性。Wu等研究发现,Ni的掺入可以使FeVO4纳米粒子与TiO2载体之间的相互作用增强,这对于结构缺陷的形成是有利的,并且可以使催化剂的酸性和氧化性得到提升,有助于形成更多的表面吸附氧,从而提高催化性能[2]。Chen等将Ni掺入到NixMn1-xTi10(x= 0.1~0.5)催化剂中[3]。结果表明,Ni的加入可以使催化剂表面的Ni3+、Mn4+和化学吸附氧物种增多,从而影响催化剂的催化性能,同时,Ni的掺入能够抑制SO2氧化成SO3,从而提高催化剂的抗硫性能。
Cu基氧化物催化剂由于具有良好的氧化性,在低温脱硝领域中得到了广泛的应用,但纯CuOx催化剂工作窗口较窄,活性较差。因此,通过调节氧化还原性和酸性可以使Cu基催化剂的活性得到提高,同时也能够拓宽操作温度窗口。Wang等报道,在Ti-Nb催化剂中加入Cu可以使催化剂的低温活性显著提高,这主要归因于Cu的加入引起了Cu和Nb之间发生相互作用,导致催化剂的氧化性增强。本课题组也制备了Cux-Nb1.1-x氧化物[5]和Cux-Ce0.5-x-Zr0.5氧化物[6]低温NH3-SCR脱硝催化剂,系统地研究了氧化还原性和酸性给催化剂的催化性能带来的影响,提出了其催化反应机制。
基于上述研究内容,本文通过将适量的Cu掺入到Ni-Ti体系中来调变催化剂的氧化还原性和表面酸性,从而得到具有较好催化性能的NH3-SCR脱硝催化剂。
1 实验部分
1.1 仪器与试剂
D/MAX-3B型X-射线衍射仪(德国布鲁克公司);全自动多用吸附仪(天津市先权科技有限公司);NO/NOx分析仪(北京微讯超技仪器技术有限公司);气体分析质谱仪(英国海德HIDEN公司);Nicolet-6700傅里叶变换红外光谱仪(外光赛默飞世尔科技公司)。
硝酸铜、无水乙醇(天津市天力化学试剂有限公司)、硝酸镍(天津市耀华化学试剂有限公司)、钛酸四丁酯(天津科密欧化学试剂有限公司)、冰醋酸(天津市光复科技发展有限公司),均为分析纯。
1.2 样品制备
采用溶胶-凝胶法制备一系列CumNi0.1-mTiOx(m= 0.01、0.015、0.02、0.03)催化剂。称取0.09 mol钛酸四丁酯,将硝酸铜(0.001、0.015、0.002和0.003 mol)和硝酸镍(0.009、0.008 5、0.008和0.007 mol)置于250 mL烧杯中,然后将50 mL冰醋酸、50 mL乙醇和15 mL蒸馏水加入到以上混合溶液中,搅拌5 h。室温下放置4天后,30 ℃烘箱中保持48 h,再在110 ℃干燥12 h。将得到的固体颗粒研磨成粉末后,在500 ℃空气条件下煅烧4 h,得到CumNi0.1-mTiOx产品。
为了作比较,采用与上述相同的方法制备了Ni0.1TiOx催化剂和Cu0.1TiOx催化剂。
1.3 催化剂的脱硝性能评价
在固定床反应器中进行催化剂的脱硝性能测试。催化剂的用量为0.30 mL(40~60目),模拟反应气体的组成为:1 000 ppm NH3、1 000 ppm NO和3% O2,N2作为平衡气。气体总流速为200 mL·min-1,反应空速为40 000 h-1。用质谱仪检测出口气体(NO、NO2、N2O和NH3)的浓度。NO转化率、N2选择性和NH3转化率由以下公式计算:
(1)
(2)
(3)
式中:[NO]in和[NO]out分别代表进入和出入固定反应床的NO浓度,[NH3]in和[NH3]out分别代表进入和出入固定反应床的NH3浓度,[NO2]out和[N2O]out分别代表出口NO2和N2O的浓度。
2 结果与讨论
2.1 催化剂性能测试
2.1.1 催化剂的活性测试结果
图1(a)显示了不同温度对CumNi0.1-mTiOx催化剂的NH3-SCR反应活性的影响。可以看到,Ni0.1TiOx催化剂在360 ℃时NO转化率达到100%。对于CumNi0.1-mTiOx(m= 0.01、0.015、0.02和0.03)催化剂,随着Cu含量的增加,其低温活性逐渐提高,但是高温活性逐渐下降。其中Cu0.015Ni0.085TiOx催化剂展现了相对较好的催化性能,在210~390 ℃的温度窗口范围内NO转化率达到100%。而当Ni完全被Cu取代时,Cu0.1TiOx催化剂仅在180~240 ℃范围内催化NO完全转化。图1(b)展现了CumNi0.1-mTiOx催化剂的N2选择性测试结果,可见随着Cu含量的增加,催化剂的N2选择性逐渐降低。在所有催化剂中,Cu0.015Ni0.085TiOx催化剂在整个测试温度范围内的N2选择性达到了90%以上。以上结果表明,掺入少量的Cu可以使催化剂的低温活性有所提高,但过量Cu的掺入则会降低催化剂的高温活性以及N2选择性,这可能是由于过量Cu的引入会导致催化剂的氧化性能提高,使高温条件下NH3被过度氧化。

图1 CumNi0.1-mTiOx催化剂的NO转化率(a)与N2选择性(b)
2.1.2 H2O和SO2对NH3-SCR活性的影响
由于烟气中存在的残余H2O和SO2会对NH3-SCR活性有抑制作用,并导致催化剂失活[7],因此,在空速为40 000 h-1的条件下,在200 ℃下进一步研究了SO2和H2O对Cu0.015Ni0.085TiOx催化剂SCR活性的影响,如图2所示。催化剂在通入H2O和SO2前,NO转化率在4 h内维持在85%左右,向反应气中通入100 ppm SO24 h后,NO转化率先略有上升随后又开始下降,最后下降到80%,这说明SO2对催化剂活性存在一定的抑制作用,当切断SO26 h后,NO转化率并没有恢复到初始值,说明SO2对催化剂性能的影响是不可逆的。当在反应气中加入5% H2O时,NO转化率明显降低,3 h内达到63%左右,当切断H2O后,NO转化率又恢复到73%,说明H2O对Cu0.015Ni0.085TiOx催化剂的SCR活性有一定的抑制作用,当5% H2O和100 ppm SO2同时通入反应气后,NO转化率又在一定程度上有所下降。在5% H2O和100 ppm SO2引入4 h内可保持63%的NO转化率。同样,当切断H2O和SO2后,NO转化率又恢复到73%左右。抗水和抗硫性能测试结果表明,Cu0.015Ni0.085TiOx催化剂在低温200 ℃具有一定的抗H2O和抗SO2性能。
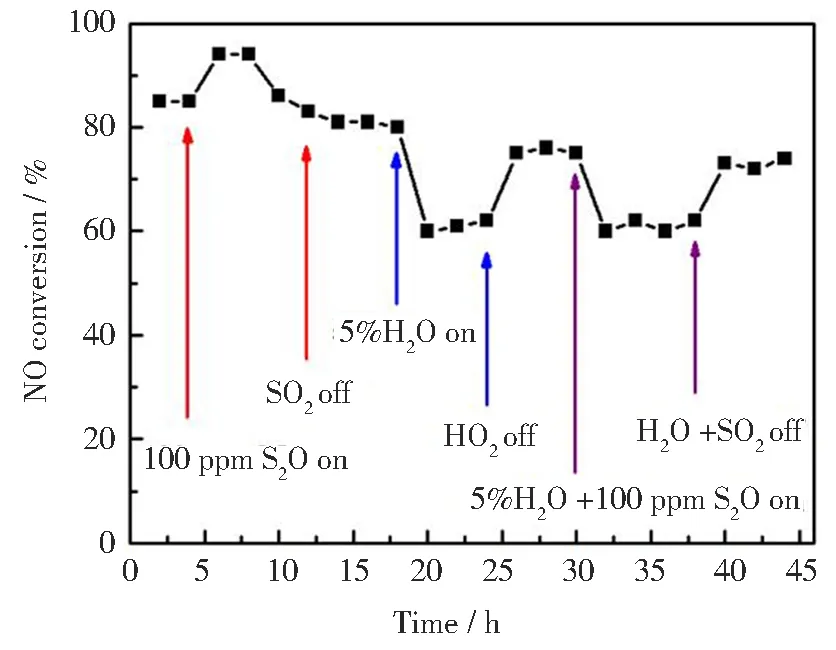
图2 200 ℃时SO2和H2O对Cu0.015Ni0.085TiOx催化剂活性的影响
2.2 表征结果
2.2.1 XRD和BET分析
利用XRD研究催化剂的晶体结构,结果如图3所示。在XRD谱图中,仅观察到归属于锐钛矿型TiO2的(101)、(004)、(200)、(211)、(204)和(220)晶面的衍射峰(JCPDS:65-5714),没有检测到其他如NiOx或CuOx等金属氧化物的特征峰,这可能是由于Cu和Ni的含量较少或以无定型形式存在于催化剂中。以上结果证明了Cu、Ni与Ti之间存在一定的相互作用。利用N2吸附-脱附曲线对催化剂的BET比较面积进行测试,结果如表1所示。可以观察到,相较于Ni0.1TiOx催化剂(118 m2·g-1),加入Cu以后,CumNi0.1-mTiOx催化剂的BET比表面积略有减少。

图3 Ni0.1TiOx(a)、Cu0.01Ni0.09TiOx(b)、Cu0.015Ni0.085TiOx(c)、Cu0.02Ni0.08TiOx(d)、Cu0.03Ni0.07TiOx(e)和CuTiOx(f)样品的粉末X-射线衍射图

表1 CumNi0.1-mTiOx催化剂的物理化学性质
2.2.2 H2-TPR分析
催化剂的氧化还原性通过H2程序升温还原(H2-TPR)进行检测,结果显示在图4中。对于Cu0.1TiOx催化剂,在100~250 ℃范围内出现两个重叠峰。低温处的峰归属于高分散表面CuO物种的还原(Cu2+→Cu+→Cu0)[8];高温处的峰归属于小尺寸结晶CuO的还原[9]。对于Ni0.1TiOx催化剂,在250~450 ℃出现了归属于Ni2+→ Ni0还原[10]的H2消耗峰。对于CumNi0.1-mTiOx催化剂,低温和高温的两个还原峰分别归属于CuO和NiO物种的还原。而且,还原峰温度随着Cu含量的增加而降低。尽管与Cu0.1TiOx相比,CumNi0.1-mTiOx的总H2消耗量几乎没有变化,但其低温还原峰的面积逐渐增加,H2消耗量增加(表1)。这说明Cu的加入提高了催化剂的可被还原能力。这也能导致CumNi0.1-mTiOx催化剂具有较好的低温NH3-SCR性能。
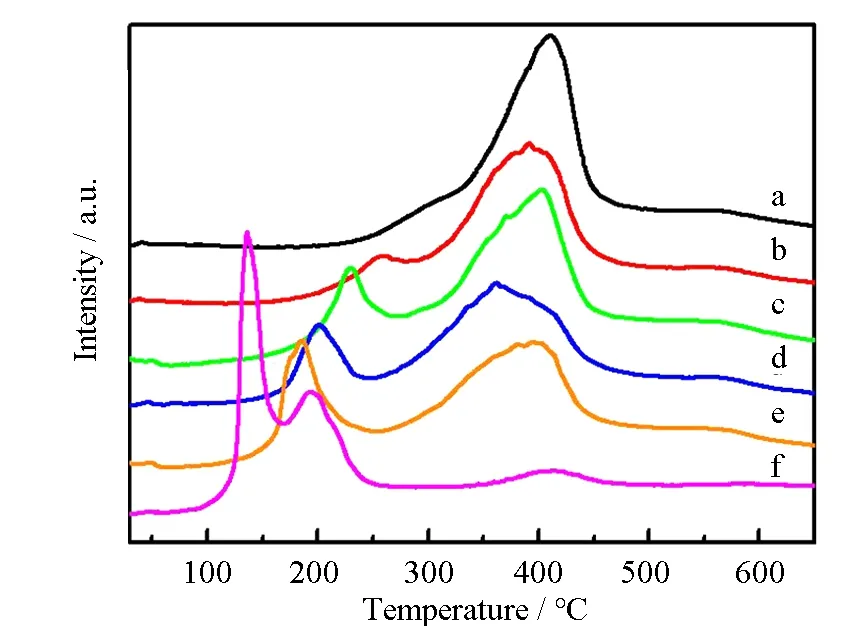
图4 Ni0.1TiOx(a)、Cu0.01Ni0.09TiOx(b)、Cu0.015Ni0.085TiOx(c)、Cu0.02Ni0.08TiOx(d)、Cu0.03Ni0.07TiOx(e)和Cu0.1TiOx(f)样品的H2-TPR谱图
2.2.3 NO氧化和NH3氧化分析
图5(a)为催化剂的NO氧化结果,从图中可以看到,同Ni0.1TiOx催化剂相比,对于CumNi0.1-mTiOx(m= 0.01、0.015、0.02)催化剂,随着Cu的引入,在相同温度下NO2的浓度增加。即催化NO氧化成NO2的能力随着Cu含量的增加而增加。图5(b)显示催化剂的NH3氧化与NO氧化的结果完全吻合,催化剂中Cu的含量越多,其对NH3的氧化能力越强。通过以上结果,可以证明Cu的引入增加了催化剂的氧化能力。根据文献报道,催化剂具有较强的氧化能力,将有助于更多NO氧化成NO2,促进快速SCR反应的进行,从而增强低温催化活性[11]。然而,当氧化能力太强时,会导致在SCR反应中NH3被过度氧化成N2O[12],从而降低高温N2的选择性。
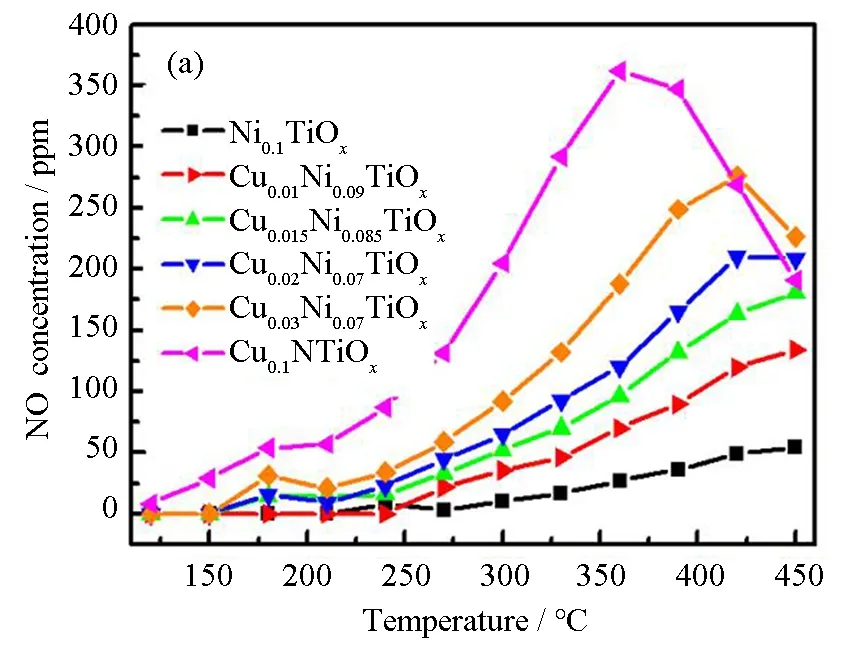
图5 CumNi0.1-mTiOx催化剂的NO氧化(a)和NH3氧化(b)图
2.2.4 NH3-TPD分析
催化剂表面的酸强度和酸量对NH3-SCR反应性能有很大影响。用NH3-TPD测试了催化剂表面的酸强度和酸量。如图6所示,在低于250 ℃和高于250 ℃的区域分别出现了两个NH3的脱附峰。根据文献,在低温区域(<250 ℃)的脱附峰归属于弱酸性位点吸附的NH3,在高温区域(>250 ℃)的脱附峰归属于中强酸性位点吸附的NH3[13]。可以看出,所有催化剂低温区域的脱附峰温度基本相同,表明这些催化剂的弱酸位酸强度基本相同。
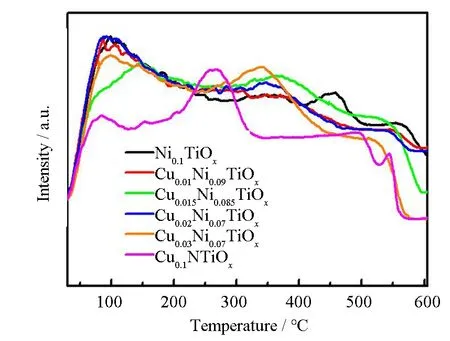
图6 CumNi0.1-mTiOx催化剂的NH3-TPD谱图
随着Cu含量的增加,位于中等酸性位上的脱附峰位置逐渐向低温方向移动,说明Cu的引入削弱了中等酸性位点的强度。根据峰面积计算酸量(表1),发现Cu0.015Ni0.085TiOx催化剂具有最高的表面酸度,说明掺入Cu后,Cu与Ni之间发生相互作用,提高了催化剂的总酸量,进而提高了SCR性能。
2.2.5 XPS分析
用XPS来分析催化剂的表面元素组成和化学状态, Cu 2p、Ni 2p、O 1s和Ti 2p的XPS图谱如图7所示。CumNi0.1-mTiOx催化剂的Cu 2p的XPS结果展示在图7(a)中,在934.0和953.8 eV处出现两个分别归属于Cu 2p3/2和Cu 2p1/2的特征峰,将934.0 eV处的峰分成两个峰,结合能为932.6 eV和934.4 eV的峰分别归属于Cu+和Cu2+[14]。根据峰面积,对Cu2+/(Cu++Cu2+)进行计算并列于表2中。可以看到,随着Ni含量的降低和Cu含量的增加,Cu2+/(Cu++Cu2+)的量略有增加。但是,Cu2+/(Cu++Cu2+)的含量几乎都在91%~94%,这也反映出这几种催化剂具有良好低温活性的原因。
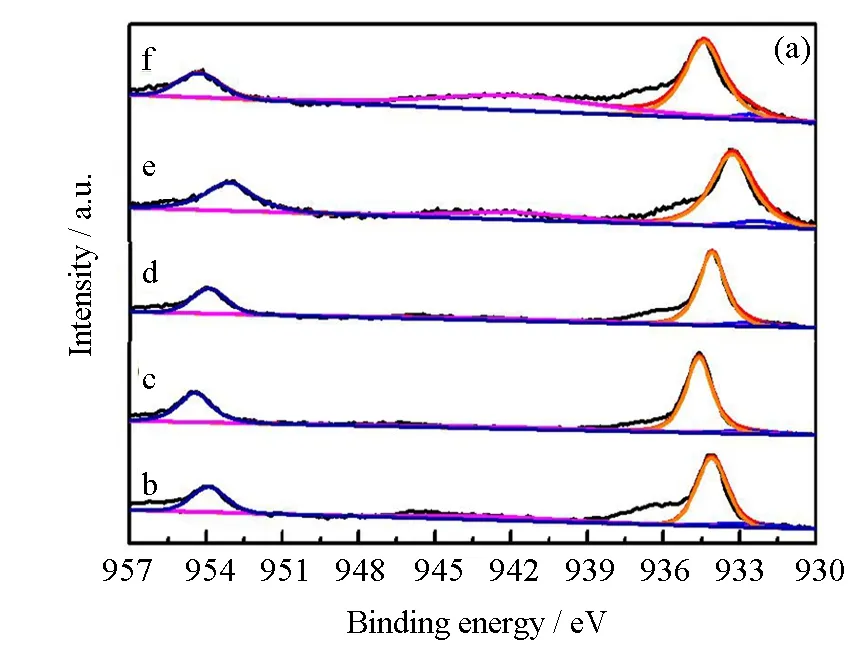
图7 样品的 Cu 2p(a)、Ni 2p(b)、O 1s(c)和 Ti 2p(d)XPS 光谱
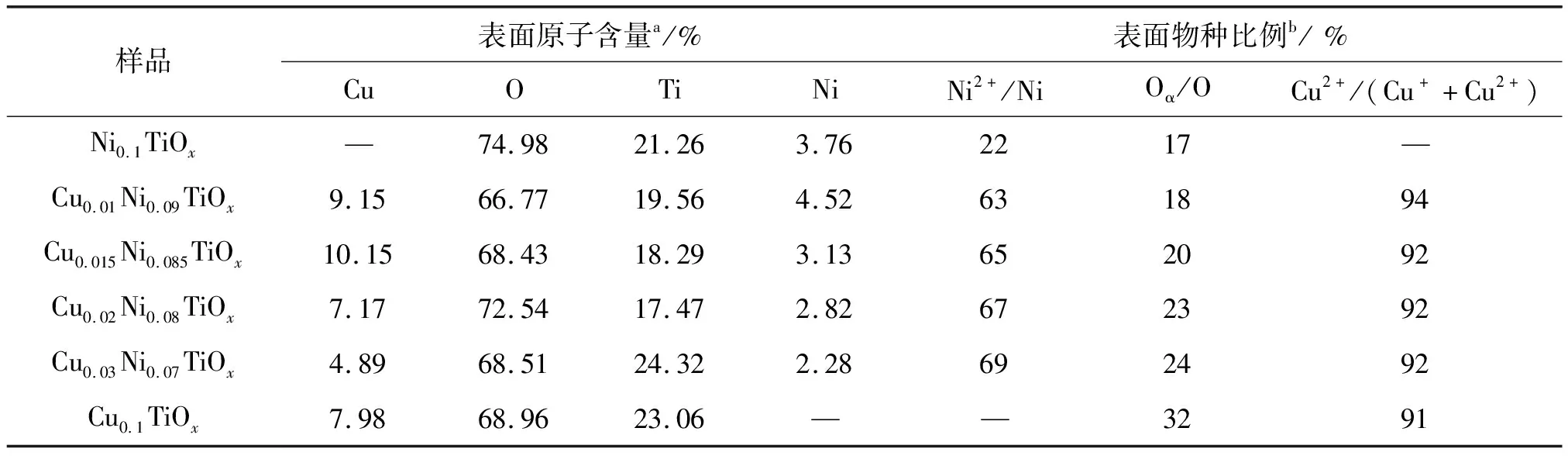
表2 CumNi0.1-mTiOx(m = 0、0.01、0.15、0.02、0.03和0.1)催化剂的表面组成
CumNi0.1-mTiOx催化剂的Ni 2p的XPS结果展示在图7(b)中,可将Ni 2p3/2分成三个峰,分别归属于Ni2+(854.6 eV)、Ni3+(856.0~856.2 eV)和卫星峰(861.2~861.8 eV)[15]。如图所示,催化剂的峰位置随着Cu的掺入向低结合能方向移动,表明Cu和Ni之间可能存在一定的相互作用。从表1中可以看出,Ni2+/(Ni2++Ni3+)(记作Ni2+/Ni)的比例随着Cu含量的增加而逐渐增大。从H2-TPR结果可以看出,随着Ni含量的降低和Cu含量的增加,Cu2+/(Cu++Cu2+)的量略有增加,并且还原峰温度随着Cu含量的增加而降低,结合Cu 2p和Ni 2p的XPS结果,可以证实Cu离子和Ni离子之间可能存在一定的相互作用,此结果与H2-TPR结果一致[16],即存在Ni3++ Cu+↔ Ni2++ Cu2+氧化还原循环,而且更多Ni2+和Cu2+的存在对氧化还原反应的进行也是十分有利的。
CumNi0.1-mTiOx催化剂的O 1s的XPS结果展示在图7(c)中。将O 1s XPS光谱分成三个峰,530.7~530.9 eV处的峰归属于表面化学吸附氧(Oα),529.1~529.8 eV处的峰归属于表面晶格氧O2-(Oβ),532.9~533.5 eV处的峰归属于催化剂表面吸附水中的氧(Oγ)[17]。根据峰面积,对Oα/(Oα+Oβ+Oγ)的相对含量(记作Oα/O)进行计算(见表2),可以发现CumNi0.1-mTiOx催化剂的Oα/O比率随着Cu含量的增加而增大,这说明Cu引入以后,增加了表面吸附氧物种,因而促进了NO氧化成NO2,加快了SCR反应的进行,从而提高催化剂的低温活性[18]。
CumNi0.1-mTiOx催化剂的Ti 2p XPS结果展示在图7(d)中。在高结合能处(458.0~459.0 eV)的峰归属于Ti 2p3/2,低结合能处(463.6~465.0 eV)的峰归属于Ti 2p1/2[19],与Ti4+的特征峰一致,表明Ti4+存在于CumNi0.1-mTiOx催化剂表面。此外,相比于Ni0.1TiOx催化剂,系列CumNi0.1-mTiOx(m= 0.01、0.15、0.02、0.03和0.1)催化剂的Ti2p3/2和Ti2p1/2峰向高结合能方向移动,这表明Cu、Ni和Ti三者氧化物之间存在的相互作用,使Ti物种的表面电荷密度更低,因此能够在催化剂表面发生两个氧化还原反应(Cu2++ Ti3+↔ Cu++ Ti4+和Ni3++ Ti3+↔ Ni2++ Ti4+)。
2.3 原位DRIFTS分析
2.3.1 NH3/NO + O2吸附
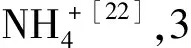

图8 Cu0.015Ni0.085TiOx催化剂在150 ℃时吸附NH3 (a)和NO+O2(b)的原位红外谱图
2.3.2 NOx和NH3物种之间的反应

图9 Cu0.015Ni0.085TiOx催化剂在150 oC时先吸附NO+O2、再通入NH3(a)和先吸附NH3、再通入NO+O2(b)的原位红外光谱图
2.4 Cu的取代对催化剂活性促进的原因
Cu的加入很明显能够有效地提升CumNi0.1-mTiOx催化剂的低温活性,特别是Cu0.015Ni0.085TiOx催化剂展现出更好的低温活性和宽的活性温度窗口(210~390 ℃,大于 90%的NO转化率)。这主要归因于Cu的加入产生了Cu、Ni和Ti间的相互作用,从而增强了催化剂的氧化性能。
H2-TPR和NO、NH3的单独氧化结果表明,Ni被Cu取代提高了CumNi0.1-mTiOx催化剂的氧化能力。XPS结果证实Cu的掺入能导致在催化剂表面富集大量的Cu物种,且Cu2+浓度和表面吸附氧(Oα)浓度较高(表2),有利于促进NO氧化成NO2,从而提高NH3-SCR反应的低温活性。但过强的氧化性也会导致NH3发生过氧化,从而降低高温下N2的选择性。因此,加入少量的Cu可以有效地提高低温活性,防止高温下NH3的过氧化,从而获得较好的N2选择性。
此外,酸性也对催化剂的活性有着很大的影响。NH3-TPD结果表明,Cu取代Ni后,CumNi0.1-mTiOx催化剂的酸含量有所增加,能提升NH3的吸附和活化,其中Cu0.015Ni0.09TiOx催化剂具有最高的表面酸度,这也是其具有优异的NH3-SCR性能的原因之一。
原位红外光谱测试结果表明,对于Ni0.1TiOx和Cu0.015Ni0.085TiOx催化剂,NH3和NOx通过吸附在催化剂表面的相邻活性位点相结合,并分解为N2和H2O,遵循L-H反应机理。然而,相比于Ni0.1TiOx催化剂,Cu0.015Ni0.085TiOx催化剂对NOx物种的吸附能力较弱,同时可能与气相的NO2直接发生反应,存在E-R机理,因而展现了更好的低温活性。
3 结 论
(1)Cu0.015Ni0.085TiOx催化剂在210~390 ℃表现出100%的NO转化率以及90%以上的N2选择性。同时,该催化剂也展现了一定的抗水抗硫能力,在温度为200 ℃,当通入100 ppm SO2和5% H2O时,NO转化率维持在60%。
(2)XRD、H2-TPR和NH3-TPD结果表明,Cu的掺入能够提升催化剂的氧化还原能力和表面酸性,使Cu在催化剂表面富集,形成了更多的表面吸附氧(Oα)物种,有利于促进NO氧化成NO2,从而提高了催化剂的低温活性。
(3)通过insituDRIFTS研究发现,Ni0.1TiOx和Cu0.015Ni0.085TiOx催化剂的NH3-SCR反应主要通过表面吸附态的NOx和吸附态的NH3物种之间进行,遵循L-H反应机理,同时Cu0.015Ni0.085TiOx也可能与气相的NO2直接发生反应,存在E-R机理。

