阿米洛利介导PI3K/AKT信号通路对急性 呼吸窘迫综合征大鼠肺损伤的作用机制
朱磊, 郭鸿, 井高静, 帅佃奎, 熊怀玉, 黄蔷茹, 刘健*
(兰州大学 第一医院 1.重症医学科, 2.内分泌科. 甘肃 兰州 730030)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是肺部过度炎症反应引起的疾病,发病特征为急性发作非心源性肺水肿、双侧肺浸润和呼吸系统顺应性降低,临床表现为难治性低氧血症,死亡率高[1],严重威胁患者的生命安全,一直是科研工作者重点关注的领域.但是由于ARDS发病机制复杂、病理机制认识不足、新的治疗方法发展受阻等原因,临床上仍然无法取得满意的治疗效果[2].因此,探索新药及其作用机制对临床治疗ARDS有重要的意义.
阿米洛利目前在临床主要治疗心力衰竭、肝硬化和慢性肾炎等引起的顽固性水肿或腹水,其主要作用于肾小管远端,阻断钠-钾交换机制,促使钠氯排泄,同时减少钾、氢离子分泌,具有抗炎和抗氧化的作用[3-4].有研究显示,阿米洛利在心肌缺血再灌注损伤中具有抗细胞凋亡的作用[5],而细胞过度凋亡可引起肺组织损伤[6].有学者发现阿米洛利可以缓解大鼠肺缺血再灌注的症状[7],但在ARDS致肺损伤中是否有治疗作用目前没有相关研究印证.基于此,本课题组拟建立油酸诱导型ARDS大鼠模型,以探讨阿米洛利对ARDS大鼠肺损伤的治疗作用,以及PI3K/AKT信号通路在其中的作用,从而为ARDS的治疗提供理论基础.
1 材料与方法
1.1 实验动物
雄性Wistar大鼠,96只,体质量为 180~200 g,购自兰州大学实验动物中心,均为合格实验动物(批号:0000894),本研究得到兰州大学第一医院动物伦理批准(批号:LDYYLL2019-137).
1.2 试剂与仪器
阿米洛利、二甲基亚砜(DMSO)均购自Sigma公司;羊多克隆抗体IgG购自北京中杉金桥生物技术有限公司;大鼠肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)和白介素-10(interleukin-10,IL-10) Elisa试剂盒购自酶联生物;预染Marker购自美国Thermo公司;牛血清白蛋白、甘氨酸、β-actin、Tris、RIPA裂解液、SDS-PAGE凝胶配制试剂盒均购自北京索莱宝科技有限公司;PVDF膜、ECL发光液均购自密理博(Millipore)中国有限公司;PI3K抗体、AKT抗体、p-AKT抗体购于Genetex公司,GAPDH抗体购于Immunoway 公司,p-PI3K抗体购于Abcam公司;Tween-20上海碧云天生物技术有限公司;RNA提取试剂盒、cDNA合成试剂盒、荧光定试剂盒均购自上海翊圣生物科技有限公司.
Western blot转膜仪(北京六一,DYCZ-40G)、Western blot电泳仪(美国Bio-rad公司,Powerpac Universal);NanoDrop核酸浓度测量仪(美国Thermo公司,ND-ONE-W);实时定量PCR仪(美国ABI,StepOne Plus).
1.3 实验方法
1.3.1 实验分组及ARDS大鼠模型建立
雄性Wistar大鼠96只,适应性饲养7 d后,将其随机分为4组:空白对照组(n=24)、DMSO组(n=24)、ARDS组(n=24)、阿米洛利组(n=24).
大鼠称量体质量后,每千克大鼠体质量腹腔注射质量分数为10%的水合氯醛350 mg进行麻醉,将穿刺部位毛剔除,碘伏、乙醇棉球局部消毒,在一侧腹股沟韧带处作一纵切口后分别分离股动脉、股静脉,将股静脉置管穿刺进入股静脉.
空白对照组大鼠用微量进样器链接股静脉置管后缓慢注入相应体积的生理盐水(每千克体质量注射生理盐水1.0 mL).
DMSO组由股静脉缓慢注入相应换算体积DMSO(每千克体质量注射DMSO溶液0.1 mL),30 min后再缓慢注入同空白对照组相同体积的生理盐水.
ARDS组由股静脉先缓慢注入相应换算体积的油酸(每千克体质量注射油酸0.1 mL),再缓慢注入同空白对照组相同体积的生理盐水.给药后3 min左右,观察大鼠一般情况,若出现呼吸频率增快、呼吸费力、活动减少、毛发直立、嘴唇、颜面紫绀等提示动物ARDS模型成功[8].
阿米洛利组由股静脉缓慢注入油酸(每千克体质量注射油酸0.1 mL),观察大鼠一般情况,30 min后缓慢注入阿米洛利(将4.8 mg 阿米洛利溶解于2.4 mL DMSO溶液中,然后吸取注射,每千克体质量注射0.1 mL),再缓慢注入生理盐水(每千克体质量注射生理盐水0.8 mL).
1.3.2 样品收集
(1)肺组织 大鼠颈椎脱臼处死后,迅速剥取大鼠肺组织,生理盐水清洗肺表面,部分组织用质量分数为4%的多聚甲醛溶液固定,部分组织经液氮速冻后转移至-80 ℃保存,用于后续RT-PCR、Western blot、免疫组化和HE实验.
(2)肺泡灌洗液(alveolar lavage fluid, BALF) 将大鼠颈部毛发剃除后充分暴露颈部,用体积分数75%的乙醇消毒,纵向切开皮肤,暴露气管,结扎右支气管,于气管下1/3处开倒“T”字口,插入无菌塑料管约1~1.5 cm,使插管插至左主支气管内,固定插管.用37 ℃生理盐水灌洗(每千克大鼠体质量使用生理盐水15 mL),再将灌洗液缓慢抽出,重复该步骤5次.在灌洗时,同时给予大鼠0.3 mL空气,确保生理盐水到达大鼠肺脏.每次灌洗回收液的回收率>80%,此即为BALF.将BALF转移至预冷的离心管中,于4 ℃、1 500 r/min条件下离心15 min,取上清液,-80 ℃保存.
1.3.3 ELISA检测BALF中TNF-α、IL-6和IL-10质量浓度
将样品加入96孔板中,设置空白对照孔和待测样品孔,依次加入样品稀释液40 μL和待测样品10 μL;空白对照孔中不加样品,每孔中分别加入酶标试剂100 μL,其余步骤同待测样品孔;酶标板经封板膜封闭后,于37 ℃下孵育60 min;酶标板孵育完成后,依次加入显色剂A和显色剂B显色反应,终止反应后,采用酶标仪于450 nm处测量各孔的吸光度,绘制标准曲线,计算大鼠BALF中TNF-α、IL-6和IL-10质量浓度.
1.3.4 HE染色观察大鼠肺组织病理学变化
取出经多聚甲醛固定的标本,常规石蜡包埋,二甲苯中浸泡2次,每次10 min,体积分数为100%的乙醇中浸泡2次,每次2 min, 体积分数分别为95%、90%和85%的乙醇中脱水1 min,蒸馏水浸泡1 min,进行脱蜡水化;苏木素染色5 min,流水冲洗2 min,体积分数为1%的盐酸乙醇浸泡2 s,水洗2 min,返蓝2 min(80 ℃左右热水):质量分数为0.5%的伊红染色5 min,经水洗2 min,体积分数分别为75%、85%和90%的乙醇各浸泡1 min,体积分数为95%的乙醇浸泡2 min,100%乙醇中浸泡2次,每次3 min.二甲苯中浸泡3次,每次10 min.中性树胶封片.显微镜下观察组织病理学变化.
1.3.5 免疫组化检测ET-1、VCAM-1和VEGF因子表达
采用免疫组化方法检测大鼠肺组织中血清内皮素-1(endothelin-1,ET-1)、血管细胞粘附分子-1(vascular cell adhesion molecule 1,VCAM-1)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的阳性表达,具体实验操作参照试剂盒说明书.
1.3.6 Western blot检测大鼠肺组织PI3K/AKT信号通路关键蛋白AKT、p-AKT、PI3K、p-PI3K的蛋白表达
取出液氮保存的肺组织,研碎至匀浆后,4 ℃放置30 min,13 000 r/min离心10 min,取部分上清,BCA试剂盒检测蛋白质量浓度,另一部分上清加入4倍上样缓冲液,煮沸变性后,用质量分数为4%的浓缩胶和质量分数为10%的分离胶电泳分离,PVDF膜和滤纸浸泡转膜缓冲液中,接通电源,在400 mA电流下转膜1.5 h;转膜结束,取出PVDF膜置于质量分数为5%的脱脂奶粉中,室温封闭1.5 h,用TBST稀释一抗(V一抗:VTBST=1∶1 000),将目的条带浸于其中,于4 ℃过夜孵育.一抗孵育完成,用TBST洗涤条带3次,每次10 min.将目的条带浸入二抗稀释液(V二抗∶VTBST=1∶6 000)中,于37 ℃孵育1.5 h后,再次用TBST洗涤条带3次,每次10 min.目的条带放置自动曝光装置的暗盒中,条带滴加ECL发光液(V试剂A∶V试剂B=1∶1)反应5 min,使其显色发光.自动曝光系统曝光并拍照,条带用Image Pro进行分析.
1.3.7 RT-PCR检测大鼠肺组织中PI3K、AKT的mRNA表达
按照试剂盒说明书提取各组织中的总RNA,检验纯度和完整性后,检测肺组织中PI3K和AKT的mRNA表达变化,关键步骤:肺组织标本加入1.5 mL Trizol于研磨至匀浆,室温静置5 min,13 000 r/min 离心5 min,吸取上清,加入氯仿(V上清∶V氯仿=5∶1),静置离心,吸取上清加入等体积异丙醇(V上清∶V异丙醇=1∶1),静置离心,弃去上清,体积分数为75%的乙醇清洗沉淀,离心弃上清,保留沉淀干燥,用DEPC水溶解.按照Takara反应试剂盒说明书依次进行去除基因组DNA反应、反转录反应和RT-PCR扩增,预变性:95 ℃、10 min、1循环数;扩增:95 ℃、15 s,60 ℃、15 s,72 ℃、30 s、40循环数.扩增结束后,计算目的基因相对表达量F=2-ΔΔCt.其中ΔΔCt=(待测样品目的基因的Ct平均值-待测样本管家基因的Ct平均值)-(对照样品目的基因的Ct平均值-对照样本管家基因的Ct平均值).
1.3.8 统计分析
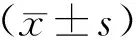
2 结果
2.1 ARDS大鼠模型构建结果
注射油酸约3 min后,ARDS组和阿米洛利组大鼠开始出现呼吸窘迫综合征样症状,包括呼吸频率增快、呼吸费力、活动减少、毛发直立、嘴唇、颜面紫绀等,提示ARDS大鼠模型构建成功.空白对照组和DMSO组大鼠无上述变化,精神状态、呼吸、活动情况等良好.
2.2 各组大鼠BALF中TNF-α、IL-6和IL-10的变化
注射油酸4 h、8 h和12 h后,与空白对照组比较,DMSO组TNF-α、IL-6、IL-10的变化不具有统计学差异(P>0.05);与DMSO组比较,ARDS组大鼠BALF中TNF-α、IL-6质量浓度均显著升高(P<0.05),IL-10质量浓度均显著降低(P<0.05);与ARDS组比较,阿米洛利组大鼠BALF中TNF-α、IL-6质量浓度均显著降低(P<0.05),IL-10质量浓度均显著升高(P<0.05)(图1).由此提示,阿米洛利可降低ARDS大鼠BALF中促炎因子TNF-α、IL-6质量浓度,增加抗炎因子IL-10质量浓度,进而影响ARDS大鼠的炎症反应.

1) P<0.05
2.3 大鼠肺组织病理学变化
对各组大鼠肺组织切片进行HE染色,观察发现空白对照组和DMSO组大鼠肺组织结构完整、清楚,未发生明显的病理学变化和炎性细胞浸润,且两组之间无统计学差异.油酸注射4 h后,与空白对照组比较,ARDS组和阿米洛利组大鼠肺组织切片中可见肺水肿、出血,肺泡壁增厚,部分肺泡结构被破坏.油酸注射8 h和12 h后,与空白对照组比较,ARDS组大鼠肺组织切片中肺水肿、肺泡结构破坏明显,部分肺泡坏死,炎性细胞浸润,进一步提示ARDS大鼠模型构建成功.与ARDS组比较,阿米洛利组大鼠肺部肺水肿、肺泡结构破坏及肺泡壁增厚现象明显被改善,炎性细胞浸润减少(图2).由此提示,阿米洛利可明显修复ARDS大鼠的肺部组织结构.
2.4 大鼠肺组织中ET-1蛋白表达变化
注射油酸4 h后,空白对照组和DMSO组ET-1呈弱阳性表达,视野中可见少量棕黄色,且两组间ET-1阳性表达水平无统计学差异(P>0.05);与空白对照组比较,ARDS组ET-1阳性表达明显增多,具有统计学差异(P<0.05);与ARDS组比较,阿米洛利组大鼠肺组织中ET-1阳性表达明显减少,具有统计学差异(P<0.05).注射油酸8 h、12 h后,空白对照组和DMSO组大鼠肺组织切片中ET-1表达变化情况和4 h一致,与ARDS组比较,阿米洛利组大鼠肺组织中ET-1阳性表达均明显减少,具有统计学差异(P<0.05),且阿米洛利干预后,ET-1的表达量随着时间越来越低,说明阿米洛利可下调ET-1水平,对ARDS大鼠肺部起到治疗作用(图3).
2.5 大鼠肺组织中VCAM-1蛋白表达变化
注射油酸4 h后,空白组和DMSO组VCAM-1呈弱阳性表达,可见少量棕黄色视野,且两组间VCAM-1表达水平无统计学差异(P>0.05).与空白对照组比较,ARDS组VCAM-1阳性表达均明显增多,具有统计学差异(P<0.05);与ARDS组比较,阿米洛利组大鼠肺组织中VCAM-1阳性表达均明显减少,具有统计学差异(P<0.05).注射油酸8 h、12 h后,阿米洛利组大鼠肺组织中VCAM-1阳性表达减少更多,说明阿米洛利可下调VCAM-1水平,从而对ARDS大鼠肺部起到治疗作用(图4).

图2 各组大鼠肺组织病理学变化(HE,200×)

1) P<0.05

1)P<0.05
2.6 大鼠肺组织中VEGF蛋白表达变化
注射油酸4 h后,VEGF在大鼠肺组织中的阳性表达水平,其中空白组和DMSO组VEGF可见大量棕黄色视野,且两组间VEGF表达水平无统计学差异(P>0.05).与空白对照组比较,ARDS组VEGF阳性表明明显减少,具有统计学差异(P<0.05);与ARDS组比较,阿米洛利组大鼠肺组织中VEGF阳性表达明显增多,具有统计学差异(P<0.05).注射油酸8 h、12 h后,阿米洛利组大鼠肺组织中VEGF阳性表达增加多,说明阿米洛利可上调VEGF水平,从而对ARDS大鼠肺部起到保护作用(图5).

1) P<0.05
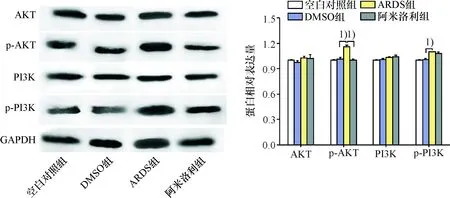
2.7 大鼠肺组织PI3K/AKT信号通路关键因子PI3K、p-P13、AKT和p-AKT 蛋白表达结果
注射油酸4 h后,与空白对照组比较,DMSO组PI3K、p-PI3K、AKT和p-AKT蛋白表达水平未发生明显变化,不具有统计学差异(P>0.05),ARDS组与DMSO组相比总PI3K和AKT蛋白表达不具有统计学差异(P>0.05),p-PI3K、p-AKT蛋白表达显著升高(P<0.05);与ARDS组比较,阿米洛利组总PI3K和AKT、p-PI3K的蛋白表达变化不具有统计学差异(P>0.05),p-AKT蛋白表达水平均降低(P<0.05).(图6)
注射油酸8 h后,与空白对照组比较,DMSO组AKT、p-AKT、PI3K、p-PI3K蛋白表达水平不具有统计学差异(P>0.05),ARDS组与DMSO组相比,总PI3K和AKT蛋白表达差异不显著(P>0.05);p-AKT和p-PI3K蛋白表达水平均显著升高(P<0.05);与ARDS组比较,阿米洛利组总PI3K和AKT蛋白表达差异不显著(P>0.05),p-AKT、p-PI3K蛋白表达水平均显著降低(P<0.05).(图7)
注射油酸12 h,与空白对照组比较,DMSO组PI3K、p-PI3K、AKT、p-AKT蛋白表达水平不具有统计学差异(P>0.05),ARDS组总PI3K和AKT蛋白表达不具有统计学差异(P>0.05); p-PI3K、p-AKT蛋白表达水平均显著升高(P<0.05);与ARDS组比较,阿米洛利组总PI3K和AKT蛋白表达差异不显著(P>0.05),p-PI3K、p-AKT蛋白表达水平均显著降低(P<0.05).(图8)
由此提示,阿米洛利可降低p-PI3K、p-AKT蛋白表达水平,从而抑制PI3K/AKT信号通路,保护ARDS大鼠肺部组织.
2.8 各组大鼠肺组织中AKT和PI3K mRNA表达变化
注射油酸4 h后,与空白对照组比较,DMSO组AKT和PI3KmRNA表达不具有统计学差异(P>0.05),与ARDS组比较,阿米洛利组大鼠肺组织中AKT和PI3KmRNA表达水平明显下调,具有统计学差异(P<0.01);注射油酸8 h和12 h后,与空白对照组比较,DMSO组AKT和PI3KmRNA表达不具有统计学差异(P>0.05);与ARDS组比较,阿米洛利组大鼠肺组织中AKT和PI3KmRNA表达水平均明显下调,具有统计学差异(P<0.05);在注射油酸8h时,ARDS组AKT和PI3KmRNA表达水平最高,随着油酸注射时间的延长,AKT和PI3KmRNA表达水平明显下降,进一步说明阿米洛利可抑制PI3K/AKT信号通路.(图9)
1) P<0.05

1) P<0.05

1) P<0.05

1) P<0.05
3 讨论
ARDS以肺水肿、难治性低氧血症、多种脏器功能衰竭为特征,是多种疾病炎症反应过度的结果,会引起肺泡-毛细血管屏障丧失、肺泡内充满液体、肥大上皮损伤、中性粒细胞和巨噬细胞流入、凝血激活和纤溶抑制导致纤维蛋白沉积等多种病理学变化[9-10].本研究采用的造模方法是通用的油酸诱导型大鼠ARDS模型,在病因上可模拟ARDS患者的病理生理学表现,且具有操作简便、稳定可靠等优点,被广泛应用[11-12],研究结果显示,大鼠注射油酸后,3 min左右开始出现呼吸窘迫综合征样症状,同时 ARDS大鼠肺组织有肺泡水肿、肺泡出血、肺泡壁破坏等典型病理改变的情况,说明ARDS大鼠模型构建成功,可以用作下一步实验.为了确定阿米洛利溶解剂DMSO对大鼠有无影响,本研究设计大鼠仅注射DMSO的DMSO组,结果显示,DMSO组和空白对照组大鼠之间各种变化并无统计学差异,因此,讨论中将不再对DMSO组进行单独分析说明.
TNF-α作为重要的促炎因子[13],不仅能损伤血管内皮,摧毁其屏障功能,增加毛细血管通透性,促使大量液体渗出,形成肺水肿,导致ARDS的发生,还可抑制抗氧化剂的产生,使组织中氧自由基增多,加重组织损伤和疾病恶化[14-15].研究表明,TNF-α、IL-6、IL-10等参与ARDS引起的肺损伤和修复.正常情况下,机体内TNF-α表达量低,而当机体处于病理状态时,TNF-α被大量释放到局部组织,介导疾病的发展.IL-10是一种抗炎细胞因子,通过抑制机体的炎症反应恢复机体炎症和抗炎反应之间的平衡[16],促炎因子与抗炎因子相互作用的程度决定了ARDS炎症反应的发展方向,本研究发现在ARDS大鼠的BALF中,抗炎因子TNF-α和IL-6质量浓度均显著增加,促炎因子IL-10质量浓度减少;而当给予大鼠阿米洛利干预后,TNF-α和IL-6质量浓度均显著减少,IL-10质量浓度增加,提示阿米洛利可通过抑制炎症因子TNF-α和IL-6的质量浓度和促进抗炎因子IL-10的质量浓度,从而减轻ARDS大鼠的炎症反应.
ET-1主要产生于肺中,在呼吸系统中发挥血管调节、支气管收缩、细胞增殖和炎症等多种生物活性[17].临床试验中,ARDS患者ET-1水平升高,与疾病的严重程度相关[18],是ARDS发病机制中的炎性介质之一,ET-1可诱导产生TNF-α、MCP-1和VCAM-1等多种促炎因子[19].VEGF是ARDS导致肺损伤的主要调节因子,促进ARDS的发生和发展[20].VCAM-1正常条件下低表达或不表达,当ARDS发生时,其在肺泡上皮、血管上皮和支气管黏膜上皮细胞中高表达,也是用于评估ARDS严重程度的生物标志物之一.本研究发现在ARDS大鼠肺组织中ET-1、VCAM-1的表达水平明显高于空白对照组,而VEGF的表达水平低于空白对照组,利用阿米洛利干预治疗后,ARDS大鼠肺组织中ET-1、VCAM-1表达水平则显著下调,而VEGF的表达水平出现上调,说明阿米洛利对ARDS大鼠肺损伤具有修复和保护的作用.
PI3K/AKT通路参与多种生物学过程.研究表明,脂多糖通过PI3K/AKT信号通路调节人肺微血管内皮细胞屏障功能[21].血红素氧合酶-1抑制脂多糖诱导的ARDS大鼠模型的氧化应激和肺损伤可能是通过PI3K/AKT信号通路实现的[22].在ARDS小鼠肺组织中用PI3K抑制剂渥曼青霉素上调p-AKT蛋白表达水平,加重了ARDS和肺损伤[23].由此可见,PI3K/AKT信号通路在ARDS中发挥重要作用.本研究发现在ARDS大鼠肺组织中PI3K/AKT信号通路被激活,使大鼠BALF中促炎因子大量释放,抗炎因子被抑制;而阿米洛利干预后大鼠肺组织中p-PI3K、p-AKT表达减少,进而使TNF-α、IL-6、VCAM-1和ET-1水平下调,IL-10和VEGF水平上调,改善ARDS大鼠肺水肿及炎症反应,从而发挥其对ARDS大鼠肺损伤的保护作用.但是在ARDS的发生和发展过程中,多个信号通路共同参与调节其发展.本研究仅对 PI3K/AKT 信号通路进行了研究,而阿米洛利改善 ARDS 大鼠肺损伤过程中是否存在其他信号通路,这些信号通路之间的平衡是如何调控的,还有待进一步的研究.
综上所述,本研究发现阿米洛利在ARDS致肺损伤中具有治疗作用,并证实PI3K/AKT信号通路是该保护作用的机制之一,为ARDS的临床治疗提供了基础实验支持和新的思路.

