HK2基因表达与泌尿系肿瘤的发生、免疫 细胞浸润及预后的相关性分析
李兰兰, 付生军, 陶燕, 刘善辉, 张静, 卢建中
(1.兰州大学 第二医院甘肃省泌尿系统疾病研究重点实验室, 甘肃 兰州 730030;2.兰州大学 第二医院甘肃省泌尿系疾病临床医学中心, 甘肃 兰州 730030)
能量代谢作为肿瘤发生发展的特征之一在肿瘤发生发展中发挥重要的作用.正常细胞在有氧环境中主要依靠线粒体氧化磷酸化代谢葡萄糖产能,低氧环境会迫使糖代谢转向糖酵解.而肿瘤细胞即使在有氧环境下均以糖酵解为主要能量来源,即有氧糖酵解或Warburg效应[1].糖酵解的第一个限速酶己糖激酶(hexokinase, HK)催化葡萄糖代谢的第一步,可磷酸化底物葡萄糖为6-磷酸葡萄糖.HK催化的反应中间产物也是调节糖代谢和其他生物合成途径的一个焦点,因此HK成为调节肿瘤生长和转移的重要靶点.多种癌症细胞可通过上调己糖激酶2(hexokinase 2,HK2)表达来改变癌细胞糖代谢.肿瘤中葡萄糖代谢率升高、肿瘤进展和高死亡率主要与HK2过度表达有关[2].HK2的上调会促进不同肿瘤细胞的化疗抵抗和转移[3],使HK2成为抑制肿瘤细胞糖代谢的重要靶点.为了探究HK2在泌尿系肿瘤中的作用,本文使用基因表达数据集分析泌尿系统肿瘤中HK2表达与肿瘤分期分级、肿瘤患者预后的关系.进一步分析HK2表达水平与肿瘤组织中免疫细胞浸润水平的相关性、免疫细胞标志物表达水平的相关性及与肿瘤微环境的相关性.
1 材料和方法
1.1 基因表达分析
HK2基因在不同癌症类型中的表达水平使用Oncomine数据库[4]中数据集分析.分析过程中概率(p)和变化倍数(FC)阈值分别设置为0.05和1.5.
1.2 生存分析
HK2基因在不同癌症病人的生存曲线,使用Kaplan-Meier在线绘图工具产生[5].该网站包含了基因表达、癌症基因组图谱(TCGA)和癌症生物医学信息网格组装微阵列基因表达信息和存活等数据集信息.根据目的基因表达水平将癌症病人分为高表达和低表达两组,对其总生存率(OS)和无进展生存(PFS)进行分析,计算95%置信区间(CI)的风险比(HR).使用log-rank法计算两组患者的生存曲线之间的差异.
1.3 肿瘤免疫细胞浸润评估
HK2表达与膀胱癌(BLCA)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)和前列腺癌(PRAD)中免疫细胞浸润的相关性及与免疫细胞标志物表达水平的相关性使用TIMER[6]分析,同时也分析了HK2表达水平与肿瘤免疫微环境中免疫细胞和基质细胞浸润的相关性.HK2表达和肿瘤免疫浸润细胞的分子标记物表达之间的相关性使用TIMER的相关性模块分析获得.
1.4 GEPIA分析
HK2在泌尿系肿瘤表达水平与免疫细胞标志物表达水平相关性分析借助GEPIA在线工具(http://gepia.cancer-pku.cn/index.html)的单基因分析工具中Correlation模块分析获得.
2 结果
2.1 HK2 mRNA表达水平
HK2在不同肿瘤和癌旁组织中mRNA表达差异水平如图1所示.与正常癌旁组织相比,HK2在膀胱癌(BLCA)、胆管癌(CHOL)、食管癌(ESCA)、头颈鳞状细胞癌(HNSC)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)、肺鳞癌(LUSC)、前列腺癌(PRAD)、胃癌(STAD)、甲状腺癌(THCA)、子宫内膜癌(UCEC)等大多数癌症组织中表达显著上调.仅在结肠癌(COAD)、肾嫌色细胞癌(KICH)、肺腺癌(LUAD)和直肠腺癌(READ)中表达显著下调.
4种泌尿系肿瘤(BLCA、KIRC、KIRP和PRAD)中HK2表达水平与肿瘤分期分级的关系如在图2,其中前列腺癌分级采用Gleason score.在BLCA中,HK2表达随着肿瘤分级增加而降低,提示HK2在进展期和转移膀胱癌中发挥不同的作用.HK2表达在不同分级KIRC中变化不大.在KIRP和PRAD中,HK2在最高级别肿瘤中均显著高于低级别肿瘤,提示HK2参与促进癌症进展或转移.
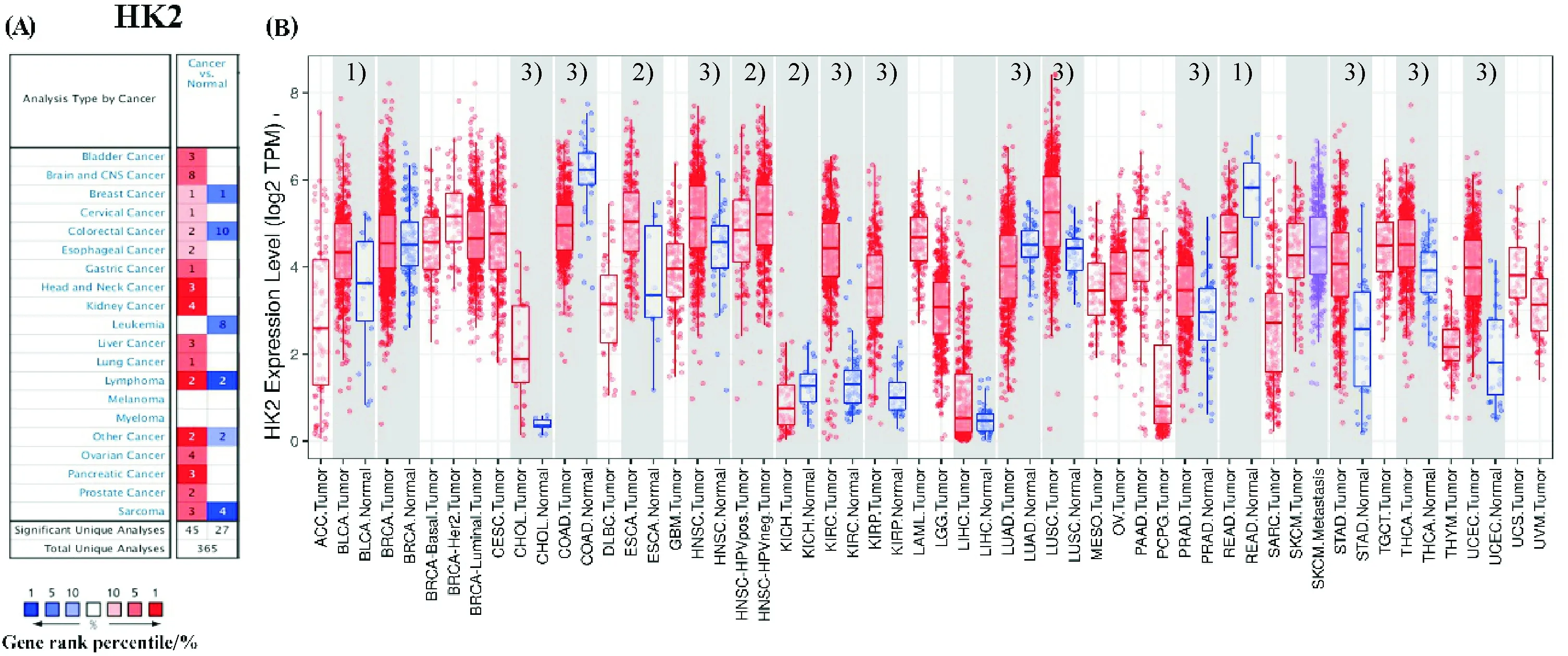
图1 不同癌症中HK2基因mRNA表达情况.(A) Oncomine数据库中HK2基因在不同癌症和癌旁组织中表达水平.(B)使用TIMER网站绘制的TCGA数据库中不同肿瘤类型中HK2的mRNA表达水平. 1)P<0.05, 2)P<0.01, 3)P<0.001.
2.2 HK2表达水平与癌症患者预后不良相关
Kaplan-Meier中分析的HK2表达与癌症患者预后的生存曲线如图3.从图中可以看出HK2的表达水平与泌尿系肿瘤患者的总生存期显著相关,logrankp均小于0.05.在BLCA和KIRC中,HK2基因低表达患者的OS显著低于高表达患者,p分别为0.009 6和0.002,HR分别为0.67(0.5~0.91)和0.56(0.38~0.81);PFS在HK2低表达患者同样低于高表达患者,p为0.087和0.21,HR分别为0.55(0.27~1.1)和0.52(0.19~1.45),提示HK2低表达可能是BLCA和KIRC患者的不良预后因子.而KIRP中,HK2高表达患者的OS和PFS显著低于HK2低表达患者,p分别为0.024和0.039,HR分别为1.99(1.08~3.65)和2.76(1.02~7.5),提示HK2高表达不利于KIRP患者预后.
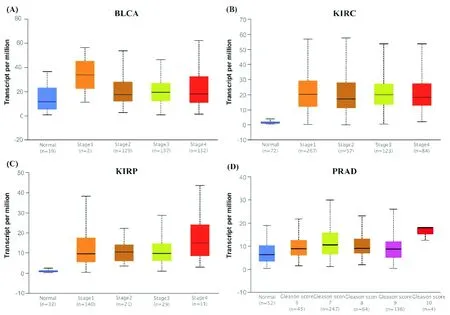
图2 HK2基因在泌尿系肿瘤不同分级分期表达水平.(A)膀胱癌;(B)肾透明细胞癌;(C)肾乳头状细胞癌;(D)前列腺癌.
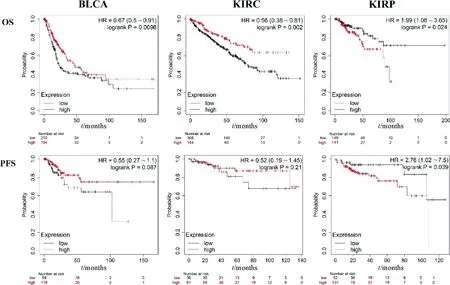
图3 HK2表达水平与泌尿系肿瘤的总生存期(OS)和无进展生存期(PFS)关系.
2.3 HK2表达与免疫细胞浸润水平相关
泌尿系肿瘤中HK2表达与6种浸润性免疫细胞之间的相关性如图4.可看出HK2在几种泌尿系肿瘤的表达水平与肿瘤纯度无明显相关性.BLCA和KIRP中HK2表达水平与多数免疫细胞浸润水平无明显相关性,BLCA中仅与巨噬细胞(Macrophages)呈显著负相关(r=-0.135,P=9.92e-3),而KIRP中与中性粒细胞(Neutrophils)和树突状细胞(Dendritic Cells)呈显著正相关,r和P分别为0.169和0.18,P分别为6.39e-3和3.93e-3.KIRC中,HK2表达水平与多数免疫细胞浸润水平呈显著正相关,如B细胞(r=0.315,P=4.61e-12)、巨噬细胞(r=0.28,P=1.71e-9)、中性粒细胞(r=0.377,P=6.85e-17)和树突状细胞(r=0.302,P=4.84e-11);而与CD4+T细胞(r=0.13,P=5.37e-3)和CD8+T细胞(r=0.166,P=4.90e-4)免疫浸润水平相关性不高.PRAD中HK2表达与CD8+T细胞(r=0.35,P=1.93e-13)、中性粒细胞(r=0.216,P=9.41e-6)和树突状细胞(r=0.233,P=1.54e-6)浸润水平呈显著正相关,而与CD4+T细胞浸润水平呈负相关,但无明显差异(r=-0.075,P=1.30e-1).
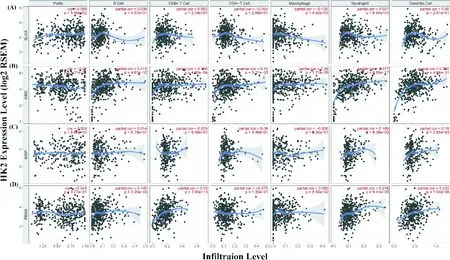
图4 泌尿系肿瘤中HK2表达和免疫细胞浸润水平相关性分析.(A) BLCA;(B) KIRC;(C) KIRP;(D) PRAD.
2.4 HK2表达水平与免疫细胞标志物表达水平相关性分析
HK2表达水平与一些免疫细胞标志物表达水平之间的相关性结果见表1.BLCA中HK2表达水平与多数免疫细胞标志物表达呈显著负相关,如单核细胞(CD86)和M2型巨噬细胞(CD163、MS4A4A);与肿瘤相关巨噬细胞(TAM)的标志物CCL2和IL10呈负相关,但无明显差异.而与M1型巨噬细胞标志物NOS2和PTGS2呈显著正相关.在KIRC和PRAD中,HK2表达水平与大部分免疫细胞标志物表达呈显著正相关,如CD86、CD115、CD68、IL10、VSIG4和MS4A4A等.而在KIRP中,HK2表达水平只与CD68、NOS2、PTGS2和CD163的表达水平呈显著正相关,与其他标志物表达呈正相关但无显著差异.
2.5 HK2表达与肿瘤微环境相关性分析
分析HK2表达水平与肿瘤微环境的相关性发现,KIRP和PRAD中HK2表达与肿瘤微环境(ESTIMATEScore)无明显相关性,包括ImmuneScore和StromalScore.而BLCA和KIRC中HK2表达与肿瘤微环境呈显著正相关,ESTIMTEScore的r分别为0.2和0.135,P值为4.77e-5和0.001 9.其中,BLCA中HK2表达与ImmuneScore和StromalScore呈显著负相关,r分别为-0.152和-0.217,P分别为0.002 05和1.02e-5;而KIRC中HK2表达仅与StromalScore呈显著正相关,r和P分别为0.179和3.6e-5,与ImmuneScore无明显相关性(图5).
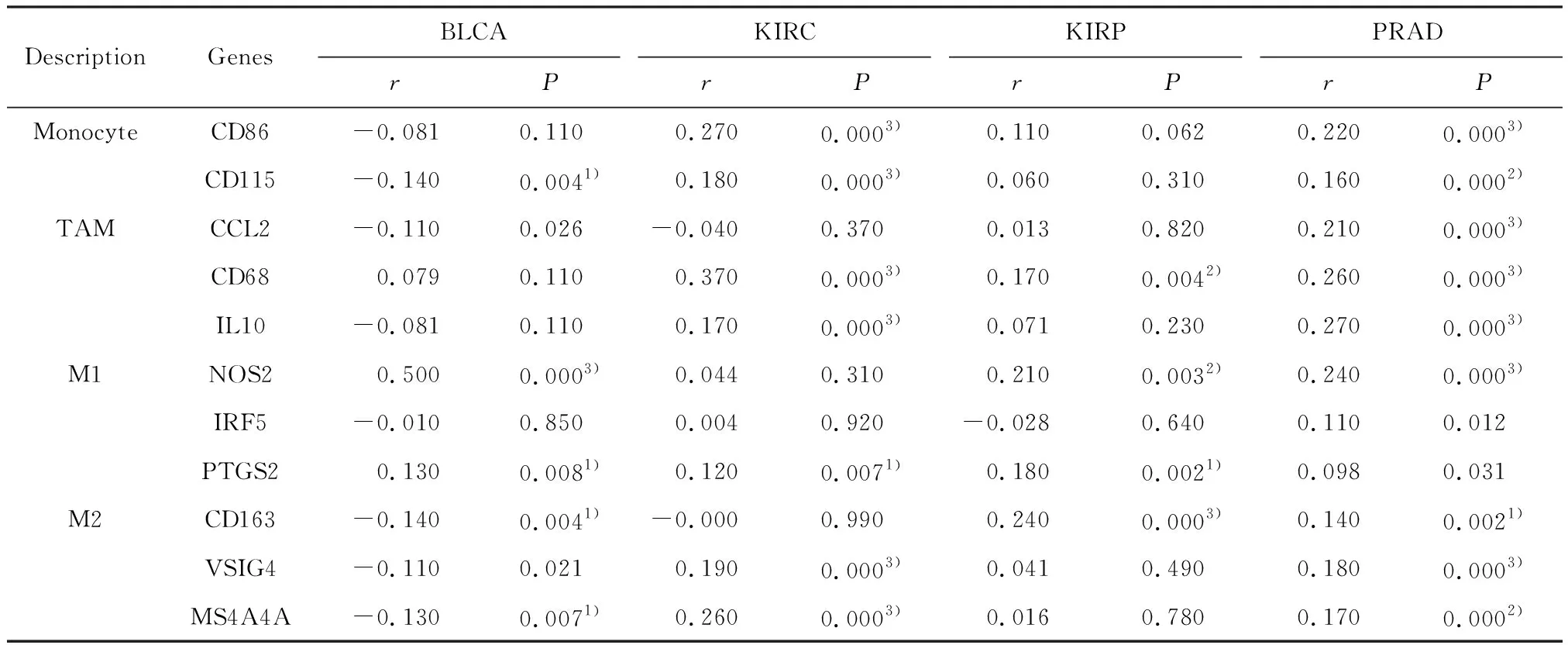
表1 HK2表达水平与免疫细胞标志物表达水平的相关性Table 1 The correlation between expression level of HK2 and immune cell markers
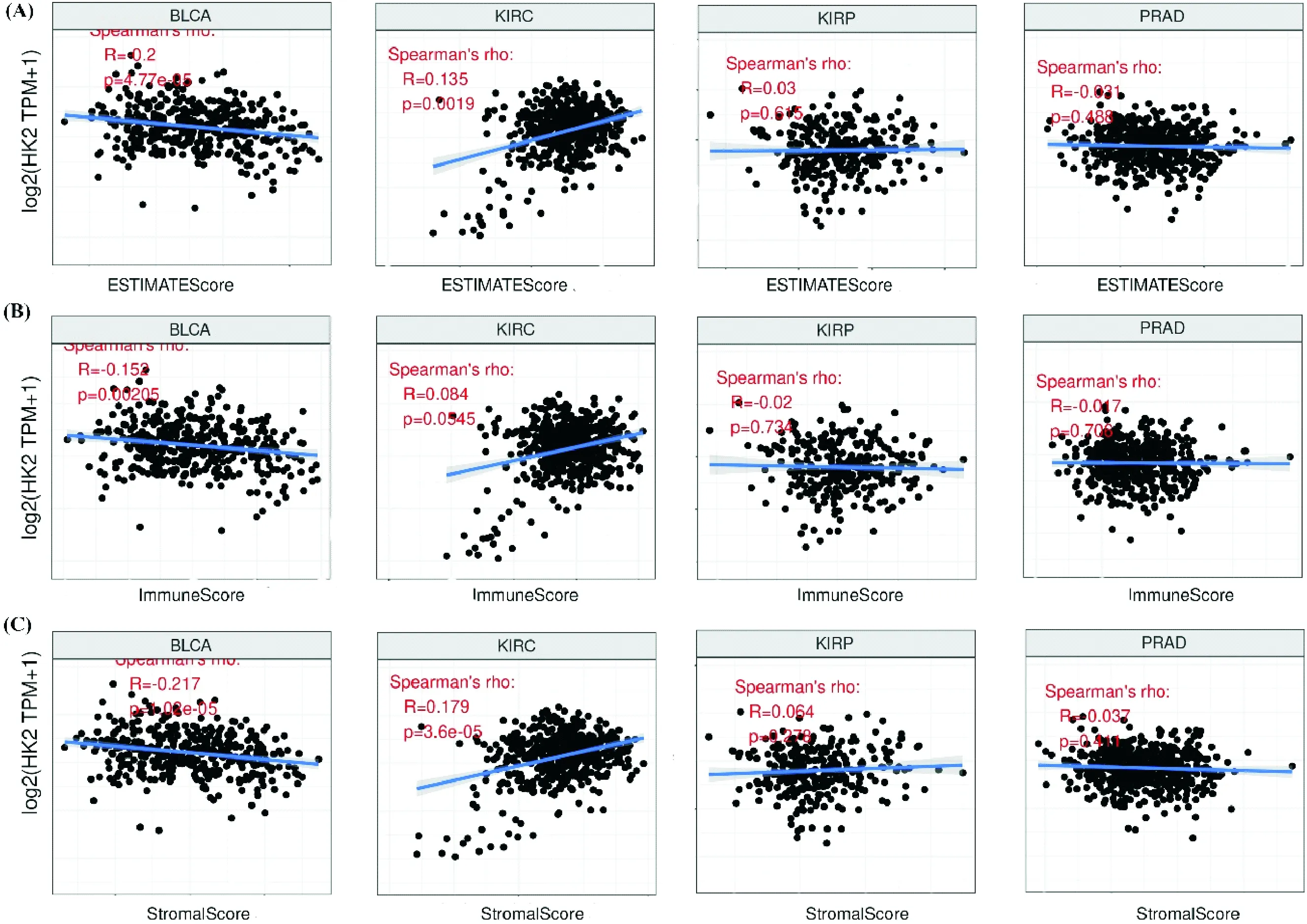
图5 BLCA、KIRC、KIRP和PRAD中HK2表达水平与肿瘤微环境中ESTIMATEScore (A)、ImmuneScore (B)和StromalScore (C)的相关性.
3 讨论
肾癌、膀胱癌和前列腺癌是最常见的泌尿系3大肿瘤,均具有较高的发病率和病死率,早期发现、诊断、治疗和预后预测可以显著改善患者的生命质量.目前对泌尿系肿瘤的手术、放化疗等综合治疗已获得相当的疗效,但存在手术治疗复发率高、放疗和化疗不良反应较大、放化疗耐药和转移、预后差等问题,对进展期和晚期肿瘤的治疗结果仍不甚理想,急需开展新的研究,发现有效的诊断标志物和诊断方法.
HK2作为HK组织特异性同工酶亚型之一,是催化糖酵解途径的第一个限速酶,在多种肿瘤组织中过表达并参与肿瘤中过度糖酵解过程[7].HK2过表达促进糖酵解并促进肿瘤生长、转移过程.在一些癌症中HK2对线粒体的结合能力显著增强,线粒体结合能降低线粒体外膜的通透性,增强HK2的酶催化活性,促进更多的葡萄糖转变成6-磷酸葡萄糖而进一步促进糖酵解作用[8].肿瘤细胞中过度的糖酵解产生大量乳酸造成肿瘤微环境的酸化,成为癌症进化和恶性进展的关键诱因,同时酸化的微环境加大了进化选择压力,进一步促进了侵略性和抗药性的出现[9].然而,在癌细胞中下游糖酵解活性被减弱以便将葡萄糖转移到分支代谢途径中,而关于HK2的研究发现,HK2催化的葡萄糖代谢最上游活性的增加对于将葡萄糖转移到癌细胞的这些分支途径中至关重要[10].与具有一个酶催化活性的HK1和HK3相比,HK2的N端和C端结构域均具有催化活性,因此具有更高的催化能力.而癌细胞中合成代谢的加速需要更强大的HK活性,因此需要诱导更多HK2的表达.因此,癌细胞与正常细胞相比表达高水平的HK2.HK2高表达与胆囊肿瘤恶性程度和预后不良呈显著相关,下调HK2表达可显著抑制胆囊癌细胞增殖、迁移和侵袭,同时葡萄糖消耗和细胞乳酸产量大大降低[11].对肝细胞癌的研究发现,敲除HK2可抑制癌细胞中糖酵解而促进氧化磷酸化水平,同时提高癌细胞对二甲双胍的敏感性[12].在HK2高表达HK1低表达的膀胱癌UMUC-3细胞中发现,抑制剂可减少细胞葡萄糖消耗水平、减少下游代谢产物乳酸的产生,同时抑制细胞中糖酵解水平[13].一些HK2的抑制剂,诸如2-脱氧葡萄糖、3-溴丙酮酸等可抑制多种肿瘤细胞的糖酵解作用而显现出抗癌作用[14],以上均提示HK2可作为有效的抗癌靶点.
HK2是乳腺癌[15]、喉鳞状细胞癌[16]、多形性胶质母细胞瘤[17]和胃腺癌[18]的潜在预后标志物.而泌尿系肿瘤中HK2表达水平与预后相关性的研究较少.本文讨论了HK2在泌尿系肿瘤中的作用,Oncomine和TIMER数据库中分析发现,HK2在BLCA、KIRC、KIRP和PRAD等泌尿系肿瘤中显著高表达.在BLCA中HK2随着肿瘤分级升高表达降低;KIRC中HK2表达不随肿瘤分级变化;而高级别KIRP和PRAD中HK2表达显著高于低级别肿瘤.生存分析发现,HK2表达水平与BLCA、KIRC和KIRP患者的预后显著相关.进一步分析发现HK2表达水平与泌尿系肿瘤组织中免疫细胞浸润水平、肿瘤微环境中stromal评分和immune评分、免疫细胞标志物表达水平相关.在结直肠癌和胰腺癌研究中发现,HK2低表达的患者预后更差,具有更短的无进展生存期和总生存期[2, 19],这一结果与我们分析的HK2在结直肠癌和胰腺癌组织中表达降低是一致的.此外,包括HK2在内的糖酵解相关基因介导了肿瘤组织中免疫细胞浸润水平及免疫治疗抵抗过程.Peng等[20]研究发现,肿瘤组织中糖酵解通路与黑色素瘤的免疫抵抗相关.骨髓中性粒细胞缺乏免疫抑制活性,患有早期癌症小鼠的骨髓中性粒细胞能更多地自发迁移至组织,同时伴随着氧化磷酸化和糖酵解速率的增加及ATP产量的增高[21].这一现象与本研究观察的KIRC、KIRP和PRAD中HK2表达水平与中性粒细胞浸润水平呈正相关是吻合的.蛋白质组学分析发现,CD8+T细胞浸润减少与高微卫星不稳定性肿瘤中糖酵解增加之间具有相关性,提示靶向糖酵解通路是克服肿瘤对免疫检查点抵抗的潜在治疗策略[22].
综上所述,HK2表达上调促进糖酵解参与泌尿系肿瘤发生发展过程,其在不同泌尿系肿瘤中发挥不同作用,具体作用机制还需进一步深入研究,并探究出更有效的治疗方案.总的来说,通过抑制HK2表达来降低糖酵解水平可为靶向HK2进行泌尿系肿瘤治疗提供理论指导.

