危重型新型冠状病毒肺炎患者T淋巴细胞亚群分析
吴强, 卢春晓, 肖强, 李晓龙, 江思维, 吴佳逢, 高虹*
(1. 深圳市第三人民医院 心内科, 广东 深圳 518112; 2. 南方医科大学 顺德医院 呼吸与危重症医学科, 广东 佛山 528000)
新型冠状病毒肺炎(Corona Virus Disease 2019, COVID-19,简称新冠肺炎)是由新型冠状病毒(SARS-CoV-2)引起的急性呼吸道传染病,COVID-19是严重影响人类健康和生命的重大公共卫生威胁,临床可分轻型、普通型、重型和危重型.重型和危重型转化速度快,现有治疗仍难以抑制部分患者的病情进展.COVID-19是中国乃至世界目前较为重大的公共卫生威胁.
有研究认为SARS-CoV-2侵入人体的途径与SARS相关冠状病毒(SARS-CoV)相同,即通过病毒表面的刺突蛋白与呼吸道上皮细胞表面的受体,即血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)相互结合,随后进入细胞内,引起一系列病理改变,并诱发炎症因子释放[1-2].早在 2005 年,Huang等[3]就发现细胞因子在SARS-CoV导致的急性呼吸窘迫综合征(SARS)中具有重要作用, 在一项分析武汉市41 例COVID-19确诊患者的研究中,也认为SARS-CoV-2感染的危重病人可能与炎症因子有关[4].因此分析COVID-19患者炎症和免疫反应特点,寻找早期的病情发展和预后转归预测指标具有重要意义.本研究分析深圳市第三人民医院2020年1月11日至2月5日收治的COVID-19患者152例,收集并记录患者的临床特征和血液生化指标, 初步分析COVID-19患者的炎症和免疫反应特点,以期寻找早期的病情发展和预后转归的潜在生物标志物.
1 资料与方法
1.1 对象
收集2020年1月11日至2月5日在深圳市第三人民医院住院、年龄在18岁以上、明确诊断为COVID-19的患者.
1.2 诊断及临床分型标准
1.2.1 诊断标准
诊断标准根据中华人民共和国国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》[5]:
1.疑似病例:有流行病学史中的任何1条,且符合临床表现中任意2条;无明确流行病学史的,符合临床表现中的3条.
(1)流行病学史:①发病前14 d内有武汉市及周边地区,或其他有病例报告社区的旅行史或居住史;②发病前14 d内与新型冠状病毒感染者(核酸检测阳性者)有接触史;③发病前14 d内曾接触过来自武汉市及周边地区,或来自有病例报告社区的发热或有呼吸道症状的患者;④聚集性发病.
(2)临床表现:①发热和/或呼吸道症状;②具有新型冠状病毒肺炎影像学特征:早期呈现多发小斑片影及间质改变,以肺外带明显,进而发展为双肺多发磨玻璃影、浸润影,严重者可出现肺实变,胸腔积液少见;③发病早期白细胞总数正常或降低,淋巴细胞计数减少.
2.确诊病例:疑似病例,具备以下病原学证据之一者:①实时荧光RT-PCR检测新型冠状病毒核酸阳性;②病毒基因测序,与已知的新型冠状病毒高度同源.
1.2.2 临床分型标准
临床分型标准根据中华人民共和国国家卫生健康委员会发布的《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》[5]:
(1)轻型:临床症状轻微,影像学未见肺炎表现.
(2)普通型:具有发热、呼吸道等症状,影像学可见病毒性肺炎表现.
(3)重型:符合以下任何一条.①呼吸窘迫:呼吸频率(respiratory rate,RR)≥30次/min;②静息状态下,指氧饱和度≤93%;③动脉血氧分压(arterial partial pressure of oxygen,PaO2,P)与吸入氧浓度(fraction of inspiration O2,FiO2,F)之比P/F≤300 mmHg(1 mmHg=0.133 kPa).
(4)危重型:符合以下情况之一者.①出现呼吸衰竭,且需建立人工气道,进行有创机械通气;②出现休克;③合并其他器官功能衰竭需ICU 监护治疗.
1.3 分组
本研究中轻型与普通型合并为普通型组,故根据临床分型将患者分为普通型组、重型组和危重型组.根据目前预后情况,对危重型组进一步亚组分析,分为死亡组和生存组.
1.4 收集临床数据
收集的临床信息包括性别、年龄、初始症状、合并的基础疾病、流行病学史、并发症、临床生化指标、影像学检查等,临床生化指标包括白细胞介素6(Interleukin-6,IL-6)、病毒载量Ct值、氧合指数、血白细胞计数、血中性粒细胞计数、血淋巴细胞计数、血小板计数、CD4+T淋巴细胞计数、CD8+T淋巴细胞计数、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C reactive protein,CRP)、降钙素原(procalcitonin,PCT)、D-二聚体、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、血肌酐、乳酸脱氢酶(lactate dehydrogenase,LDH),临床生化指标均采集于患者入院48 h内,均收集入院后第一次结果.
危重型患者按病程分为入院时、转重型时、转危重型时、转危重型后1周、转危重型后2周、观察终点6个阶段进行数据收集,收集相应节点前后24 h内的血样本指标,其中观察终点以患者死亡/好转出院或最后一次指标为参考.
1.5 统计学方法
使用GraphPad 8.0统计软件,计数资料以百分比表示,3组间比较采用秩和检验,再进行两两比较;正态分布计量资料采用(均数±标准差)表示,非正态分布计量资料采用中位数表示,3组间比较采用Kruskal-Wallis检验,进一步采用Bonferroni法进行两两比较;Spearman等级相关系数用于进行两组连续变量之间的线性相关分析,用多因素Logistic回归分析COVID-19危重型转化的危险因素.P<0.05时具有统计学差异.
2 结果
2.1 COVID-19患者一般情况
本研究共纳入152名明确诊断为COVID-19的患者,其中危重型组17例,重型组31例,普通型组104例;男性79例,占比51.9%.其中,危重型组男性12例,占比70.6%;重型组男性22例,占比70.9%;普通型组男性45例,占比43.2%;危重型组、重型组患者男性比例高于普通型组患者,具有统计学差异(P<0.05).平均年龄51.89岁,其中危重型组患者平均年龄63.53岁,重型组患者平均年龄59.55岁,普通型组患者平均年龄47.71岁,危重型组、重型组患者平均年龄均高于普通型患者,具有统计学差异(P<0.05).与普通型组比较,危重型组患者合并高血压、糖尿病比例较高,具有统计学差异(P<0.05).与普通型组患者比较,危重型组患者氧合指数、病毒载量Ct值较低,具有统计学差异(P<0.05),D-二聚体、AST、LDH、ESR较高,具有统计学差异(P<0.05).与重型组患者比较,危重型组患者D-二聚体、LDH较高,具有统计学差异(P<0.05)(表1、2).
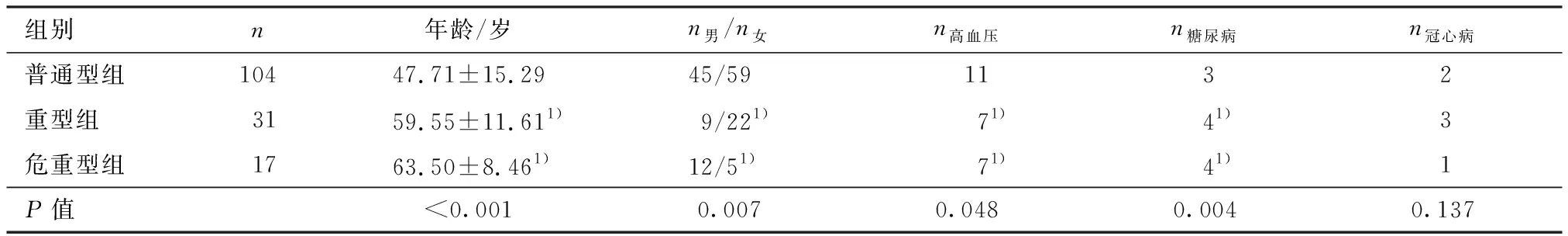
表1 危重型组、重型组、普通型组3组间一般资料比较Table 1 Comparison of general data among three groups of critical, severe and general

表2 危重型组、重型组、普通型组3组间临床生化指标比较Table 2 Comparison of clinical biochemical indexes among three groups of critical, severe and general
2.2 COVID-19患者外周免疫和炎症指标分析
收集患者入院时免疫和炎症指标分析,与普通型组患者比较,危重型组患者淋巴细胞计数、CD4+T淋巴细胞计数、CD8+T淋巴细胞计数较低,具有统计学差异(P<0.05),白细胞计数、中性粒细胞计数、CRP、IL-6较高,具有统计学差异(P<0.05).与重型组患者比较,危重型组患者IL-6较高,具有统计学差异(P<0.05).与普通型组比较,危重型组、重型组CD4/CD8比值较高,但进一步两两比较无统计学差异(表3).
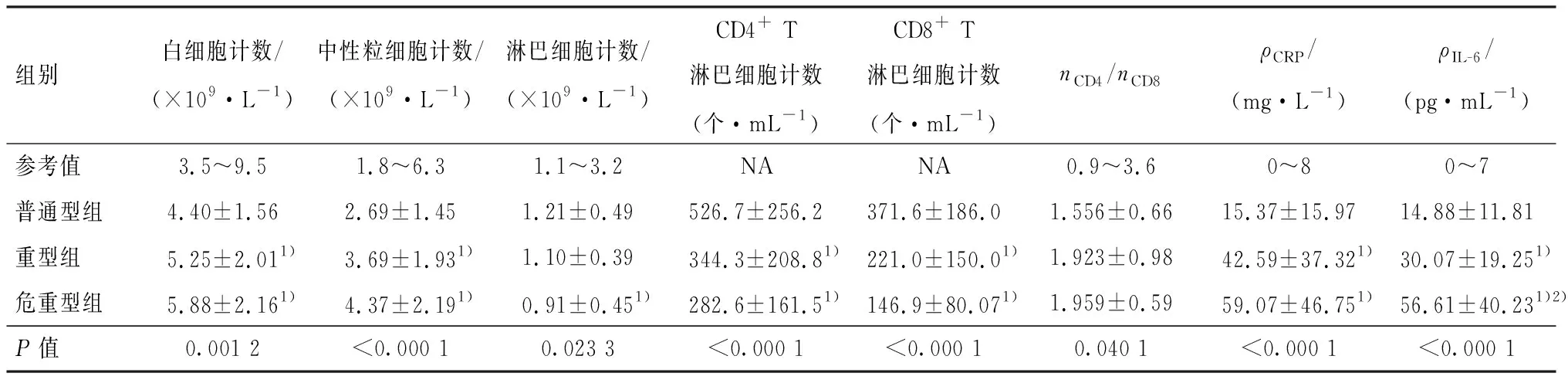
表3 危重型组、重型组、普通型组3组间免疫和炎症指标比较Table 3 Comparison of immune and inflammation indexes among three groups of critical, severe and general
2.3 COVID-19患者多因素Logistic回归分析
多因素Logistic回归分析显示CD4+T淋巴细胞计数减少(OR=-0.011;95%CI为0.979~0.999;P=0.031),IL-6升高(OR=0.069;95%CI为1.010~1.136;P=0.022)是危重型COVID-19的独立危险因素(表4).

表4 与危重型 COVID-19相关的危险因素的多因素回归分析Table 4 Multivariate regression analysis of risk factors related to critical COVID-19
2.4 COVID-19患者外周免疫和炎症指标相关性分析
使用Spearman相关系数来进行相关性研究,发现病毒滴度Ct值与淋巴细胞计数成正相关,与CD4+T淋巴细胞计数、CD8+T淋巴细胞计数、白细胞计数、中性粒细胞计数、CRP、IL-6等无相关性;IL-6与淋巴细胞计数成负相关;IL-6与中性粒细胞计数、CRP成正相关(图1).
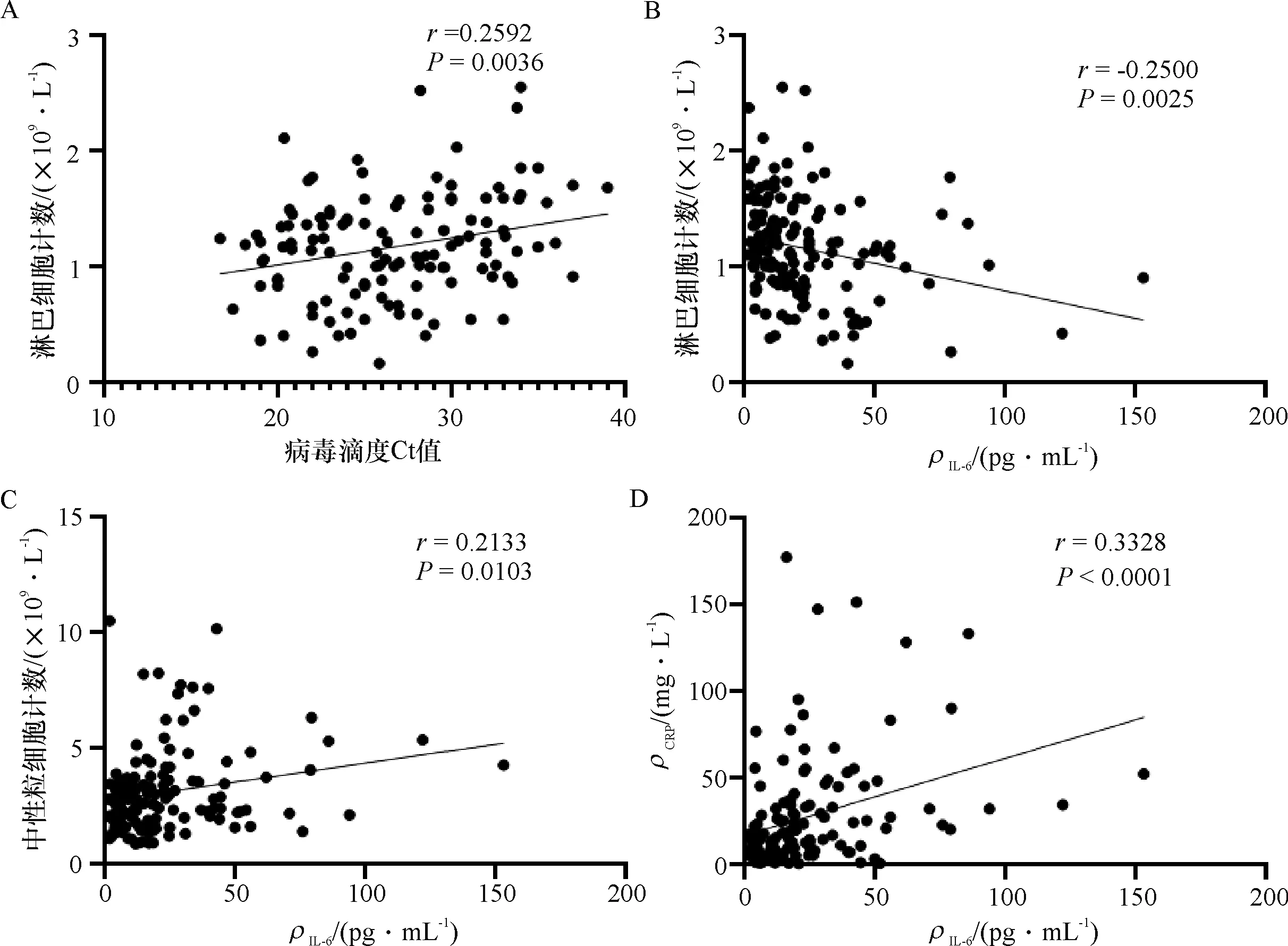
A:病毒滴度Ct值与淋巴细胞计数相关性分析;B:IL-6与淋巴细胞计数相关性分析;C:IL-6与中性粒细胞计数相关性分析;D:IL-6与CRP相关性分析.
2.5 生存组与死亡组外周免疫与炎症指标变化趋势
危重型组亚组分析,死亡组病程中淋巴细胞计数、CD4+T淋巴细胞计数、CD8+T淋巴细胞计数持续偏低,生存组淋巴细胞计数、CD4+T淋巴细胞计数、CD8+T淋巴细胞计数逐步恢复,死亡组病程后期白细胞计数、中性粒细胞计数升高.死亡组病程中IL-6、CRP的质量浓度逐步升高,其中两例患者观察终点时IL-6的质量浓度高于检测极限,生存组IL-6、CRP的质量浓度随着病情好转逐步下降(图2).
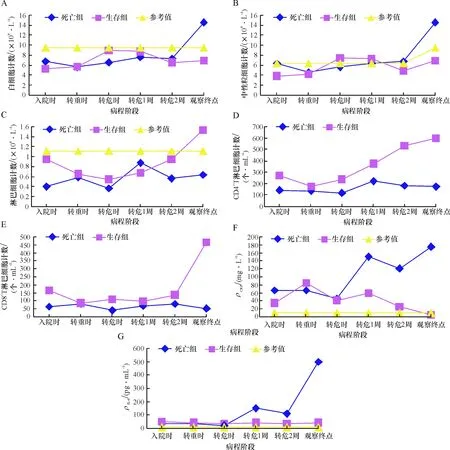
A:死亡组与生存组不同时间节点白细胞计数变化趋势;B:死亡组与生存组不同时间节点中性粒细胞计数变化趋势;C:死亡组与生存组不同时间节点淋巴细胞计数变化趋势;D:死亡组与生存组不同时间节点CD4+T淋巴细胞计数变化趋势;E:死亡组与生存组不同时间节点CD8+T淋巴细胞计数变化趋势;F:死亡组与生存组不同时间节点CRP变化趋势;G:死亡组与生存组不同时间节点IL-6变化趋势.
3 讨论
早期研究发现,大多数COVID-19患者淋巴细胞绝对值降低[6-7].本研究中大部分COVID-19患者淋巴细胞计数降低,且在危重型组患者中计数降低更加明显,危重型组患者中CD4+T淋巴细胞计数、CD8+T淋巴细胞计数均明显降低.进一步对危重型组患者进行亚组分析,死亡组患者淋巴细胞计数、CD4+T淋巴细胞计数、CD8+T淋巴细胞计数持续偏低,而生存组患者淋巴细胞计数、CD4+T淋巴细胞计数、CD8+T淋巴细胞计数降低,在转危阶段达到最低谷,其后随着病情的好转,淋巴细胞计数、CD4+T淋巴细胞计数、CD8+T淋巴细胞计数逐步恢复,且相关性分析提示淋巴细胞计数与病毒载量Ct值成正相关,病毒载量Ct值越低,病毒复制情况越严重,淋巴细胞计数越低.Qin等[8]研究亦发现COVID-19患者中T淋巴细胞计数减少,尤其是CD4+T淋巴细胞计数的减少在危重症患者中更为常见,但CD8+T淋巴细胞和B细胞的数量却无明显变化.本研究中,CD4+T淋巴细胞、CD8+T淋巴细胞在危重型患者中均有明显减少,SARS-CoV-2可能与SARS-CoV一样,能作用于淋巴细胞,尤其是T淋巴细胞,导致CD4+T淋巴细胞、CD8+T淋巴细胞均减少.病毒颗粒通过呼吸道黏膜传播并感染其他细胞,产生一系列免疫反应, 淋巴细胞总数的大幅减少表明SARS-CoV-2消耗了许多免疫细胞并抑制了人体的细胞免疫功能.T淋巴细胞的损伤可能是导致患者病情恶化的重要因素[9].
首例COVID-19患者的病理解剖结果发现,外周血淋巴细胞减少,但同时淋巴细胞也被过度激活,尤其是CD4+T细胞中具有高度促炎效应的CCR4+CCR6+Th17细胞数量增加,CD8+T细胞中高细胞毒性的T细胞过度活化[10].Th17 细胞是近些年发现的 T 细胞亚群,能够分泌大量的IL-17从而起到致炎作用.原始 T 淋巴细胞在IL-6及其他因子刺激下,由非受体酪氨酸激酶介导,激活 STAT3 信号通路,通过表达维甲酸相关核孤儿受体γt使 Th0 分化平衡朝 Th17 转化[11]. 本研究中COVID-19患者促炎性细胞因子IL-6升高,在危重型患者中升高更加明显,亚组分析显示死亡组患者病程中IL-6持续升高,病程后期IL-6 异常升高,其中2例患者IL-6在观察终点高于检测极限.SARS-CoV感染可诱导促炎性细胞因子TNF-α和IL-6的上调以及炎性趋化因子CCL3、CCL5、CCL2和CXCL10的上调[12],SARS-CoV-2可能与SARS-CoV一样.上调的IL-6等促炎性细胞因子刺激原始T淋巴细胞分化为具有高度促炎效应的Th17细胞,Th17细胞增加导致细胞因子的过度分泌,形成级联瀑布效应.由于炎症反应,肺部病变部位的血管通透性增大,导致病变部位的病原体更容易进入血管,同时加速血管中液体的外渗,从而破坏组织.肺组织中炎症反应失控,过度免疫反应使大量的免疫细胞在肺中激活、募集,这种异常升高的细胞因子与过度激活的免疫细胞,造成肺毛细血管内皮细胞以及肺泡上皮细胞弥漫性损伤,大量渗出液聚集而使气道阻塞,最终导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的发生[13].同时,严重的肺损伤、机体免疫功能的损害以及细胞因子在循环系统中导致的全身细胞因子风暴会进一步引起全身脏器的功能障碍,这很可能是导致COVID-19患者病情突然加重,甚至死亡的重要原因之一[14].因此,危重型病例的早期发现和及时治疗至关重要,对炎症因子持续升高、有ARDS倾向的患者,可尝试尽早使用糖皮质激素;而淋巴细胞减少,免疫功能受损,可尝试使用免疫球蛋白来增强重症患者的抗感染能力[6].开展细胞因子等指标动态监测,可能有助于早期发现是否出现细胞因子风暴,判断是否需要连续肾脏替代治疗(continuous renal replacement therapy,CRRT)、人工肝血液净化等治疗[15].目前COVID-19抗病毒治疗和中医治疗是主要治疗手段[16],针对Th17细胞激活的IL-17抑制剂苏金单抗[10]和直接靶向抗 IL-6 的药物托珠单抗、司妥单抗等对COVID-19患者可能有作用[17-18].
研究显示,淋巴细胞减少和T淋巴细胞亚群的持续消耗是SARS进行性发展的表现之一,长时间或更低水平的CD4+T淋巴细胞、CD8+T淋巴细胞与疾病加重甚至死亡呈正相关,低CD4+T淋巴细胞、CD8+T淋巴细胞被建议作为SARS严重程度的标志[19-20].本研究多因素Logistic回归分析显示,CD4+T淋巴细胞计数减少、IL-6升高是COVID-19患者危重型转化的独立危险因素.凌云等[21]亦发现,COVID-19重症患者的细胞免疫功能显著被抑制,进一步的Logistic回归分析显示,低CD8+T淋巴细胞水平是COVID-19进展为重症的独立危险因素.提示T细胞亚群可作为COVID-19轻症向重症转化的预测因子.因T细胞亚群的动态变化可提示病情轻重转化,建议临床医生在诊治过程中结合T细胞亚群,对患者进行危险分级,预判疾病程度,以便在病情恶化的早期实施有效干预,逆转重症发展,降低病死率.
本研究存在一定的局限性,首先,这是一项对入院患者的回顾性、小样本研究;其次,本研究只检测了T淋巴细胞,未检测体液免疫、NK细胞等,细胞因子方面只检测了IL-6,未检测其他细胞因子及趋化因子;第三,合并细菌感染的COVID-19患者的免疫反应结果可能会受影响.
尽管如此,本研究提示了一些有关COVID-19患者免疫反应的新信息,即SARS-CoV-2可能主要作用于淋巴细胞引起细胞免疫反应,尤其是T淋巴细胞,并产生一系列免疫应答.IL-6可能在诱发机体细胞因子风暴方面有介导和促进作用.因此对淋巴细胞、T细胞亚群、IL-6等进行动态监测有助于及早识别危重倾向患者,及早治疗.

