黄芪当归主要活性成分配伍对人脐静脉内皮细胞氧化损伤的保护作用研究
谭媖子,刘彩霞,朱秋燕,邓常清
近年来,心血管疾病发病率及死亡率逐年升高[1],且已成为威胁国民健康的头号杀手[2]。血管内皮细胞(vascular endothelial cells,VEC)损伤是多种心血管疾病的起始及关键环节,正常状态下VEC具有心血管系统屏障功能,且能合成并分泌多种生物活性物质,具有抗血栓、调节血管舒缩活动并抑制细胞迁移与趋化等功能[3],在调节心血管系统稳态方面发挥了重要的作用[4]。因此,保护VEC免受各种理化因素的损伤,修复与改善VEC功能对心血管疾病防治具有重要的临床意义。有研究发现,氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是引起VEC形态和功能损伤的重要因子[5],ox-LDL具有强烈的细胞毒性,通过氧化应激直接损伤VEC形态,增加内皮细胞间隙,改变血管通透性;ox-LDL还通过抑制一氧化氮(NO)及其合成酶表达,增加活性氧产生,引起VEC功能障碍[6-7]。因此,改善氧化应激引起的VEC形态损伤及功能紊乱对治疗心血管疾病具有重要意义。
黄芪和当归配伍具有益气补血活血的功效,有研究发现,黄芪、当归配伍不仅可促进造血,而且对心血管具有保护作用,如黄芪、当归配伍可促进内皮细胞增殖、抗氧化、抑制细胞凋亡等[8-9]。本课题组前期研究表明,黄芪和当归配伍可抑制血管内膜增生,改善局部血管炎性反应,减轻细胞外基质在血管壁沉积,抑制血管平滑肌细胞表型转化和增殖[10-11]。由于VEC损伤是血管内膜增生的起始环节,推测黄芪、当归配伍对VEC氧化损伤可能具有保护作用。药物成分“敲出/敲入”是借鉴“基因诊断治疗”以“谱-效”及“量-效”关系为切入点,采用中药目标成分“敲出/敲入”研究模式。该研究模式以中药整体为出发点,始终关联药效,注重中药多组分的整合作用,可快速、准确地辨识关键的药效物质[12]。因此,本研究采用VEC氧化损伤模型,观察黄芪、当归主要活性成分黄芪甲苷、黄芪皂苷-Ⅰ、毛蕊异黄酮、毛蕊异黄酮苷、阿魏及芒柄花素配伍抗VEC氧化损伤的作用,运用药物成分“敲出/敲入”中药组分辨识模式,分析其主要药效成分,明确主要活性成分对VEC氧化损伤的作用,为黄芪-当归配伍用于VEC的保护治疗提供实验依据。
1 材料与方法
1.1 实验细胞 实验细胞株为人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),购自上海中侨新舟生物科技公司(批号:19195),鉴定含有因子Ⅷ相关抗原(ⅧR:Ag)表达阳性,符合VEC生物学特征。
1.2 实验试剂 当归主要活性成分:阿魏酸(ferulic acid,纯度>99%,批号:A0050);黄芪主要活性成分:黄芪甲苷(astragaloside Ⅳ,纯度>98.5%,批号:A0070)、黄芪皂苷-Ⅰ(astragalosideⅠ,纯度>98.2%,批号:A0071)、芒柄花素(formononetin,纯度>98.5%,批号:A0232)、毛蕊异黄酮(calycosin,纯度>98.5%,批号:A0514)、毛蕊异黄酮苷(calycosin glycoside,纯度>98.5%,批号:A0515)。上述各活性成分均购自成都曼思特生物有限公司。ox-LDL(广州奕源生物有限公司,批号:YB002);DMEM培养液(Hyclone,批号:SH30022.01),胎牛血清(BI公司,批号:1923003),青霉素-链霉素溶液(碧云天生物技术公司,批号:SV30010),二甲基亚砜(DMSO,Sigama,批号:D2650-5X5ML),磷酸缓冲溶盐液(PBS,hyclone,批号:SH30256.01),CCK-8试剂盒(日本同仁药业株式会社,批号:CK04-500T),乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(碧云天生物技术公司,批号:C0016),胰酶消化液(Gibco,批号:25200056),碘化丙啶(PI,大连美仑生物科技公司,批号:MB2920),Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物科技公司,批号:KGA108),总NO试剂盒(碧云天生物技术公司,批号:S0023),一氧化氮合酶(nitric oxide synthase,NOS)检测试剂盒(碧云天生物技术技术公司,批号:A014)。
1.3 主要实验仪器 CO2培养箱(CCL-17OB-8,新加坡ESCD),酶标仪(ELX-800,Bio-Tex),流式细胞分析仪(A00-1-1102,Beckman)。
1.4 实验方法
1.4.1 主要活性成分试剂的制备 黄芪甲苷、黄芪皂苷-Ⅰ、毛蕊异黄酮、毛蕊异黄酮苷、阿魏酸、芒柄花素以DMSO-DMEM溶解,制备成储存液,使用时以无血清的DMEM培养液稀释,药液中DMSO终体积分数≤0.1%。
1.4.2 内皮细胞培养及分组 将HUVECs用含10%胎牛血清的DMEM制成细胞悬液,置于37 ℃无菌CO2培养箱中培养,每2~3 d换液1次,每周传代2次,传代第4代后用于实验。
1.4.3 设计实验方案 根据课题组前期研究[10-11],本研究以黄芪甲苷20 μg/mL、黄芪皂苷-Ⅰ 7.5 μg/mL、芒柄花素12.5 μg/mL、毛蕊异黄酮10 μg/mL、毛蕊异黄酮苷12.5 μg/mL、阿魏酸18 μg/mL为中点剂量,每个活性成分均设计6个剂量水平,药物剂量以50%递增或递减。详见表1。
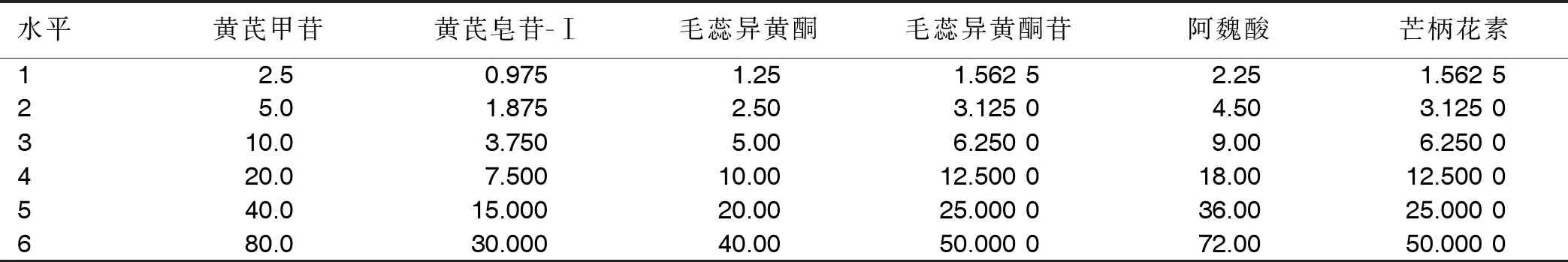
表1 药物活性成分剂量水平 单位:μg/mL
采用U6*(66)均匀设计,根据表1设定的6个剂量水平,得到6种活性成分6个不同的配伍实验组,详见表2。另外设正常组、模型组,共8组。将传代的HUVECs细胞以适当密度接种于96孔板中,每组5个复孔,应用无血清培养基同步培养使细胞处于G0期。将细胞分组加入不同药物成分培养2 h,再加入终浓度为200 μg/ mL ox-LDL培养24 h[13]。以CCK-8法采用酶标仪检测波长450 nm吸光度(A)反映细胞活力,确定各活性成分的配伍浓度。细胞存活率=(药物处理组A值-空白组A值)/(正常组A值-空白组A值)×100%。

表2 药物活性成分均匀设计方案 单位:μg/mL
1.4.4 主要活性成分及其配伍抗VEC损伤实验 在上述均匀设计实验确定6种活性成分配伍基础上,对6种活性成分及其配伍抗VEC损伤的作用进行研究。取指数生长期的HUVECs以适当密度接种于96孔板中,用无血清培养基将细胞同步于G0期。按表3方案分别加入不同药物进行处理,处理完成后进行检测。

表3 主要活性成分配伍实验方案
1.4.5 观察指标
1.4.5.1 LDH漏出率 细胞处理完成后,分别吸取培养液,以1 000 r/min离心10 min后取培养上清液,同时将离心管中的残余细胞和培养板中的细胞加入等量培养液,分别置于-20 ℃、37 ℃反复冻融3次,再将冻融液以1 000 r/min离心10 min,取上清液作为细胞冻融液。采用比色法分别测定培养上清液和细胞冻融液LDH含量。按以下公式计算LDH漏出率:LDH漏出率(%)=培养上清液中LDH含量/(细胞冻融液中LDH含量+培养上清液中LDH含量)×100%。
1.4.5.2 培养液NO含量 细胞处理完成后,分别吸取培养液,以1 000 r/min离心10 min后取上清液。按比色法测定上清液NO含量,操作按说明书进行。
1.4.5.3 培养液NOS活性 细胞处理完成后,分别吸取培养液,以1 000 r/min离心10 min后取上清液。按比色法测定培养上清液总NOS活性,操作按说明书进行。
1.4.5.4 细胞周期测定 取对数生长期HUVECs,以每孔1×106个/mL铺于6孔板,每组3个复孔,按上述处理后,取细胞以1 000 r/min离心5 min,去上清液,加入预冷的1 mL PBS洗涤2次,70%冰乙醇固定细胞过夜后,PBS重悬,离心去乙醇,收集细胞。加入10 μg/mL碘化丙啶工作液,4 ℃避光孵育30 min。应用流式细胞仪上机检测,分析细胞周期各时象分布,并计算分裂增殖指数(proliferation index,PI),PI=[(S+G2/M)/(G0/G1+S+G2/M)]×100%。
1.4.5.5 细胞凋亡测定 HUVECs经前述处理后,消化、离心、收集细胞。采用PBS重悬细胞并洗涤2次,将细胞数调整至5×105个/mL,每组3个复孔,加入Annexin V-FITC 10 μL和碘化丙啶工作液10 μL,轻轻混匀,4 ℃避光孵育30 min后每管加入 Binging Buffer 300 μL,1 h 内应用流式细胞仪检测细胞凋亡率。
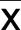
2 结 果
2.1 均匀设计实验分析 与模型组比较,实验组中1组~3组均能提高细胞活力,差异均有统计学意义(P<0.05)。以细胞存活率进行多重线性回归分析,建立多重线性回归方程(设定回归方程中X1代表黄芪甲苷、X2代表黄芪皂苷-Ⅰ、X3代表毛蕊异黄酮、X4代表毛蕊异黄酮苷、X5代表阿魏酸、X6代表芒柄花素,Y代表细胞存活率)结果如下:Y=0.586581+0.006854X2-0.003407X6-0.000228X1*X5+0.000 044X4*X6。该回归方程经方差分析,差异有统计学意义(P=0.007 6),说明方程有意义,且拟合结果较好。由于要求细胞存活率(Y值)越高越好,故黄芪皂苷-Ⅰ、毛蕊异黄酮苷取实验应用范围最大值,黄芪甲苷、阿魏酸、毛蕊异黄酮、芒柄花素均取实验应用范围最小值,即黄芪皂苷-Ⅰ 30 μg/mL、毛蕊异黄酮苷50 μg/mL、黄芪甲苷2.5 μg/mL、阿魏酸2.25 μg/mL、毛蕊异黄酮1.25 μg/mL、芒柄花素1.562 5 μg/mL。
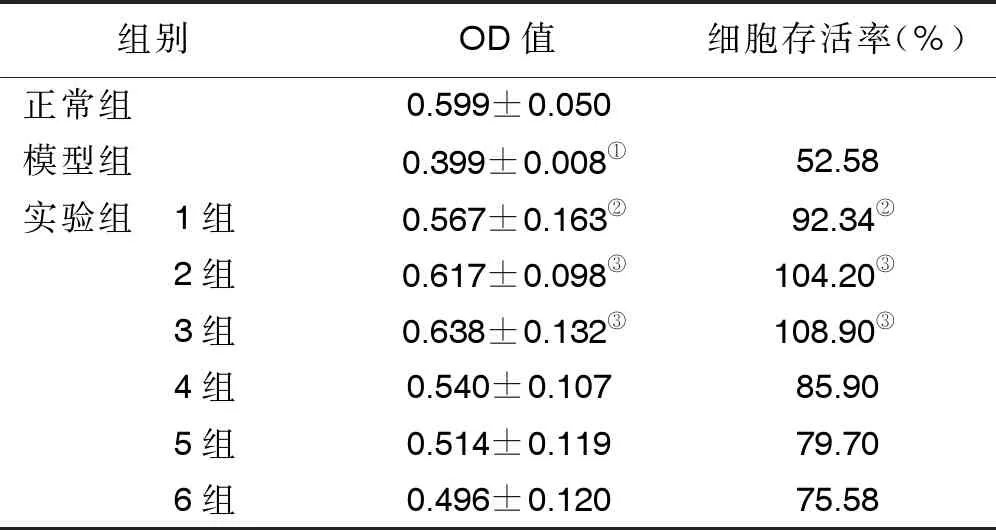
表4 均匀设计实验细胞活力比较(n=5)
2.2 黄芪、当归活性成分及其配伍对LDH漏出率的影响 与正常组比较,模型组LDH漏出率增加(P<0.01)。与模型组比较,各药物单用组、药物敲出组及6种成分配伍组LDH漏出率均降低(P<0.01)。黄芪甲苷单用组LDH漏出率低于黄芪甲苷敲出组(P<0.05),毛蕊异黄酮单用组LDH漏出率低于毛蕊异黄酮敲出组(P<0.05)。详见图1。
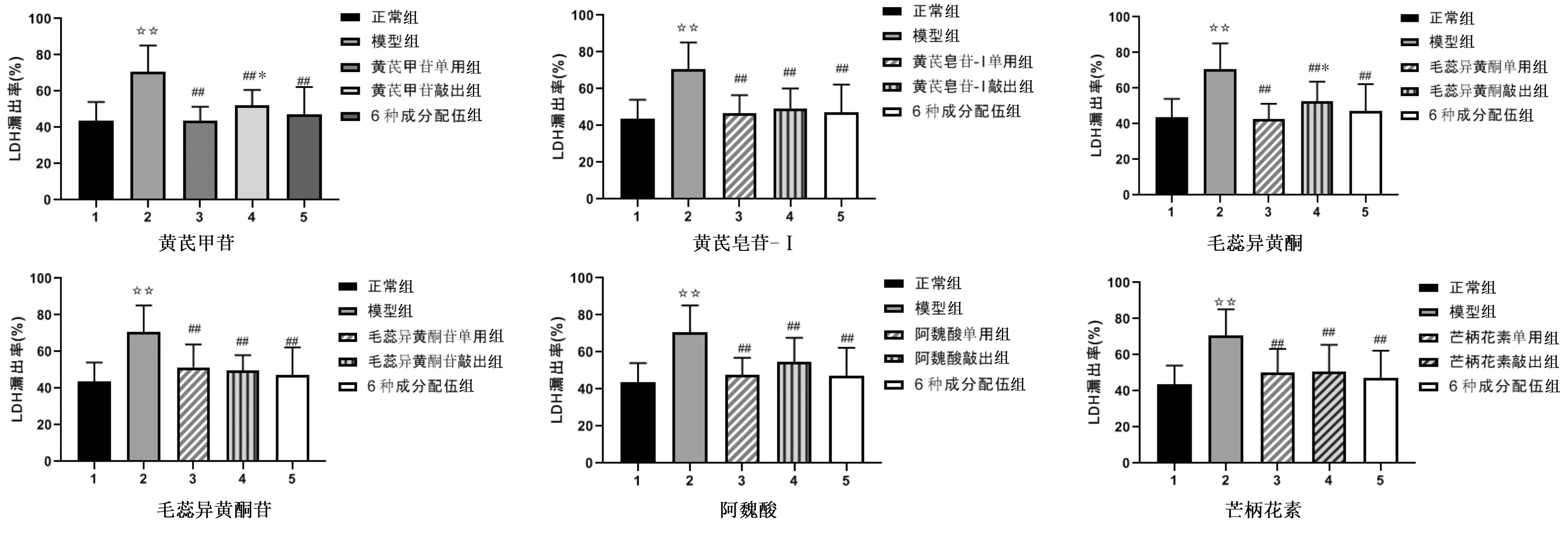
与正常组比较,☆☆P<0.01;与模型组比较,##P<0.01;与药物单用组比较,*P<0.05。图1 各药物成分及其配伍对LDH漏出率的影响(n=5)
2.3 黄芪、当归活性成分及其配伍对NO含量、NOS活力的影响 与正常组比较,模型组培养液NO含量和NOS活力均降低(P<0.01)。与模型组比较,各药物成分敲出组及6种成分配伍组培养液中NO含量升高(P<0.01),黄芪皂苷-Ⅰ单用组及毛蕊异黄酮苷单用组培养液中NO含量升高(P<0.05);其他各药物单用组、各药物成分敲出组及6种成分配伍组培养液中NOS活力升高(P<0.01)。黄芪皂苷-Ⅰ敲出组培养液中NO含量高于黄芪皂苷-Ⅰ单用组(P<0.05),黄芪甲苷敲出组、毛蕊异黄酮敲出组、阿魏酸敲出组、芒柄花素敲出组培养液中NO含量和NOS活力高于相应的单用组(P<0.01)。与6种成分配伍组比较,黄芪甲苷单用组、黄芪皂苷-Ⅰ单用及敲出组、毛蕊异黄酮单用及敲出组、毛蕊异黄酮苷单用及敲出组、阿魏酸单用及敲出组、芒柄花素单用及敲出组NO含量降低(P<0.01);各药物单用组及药物敲出组NOS活力显著降低(P<0.01)。详见图2、图3。

与正常组比较,☆☆P<0.01;与模型组比较,#P<0.05,##P<0.01;药物敲出组与药物单用组比较,*P<0.05,**P<0.01;单用药物组、药物敲出组与6种成分配伍组比较,△△P<0.01。图2 各药物成分及其配伍对NO含量的影响(n=5)
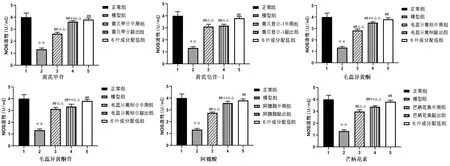
与正常组比较,☆☆P<0.01;与模型组比较,##P<0.01;药物敲出组与药物单用组比较,**P<0.01;单用药物组、药物敲出组与6种成分配伍组比较,△△P<0.01。图3 各药物成分及其配伍对NOS活性的影响(n=5)
2.4 黄芪、当归活性成分及其配伍对细胞增殖的影响 与正常组比较,模型组细胞PI均降低(P<0.01),细胞增殖活力下降。与模型组比较,黄芪甲苷组、黄芪皂苷-Ⅰ组、毛蕊异黄酮敲出组、毛蕊异黄酮苷敲出组、阿魏酸组、芒柄花素单用组及6种成分配伍组PI增加(P<0.05或P<0.01),细胞增殖能力增强。黄芪甲苷敲出组、黄芪皂苷-Ⅰ敲出组、毛蕊异黄酮苷敲出组、阿魏酸敲出组、芒柄花素敲出组PI均强于相应的单用组(P<0.05或P<0.01)。与6种成分配伍组比较,黄芪皂苷-Ⅰ单用组、毛蕊异黄酮单用组、毛蕊异黄酮苷单用组、阿魏酸组、芒柄花素敲出组PI降低(P<0.05或P<0.01)。详见图4。

与正常组比较,☆☆P<0.01;与模型组比较,#P<0.05,##P<0.01;药物敲出组与药物单用组比较,*P<0.05,**P<0.01;单用药物组、药物敲出组与6种成分配伍组比较,△P<0.05,△△P<0.01。图4 各成分及其配伍对细胞增殖的影响(n=3)
2.5 黄芪、当归活性成分及其配伍对细胞凋亡率的影响 与正常组比较,模型组正常细胞数减少,凋亡细胞增加,细胞凋亡率显著增加(P<0.01)。与模型组比较,黄芪甲苷敲出组、黄芪皂苷-Ⅰ组、毛蕊异黄酮组、毛蕊异黄酮苷组、阿魏酸敲出组、芒柄花素组及6种成分配伍组凋亡细胞均减少,细胞凋亡率降低(P<0.01)。与各药物单用组比较,黄芪甲苷敲出组、黄芪皂苷-Ⅰ敲出组、毛蕊异黄酮敲出组、阿魏酸敲出组、芒柄花素敲出组细胞凋亡率显著降低(P<0.01)。与6种成分配伍组比较,黄芪甲苷单用组、黄芪皂苷-Ⅰ组、毛蕊异黄酮组、毛蕊异黄酮苷组、阿魏酸组及芒柄花素组细胞调亡率升高(P<0.01)。详见图5、图6。

图5 各组细胞凋亡流式检测图(Q1-LL为正常细胞;Q1-UR为早期凋亡细胞;Q1-LR为晚期凋亡细胞;Q1-UL为坏死细胞)

与正常组比较,☆☆P<0.01;与模型组比较,##P<0.01;药物敲出组与药物单用组比较,**P<0.01;单用药物组、药物敲出组与6种成分配伍组比较,△△P<0.01。 图6 各药物成分及其配伍对细胞凋亡率的影响(n=3)
3 讨 论
ox-LDL是低密度脂蛋白(low density lipoprotein,LDL)氧化修饰而来,携带大量氧自由基。有研究发现,高浓度ox-LDL在血管内皮堆积,一方面诱导内皮细胞产生大量活性氧,从而抑制NO及相关合成酶表达,引起炎症反应及氧化应激反应,导致内皮细胞功能障碍[6]。另一方面,ox-LDL通过上调血凝集素样氧化型低密度脂蛋白受体-1(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1)、Caspase等促凋亡分子和下调Bcl-2等抑制凋亡分子表达,促进细胞凋亡、抑制细胞增殖[14]。本研究结果发现,ox-LDL干预细胞24 h后,可增加细胞LDH漏出率,抑制细胞增殖,促进细胞凋亡,降低细胞NOS活性,使NO合成减少。结果表明,ox-LDL通过诱导炎症反应发生,增强氧化应激,损伤血管内皮细胞形态和功能。
近年来,抗VEC氧化损伤成为心血管疾病防治的研究热点,中药以多靶点、多环节对抗VEC氧化损伤,改善VEC功能,符合防治心血管疾病的需求。黄芪当归是心血管疾病临床治疗常用药对,二者配伍应用最有名的是李东垣创立的黄芪、当归配比5︰1的当归补血汤。相关研究发现,当归补血汤具有促进血管新生、抗氧化等作用[14-16]。杨鹏等[17]研究发现,当归补血汤通过调控血管内皮生长因子(VEGF)与其受体(VEGFR)结合,促进缺氧VEC增殖。提示黄芪当归配伍通过多靶点改善VEC氧化损伤,发挥保护心血管作用。
实验研究表明,当归补血汤含量最多的是来自黄芪的皂苷类成分(黄芪皂苷-Ⅰ、 黄芪甲苷-Ⅳ等)和黄芪酮类成分(毛蕊异黄酮、芒柄花素等)及来自当归的有机酸(阿魏酸等)[18]。采用Caco-2细胞研究发现,当归主要成分阿魏酸,可提高黄芪中化学成分黄芪甲苷、毛蕊异黄酮和芒柄花素在单层Caco-2细胞的渗透性,促进药物成分吸收[19]。当归挥发油中的主要化学成分蒿本内酯是一种可抑制当归补血汤生物效应的负性调节物质[20]。中药主要通过口服,肠道吸收,其药效物质是在体内吸收的活性成分。唐蓉等[21]经大鼠肠囊翻转实验发现,黄芪和当归配伍后,在小肠吸收的主要成分是阿魏酸、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花素、黄芪甲苷5种活性成分。因此,本研究选择黄芪甲苷、黄芪皂苷-Ⅰ、毛蕊异黄酮、毛蕊异黄酮苷、芒柄花素及阿魏酸作为黄芪当归配伍的主要药效成分进行研究。
LDH是所有细胞组织均存在的活性成分,细胞损伤时,细胞内LDH漏出到细胞外液中,导致细胞外液LDH含量增加,因此,LDH漏出率增加是细胞受损的表现。本研究结果发现,黄芪、当归6种主要活性成分及其配伍均可降低LDH漏出率,减少细胞损伤,且黄芪甲苷和毛蕊异黄酮敲出的LDH漏出率降低,提示6种成分均可抑制内皮细胞损伤,其中以黄芪甲苷、毛蕊异黄酮作用较强。NO是VEC合成的血管舒张因子,NO合成和释放障碍是内皮功能受损的标志之一[22]。NO的合成与NOS活性有关,本研究结果发现,ox-LDL可抑制内皮细胞NOS活性,减少NO合成,诱导内皮功能障碍[23]。黄芪、当归6种主要活性成分及其配伍均能增强NOS活性,且黄芪皂苷-Ⅰ单用可增加NO含量,提示6种成分可增加NOS活性,且黄芪皂苷-Ⅰ可增加NO合成,6种成分对ox-LDL导致的内皮细胞功能障碍具有保护作用,6种成分配伍作用显著增强。细胞增殖实验分析表明,黄芪甲苷和芒柄花素可促进细胞增殖,而黄芪皂苷-Ⅰ、阿魏酸可抑制细胞增殖,表明黄芪甲苷和芒柄花素可能是促进细胞增殖的有效物质,而黄芪皂苷-Ⅰ、阿魏酸对细胞增殖具有负向调控作用。细胞凋亡分析表明,黄芪皂苷-Ⅰ、毛蕊异黄酮、毛蕊异黄酮苷、阿魏酸、芒柄花素均可不同程度地降低细胞凋亡率和细胞凋亡,6种活性成分配伍抗细胞凋亡的作用增强。提示这些活性成分是抑制细胞损伤的主要药效物质,这些活性成分配伍可增强抗VEC氧化损伤作用,促进VEC功能和形态的修复。
综上所述,黄芪、当归活性成分及其配伍对ox-LDL诱导的HUVECs损伤具有保护作用,其机制可能与抑制细胞氧化损伤、抑制细胞凋亡、促进细胞增殖和修复有关。VEC氧化损伤机制复杂,黄芪和当归的活性成分和作用形式多样,本研究仅从体外细胞实验进行了初步分析,对黄芪和当归活性成分的作用特点和作用机制尚未明确,今后将从多角度研究黄芪、当归活性成分配伍改善血管内皮细胞损伤作用,进一步探索其作用机制,为VEC保护的药效物质提供科学依据。

