黄芪甲苷抑制胰腺癌PANC1细胞恶性生物学行为及其作用机制
蔡秀珍 张曼 刘涛
1潍坊市中医院药学部,潍坊 261041;2潍坊市脑科医院药剂科,潍坊 261021
【提要】 采用CCK8检测胰腺癌PANC1细胞的存活率,划痕实验和Transwell小室检测细胞迁移和侵袭能力,蛋白质印迹法检测与细胞增殖、凋亡及上皮间质转化相关的蛋白表达等方法探讨黄芪甲苷对胰腺癌PANC1细胞恶性生物学行为的影响。结果显示,黄芪甲苷干预PANC1细胞后可抑制细胞的存活率,显著减少迁移和穿膜的细胞数量,影响相关蛋白的表达,提示黄芪甲苷抑制胰腺癌PANC1细胞生长的机制可能与其抑制细胞增殖、诱导细胞凋亡、抑制上皮间质转化过程有关。
黄芪甲苷是中药黄芪天然活性成分提取物之一,具有许多药理作用,如抑制炎症、抗氧化、降低血糖、调节脂肪及能量代谢、抗纤维化、调节免疫及抗肿瘤等[1-6]。早期研究发现,黄芪甲苷可以通过PKC-α-ERK1/2-NF-κB信号通路抑制肺癌细胞A549的迁移和侵袭[7]。然而黄芪甲苷是否对胰腺癌发挥同样的抗肿瘤作用尚不明确。本研究探讨黄芪甲苷对胰腺癌PANC1细胞的作用及其机制,为胰腺癌的治疗提供新的策略。
一、材料与方法
1.PANC1细胞增殖活性检测:胰腺癌PANC1细胞购自ATCC,常规复苏并传代。取对数生长期细胞,接种于96孔板,每孔3×105个细胞。培养过夜后将溶解于DMSO的终浓度为1、2.5、5、7.5 μg/ml的黄芪甲苷(成都科程生物科技开发公司)分别孵育细胞24、48、72、96 h,以单加DMSO作为对照组,每个实验组设置6个复孔。培养到相应时间点,避光每孔加入10 μl CCK8(武汉博士德生物公司),继续孵育2 h,上酶标仪检测每孔在450 nm处吸光度值(A450值)。筛选出合适的黄芪甲苷浓度进行后续实验。
2.PANC1细胞迁移能力检测:取对照组和黄芪甲苷组对数生长期PANC1细胞,分别以每孔3×105个细胞接种于6孔板,培养过夜后,用200 μl无菌枪头划痕,PBS轻轻冲洗后加入含合适浓度黄芪甲苷的培养液培养0、24 h,拍照计算迁移到痕迹空白处的细胞数。每组设置3个复孔,取均值。
3.PANC1细胞侵袭能力检测:取对照组和黄芪甲苷组对数生长期PANC1细胞,接种1×106细胞/100 μl于隔膜铺有基质胶的Transwell小室(美国BD公司)的上室,下室加500 μl培养液,培养孵育24 h后,取出小室隔膜,用棉签轻轻擦去隔膜上室面未穿膜细胞,将隔膜置于4%多聚甲醛固定,结晶紫染色,光镜下计算高倍镜下的穿膜细胞数。每组设置3个小室,取均值。
4.相关蛋白表达检测:收集对照组和黄芪甲苷组培养48 h的细胞,加入适量的细胞裂解液(美国赛默飞公司),冰上裂解30 min。离心取上清,应用BCA蛋白浓度测定试剂盒(Thermo公司)测定蛋白浓度。取30~40 μg蛋白,常规行蛋白质印迹法检测评估肿瘤细胞增殖能力的蛋白PCNA[8]、细胞凋亡的效应蛋白caspase3[9]、上皮细胞标志物E-cadherin及间质细胞标志物N-cadherin、vimentin表达,以GAPDH为内参。所有一抗均购于英国Abcam公司,按相应抗体说明书推荐比例稀释一抗。最后ECL发光,X片曝光、显影、定影。以目的条带与内参条带的灰度值比表示蛋白相对表达量。

二、结果
1.黄芪甲苷抑制胰腺癌PANC1细胞的存活:与对照组比较,1 μg/ml黄芪甲苷组存活细胞数量差异无统计学意义(P>0.05),2.5、5、7.5 μg/ml黄芪甲苷组的存活细胞数量呈剂量及时间依赖性地减少,差异均有统计学意义(P值均<0.05)。5 μg/ml与7.5 μg/ml黄芪甲苷组的存活细胞数量在不同时间点差异均无统计学意义(P值均>0.05),故选择5 μg/ml黄芪甲苷组细胞进行后续实验(图1)。
2.黄芪甲苷抑制胰腺癌PANC1细胞增殖并诱导其凋亡:与对照组比较,黄芪甲苷组PCNA蛋白表达显著下调(1.32±0.12比0.86±0.16,t=5.142,P=0.007,图2A),caspase3蛋白表达显著上调(0.45±0.17比0.87±0.15,t=4.142,P=0.004,图2B),表明黄芪甲苷组胰腺癌PANC1细胞存活数量减少可能是由于黄芪甲苷抑制细胞增殖并诱导细胞凋亡所引起。
3.黄芪甲苷抑制胰腺癌PANC1细胞的迁移和侵袭能力:划痕实验结果显示,黄芪甲苷组的迁移细胞数量较对照组显著减少(76.35±11.32比52.34±9.46,图3A~3B);穿膜细胞数量较对照组显著减少(135.24±12.45比54.69±25.39,图3C~3D),差异均有统计学意义(t值分别为3.623、6.369,P值分别为0.022、0.003),表明黄芪甲苷可抑制胰腺癌PANC1细胞的迁移和侵袭能力。
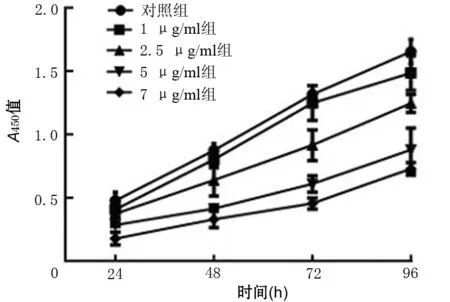
图1 不同浓度黄芪甲苷对胰腺癌PANC1细胞增殖的影响
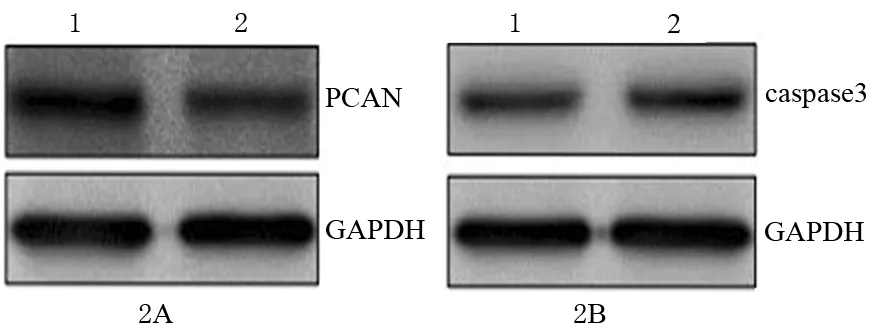
图2 对照组(1)、黄芪甲苷组(2)PANC1细胞PCNA(2A)和caspase3(2B)蛋白表达

图3 对照组、黄芪甲苷组的PANC1细胞迁移(3A~3B)和侵袭(3C~3D)能力
4.黄芪甲苷抑制胰腺癌PANC1细胞的上皮-间质转化过程:与对照组比较,黄芪甲苷组E-cadherin表达上调(0.35±0.09比0.96±0.15),N-cadherin(0.45±0.08比0.27±0.08)和vimentin(0.37±0.07比0.21±0.05)表达均下调(图4),差异均有统计学意义(t值分别为7.797、3.558、4.159,P值均<0.05),提示黄芪甲苷可能通过抑制上皮间质转化过程进而抑制胰腺癌PANC1的迁移和侵袭能力。
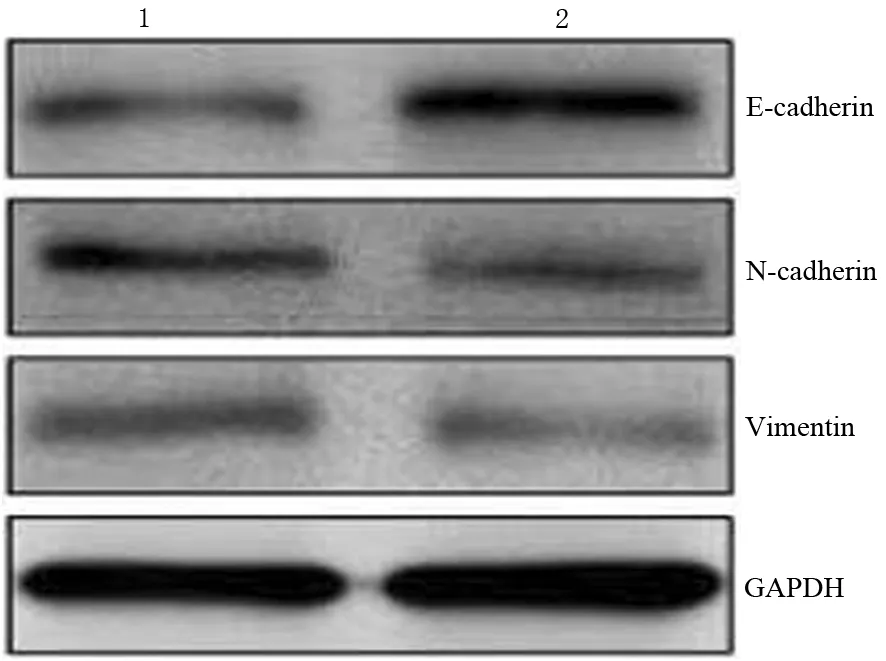
图4 对照组(1)、黄芪甲苷组(2)PANC1细胞的上皮-间质转化相关蛋白表达
讨论早期胰腺癌首选手术治疗,术后辅助进行化疗,以控制潜在的肿瘤细胞微转移[10-11]。有研究表明,5-氟尿嘧啶加亚叶酸或吉西他滨的辅助化疗可将胰腺癌患者5年生存率提高到16%~21%[12]。然而,肿瘤的早期复发、转移以及肿瘤耐药等问题仍是胰腺癌临床治疗亟待解决的难题。近年来,从中药中提取的单体在各种恶性肿瘤的治疗及辅助治疗的研究广泛开展。目前有研究表明黄芪甲苷通过抑制AKT信号通路增强阿帕替尼对胃癌AGS细胞的抗肿瘤作用[13],但黄芪甲苷对胰腺癌细胞的作用尚不清楚。
本研究应用黄芪甲苷处理胰腺癌PANC1细胞,结果显示,黄芪甲苷处理后呈剂量和时间依赖性抑制PANC1细胞存活率,同时下调细胞PCNA蛋白表达,上调caspase3蛋白表达,表明黄芪甲苷不仅可以抑制细胞增殖,且能够促进细胞凋亡的发生。此外,黄芪甲苷处理还能显著减少迁移和穿膜的细胞数量,表明黄芪甲苷能抑制PANC1细胞的迁移及侵袭能力。
为深入研究黄芪甲苷的作用机制,本研究检测了上皮-间质转化相关蛋白表达的变化。结果显示黄芪甲苷处理后PANC1细胞的E-cadherin表达上调,N-cadherin和vimentin表达均下调,提示黄芪甲苷可能通过抑制上皮-间质转化过程进而抑制胰腺癌PANC1细胞的迁移和侵袭能力。
综上所述,黄芪甲苷可显著抑制胰腺癌PANC1细胞恶性生物学行为,从而抑制胰腺癌的发生发展,有望成为治疗胰腺癌的新型药物靶点。
利益冲突所有作者均声明不存在利益冲突

