基于环介导等温扩增技术的产呕吐毒素蜡样芽胞杆菌特异性检测
徐晓可,郭卉,邓梅清,张菊梅,吴清平,丁郁,
(1.广东岭南职业技术学院健康管理学院,广东广州 510663)(2.暨南大学理工学院食品科学与工程系,广东广州 510632)(3.广东省微生物研究所省部共建华南应用微生物国家重点实验室,广东广州 510070)
蜡样芽胞杆菌(Bacillus cereus)是一种兼性需氧的革兰氏阳性菌,产芽胞,广泛分布于土壤、水、空气和各类生熟食品中[1]。食用了该菌污染的食品容易导致食物中毒,引起的食物中毒类型主要包括腹泻型中毒和呕吐型中毒,其中腹泻型中毒主要与某些菌株分泌肠毒素相关,而呕吐型中毒主要是由于某些菌株产生呕吐毒素引起[2-4]。
国内外均有报道蜡样芽胞杆菌引起的食物中毒事件。1950年在挪威发表了第一起蜡样芽胞杆菌食物中毒的报告,之后许多国家,尤其是欧洲一些国家相继报告了类似食物中毒的爆发。挪威和荷兰将蜡样芽胞杆菌认定为食品中最易检出的病原微生物[5]。我国在上世纪70年代报道蜡样芽胞杆菌中毒事件后,此类中毒事件的报道逐年增多。据2008~2015年我国国家食源性疾病监测网统计资料显示,微生物性食源性疾病占比39%,其中蜡样芽胞杆菌引起的中毒事件占17%,在细菌性病原体中排在第三[6],危害极为严重。呕吐型蜡样芽胞杆菌引发的食物中毒时有发生,约占蜡样芽胞杆菌食物中毒总数的 75.9%[7]。因此,建立一种快速、特异的方法检测食品中产呕吐毒素蜡样芽胞杆菌至关重要。
目前检测蜡样芽胞杆菌的方法是食品安全国家标准食品微生物学检验蜡样芽胞杆菌(GB 4789.14-2014),主要包括增菌、分离培养、镜检、生化鉴定、生化分型。对于分离的蜡样芽胞杆菌主要是采用PCR或荧光定量PCR的方法鉴定其是否是呕吐毒株(呕吐毒素合成酶基因存在与否)。环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是一种新兴的检测技术,它以其特异性强、等温灵敏、操作简单、产物易检测等优点在食品安全检测等领域得到了日益广泛的应用。在食源性致病菌方面,目前已经建立了副溶血性弧菌(Vibrio parahaemolyticus)、沙门氏菌(Salmonellaspp.)、克罗诺杆菌(Cronobacterspp.)和蜡样芽胞杆菌等致病菌的LAMP技术,但没有从蜡样芽胞杆菌中区分出产呕吐毒素蜡样芽胞杆菌的LAMP检测方法报道[8-11]。本研究旨在以产呕吐毒素蜡样芽胞杆菌基因cesB为靶基因,设计LAMP反应特异性引物,构建LAMP反应体系,建立一种产呕吐毒素蜡样芽胞杆菌的特异快速检测技术,为卫生检验和食品质量安全提供技术保障,不断提高我国食品安全与公共卫生控制水平。
1 材料与方法
1.1 菌株
本试验收集菌株62株,所有菌株均由广东省微生物研究所提供。
1.2 培养基和试剂
胰蛋白胨肉汤、LB肉汤等培养基:广东环凯微生物科技有限公司;BstDNA聚合酶:NEB公司;细菌基因组DNA提取试剂盒,2×PCR Mix:广州东盛生物科技有限公司;显色剂:广州迪奥生物科技有限公司;dNTPs,DNA Marker2000:生工生物工程(上海)股份有限公司;MgSO4和甜菜碱:Sigma公司。
1.3 主要仪器
低温高速离心机:SIGMA 3K30,德国sigma公司;酶标仪:EPOCH2,美国BioTek公司;PCR仪:Mini3220,杭州朗基科学仪器有限公司;电泳仪:DDR-6B,北京六一生物科技有限公司;凝胶成像系统:Tanon-4600SF,上海天能科技有限公司;移液枪:德国Eppendorf公司;生化培养箱:SPX-150B-Z,上海博迅实业有限公司医疗设备厂;恒温水浴锅:XMTD-8222,上海精宏实验设备有限公司。
1.4 方法
1.4.1 细菌培养
将菌株接种至在胰蛋白胨肉汤(TSB)培养,36±1 ℃培养 16~18 h。
1.4.2 DNA抽提
试剂盒法:按照试剂盒说明书提取细菌基因组DNA。
煮沸法:取1 mL菌液或样品增菌液于12000 r/min离心5 min,弃上清。加入200 μL无菌水洗涤1次后,用100 μL TE悬浮混匀,于100 ℃水浴10 min,冰浴3 min,12000 r/min离心5 min,取上清备用。
1.4.3 引物设计
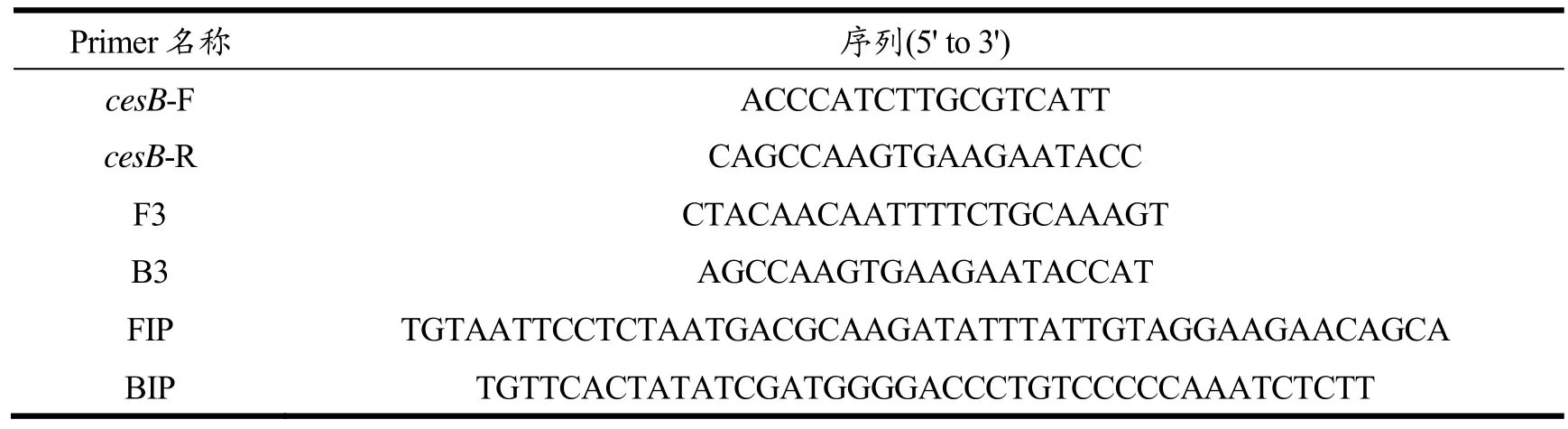
表1 本研究所用引物序列Table 1 The sequence of primers
(1)LAMP引物设计:以产呕吐毒素蜡样芽胞杆菌cesB为靶基因,设计LAMP引物,引物序列见表1,由上海生物工程公司合成。
(2)PCR引物:参考文献序列[12],由上海生物工程公司合成。
1.4.4 LAMP扩增
LAMP 反 应 体 系 25 μL, 包 括 2.5 μL 10×Thermopol反应缓冲液、1.6 mmol/L dNTPs、0.2 μmol/L上游外引物F3、0.2 μmol/L下游外引物B3、1.6 μmol/L上游内引物FIP、1.6 μmol/L下游内引物BIP、6 mmol/L MgSO4、1 mol/L甜菜碱、8 UBstDNA聚合酶、3 μL细菌DNA模板,加dd H2O至体积25 μL,加入显色剂在PCR管盖。扩增反应条件:63 ℃恒温水浴1 h,不用开盖,通过颜色直接观察结果。
1.4.5 PCR扩增
PCR反应体系和PCR扩增程序参考张志鸿等的报道[10]。用1×TAE电泳缓冲液配制2%琼脂糖凝胶,上样5 μL,100 V电压下30 min电泳,用凝胶成像系统观察电泳结果并进行分析。
1.4.6 LAMP特异性验证
将表2中所有菌株接种至TSB增菌液中37 ℃培养16~18 h后,取1 mL菌液用煮沸法提取DNA,然后进行LAMP扩增,验证LAMP反应体系的特异性。
1.4.7 LAMP灵敏度评价
1.4.7.1 基因组灵敏度
将产呕吐毒素蜡样芽胞杆菌F4810/72在TSB增菌液中37 ℃培养16~18 h后,取1 mL菌液,用DNA抽提试剂盒抽提DNA,用酶标仪测定DNA浓度。将上述DNA进行梯度稀释,进行LAMP扩增,评价该方法的DNA灵敏度。
1.4.7.2 纯菌灵敏度
将产呕吐毒素蜡样芽胞杆菌F4810/72在TSB增菌液中37 ℃培养16~18 h后,取1 mL菌液,进行梯度稀释,用DNA抽提试剂盒抽提不同稀释度的DNA,进行LAMP扩增,评价该方法的纯菌灵敏度。同时对含不同稀释度的菌液进行平板计数。
1.4.8 人工污染样品检测
称取经国标方法检验不含蜡样芽胞杆菌的新鲜米饭样品25 g至225 mL LB培养基中,接种计数的产呕吐毒素的蜡样芽胞杆菌F4810/72菌液,人工模拟样品的最终浓度分别为100cfu/g、101cfu/g、102cfu/g和103cfu/g,37 ℃静置培养,在0、2、4和6 h后分别从增菌培养基中取1 mL上清液于无菌离心管中,提取DNA进行LAMP检测。同时对含不同稀释度的菌液进行平板计数。
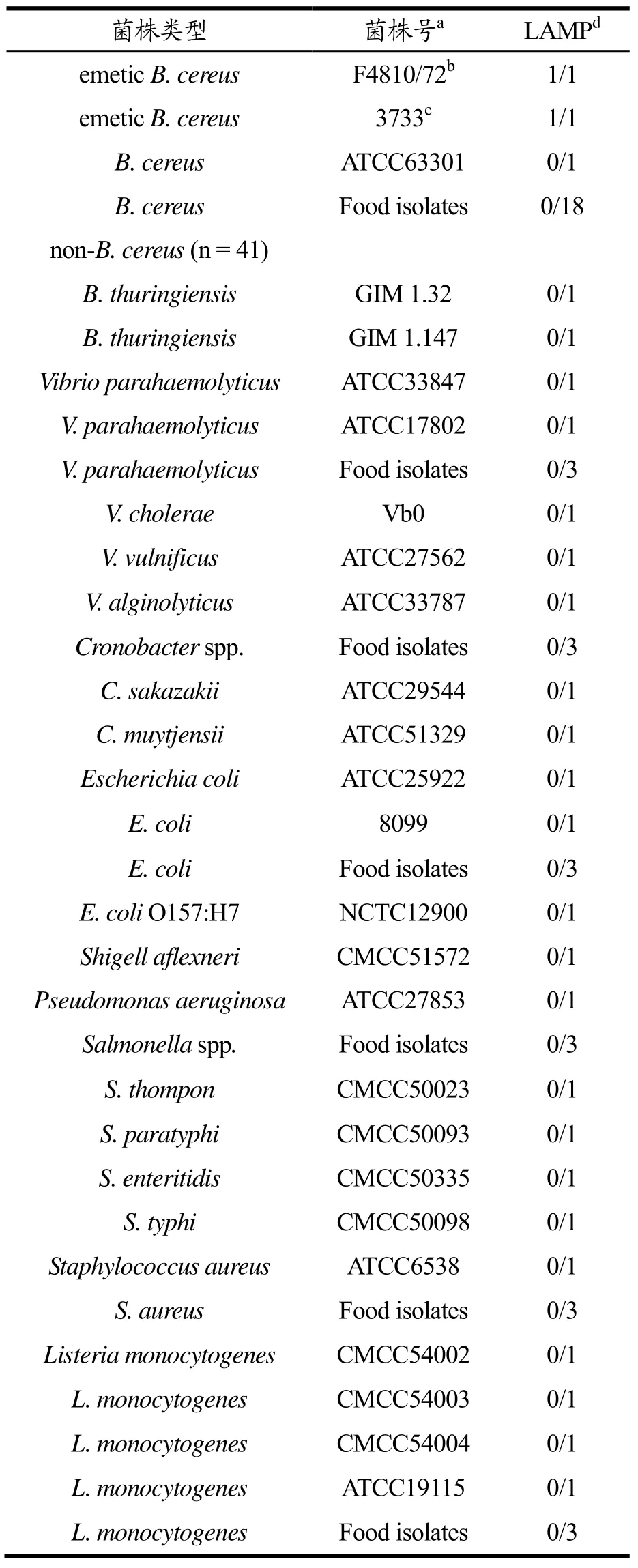
表2 特异性试验所用菌株及实验结果Table 2 The specific detection of strains
1.4.9 食品中产呕吐毒素蜡样芽胞杆菌的检测
购买各大超市和快餐店的食品 72份,其中熟食24份,水产品24份,奶制品24份。每份样品平均分成2份,一份按GB 4789.14-2014分离检测;另一份直接用胰酪胨大豆多黏菌素肉汤培养基增菌培养,取1.5 mL增菌液按上述煮沸法提取DNA,进行LAMP检测。
2 结果与讨论
2.1 LAMP特异性
为了验证所建立产呕吐毒素蜡样芽孢杆菌LAMP方法的特异性,本研究将设计的LAMP引物分别扩增2株产呕吐毒素蜡样芽胞杆菌、19株蜡样芽胞杆菌和41株非蜡样芽胞杆菌的基因组DNA,检测结果如表2所示。其中2株产呕吐毒素蜡样芽胞杆菌均为阳性,显色反应呈现绿色;19株蜡样芽胞杆菌和41株非蜡样芽胞杆菌均为阴性,显色反应呈现橙色。说明该LAMP引物仅针对产呕吐毒素蜡样芽孢杆菌cesB基因产生特异性扩增,对蜡样芽胞杆菌、苏云金杆菌(Bacillus thuringiensis)、金黄色葡萄球菌(Staphylococcus aureus)、单增李斯特菌(Listeria monocytogenes)、沙门氏菌等的DNA未产生扩增反应,LAMP扩增的特异性良好,可用于产呕吐毒素蜡样芽孢杆菌的特异检测。
2.2 LAMP灵敏度
2.2.1 DNA灵敏度

图1 LAMP DNA灵敏度实验结果Fig.1 Sensitivity of the LAMP assay with genomic DNA
用DNA抽提试剂盒抽提产呕吐毒素蜡样芽胞杆菌F4810/72基因组DNA,用酶标仪测定DNA的浓度为124 ng/μL。将上述DNA进行梯度稀释,进行LAMP扩增结果表明,LAMP的灵敏度为1.49 pg/μL(图1)。这与徐匆等(2020)建立的单增李斯特菌的LAMP基因组灵敏度相当[13]。
2.2.2 纯菌灵敏度
培养产呕吐毒素蜡样芽胞杆菌F4810/72,纯菌原始浓度为 5.0×108cfu/mL,梯度稀释,分别取不同稀释度菌悬液提取DNA,LAMP检出情况见图2。LAMP纯菌灵敏度为 5.0×103cfu/mL。杨滴等建立了蜡样芽胞杆菌的实时荧光定量PCR,其纯菌灵敏度为1.0×103cfu/mL[14],与本研究的灵敏度相当。周巍等建立了LAMP技术检测酸乳中蜡样芽孢杆菌,其纯菌灵敏度为6.4 cfu/mL,高于本研究的灵敏度[15]。

图2 LAMP纯菌灵敏度实验结果Fig.2 Sensitivity of the LAMP assay in pure culture
2.3 人工污染样品检测
培养产呕吐毒素蜡样芽胞杆菌F4810/72,人工污染米饭的接种浓度分别为2.0×100、2.0×101、2.0×102、2.0×103cfu/g,0、2、4和6 h后分别取样品增菌液用试剂盒和煮沸法提取 DNA,LAMP检出情况见表 3和图3。当起始污染菌量为2 cfu/g时,37 ℃增菌培养6 h,用试剂盒法和煮沸法提取的DNA,都可以检出产呕吐毒素蜡样芽胞杆菌。Martina(2007)等建立了产呕吐毒素蜡样芽胞杆菌的实时荧光定量PCR。产呕吐毒素蜡样芽胞杆菌人工污染米饭,经过6 h增菌,煮沸法提取DNA,灵敏度为100cfu/g[16],本研究建立的LAMP体系灵敏度与其相当。张志鸿等(2014)同样建立了产呕吐毒素蜡样芽胞杆菌的实时荧光定量PCR,产呕吐毒素蜡样芽胞杆菌人工污染米饭,经过2 h增菌,灵敏度为100cfu/g[12],高于本研究中的2 cfu/g,但该研究需要使用特定的荧光定量PCR仪器和专业人员操作,不利于在基层检测实验室大规模推广使用,无法满足现场检测的要求。当起始污染菌量大于2.0×103cfu/g时,不用经过增菌培养,LAMP可直接检测出产呕吐毒素蜡样芽胞杆菌。Zhang(2014)等建立了产呕吐毒素和非呕吐毒素的蜡样芽胞杆菌多重PCR,人工污染食品,不用经过增菌培养,其灵敏度为3.6×103cfu/g[17],与本研究的灵敏度相当。
综上所述,在大批量实际样品检测时,可以采用煮沸法提取DNA,从而节省时间和试剂。当产呕吐毒素蜡样芽胞杆菌污染食品的浓度超过103cfu/g时,不需要增菌培养过程,可以直接检出,从而缩短了检测周期。由于食用蜡样芽胞杆菌数量大于105cfu/g时有可能引起食物中毒甚至死亡,因此可以用本研究开发的 LAMP方法直接快速筛查产呕吐毒素蜡样芽胞杆菌,排查其风险。

表3 产呕吐毒素蜡样芽胞杆菌人工污染米饭不同浓度不同增菌时间的LAMP检测Table 3 Effects of different levels and pre-incubation times of artificially contaminated rice on sensitivity of the LAMP detection of emetic B. cereus

图3 产呕吐毒素蜡样芽胞杆菌人工污染米饭不同浓度不同增菌时间的LAMP检测结果Fig.3 Results of different levels and pre-incubation times of artificially contaminated rice on sensitivity of the LAMP detection of emetic B. cereus
2.4 食品中产呕吐毒素蜡样芽胞杆菌的检测
72份食品样品用传统方法检出2份产呕吐毒素蜡样芽胞杆菌阳性样品,包括一份熟食和一份巴氏奶。直接用LAMP检测72份食品样品,也检出2份产呕吐毒素蜡样芽胞杆菌阳性样品,且同传统方法一致,但比传统方法的检测时间大大缩短。
3 结论
本研究首次建立了基于cesB基因的产呕吐毒素蜡样芽胞杆菌LAMP检测方法。建立的方法具有特异性强、快速的优点。在基因组DNA水平的灵敏度为1.49 pg/μL,纯菌灵敏度为5.0×103cfu/mL。人工污染米饭样品,当起始污染量为2 cfu/g时,37 ℃增菌培养6 h,即可检出。当产呕吐毒素蜡样芽胞杆菌污染食品的浓度超过103cfu/g时,不需要增菌培养过程,亦可以直接检出。本研究建立的LAMP技术可应用于食品样品中产呕吐毒素蜡样芽胞杆菌的快速筛查检测,简便快捷,具有较好的推广应用前景。

