双孢蘑菇来源非特异性过氧合酶在毕赤酵母中的表达及生化表征
庞能威,杨博,王永华
(1.华南理工大学生物科学与工程学院,广东广州 510006)
(2.华南理工大学食品科学与工程学院,广东广州 510640)
非特异性过氧合酶(Unspecific peroxygenase,UPO,EC 1.11.2.1)属于血红素氧化酶超家族的一员[1],与单加氧酶 P450的催化功能相似,它能对一系列底物进行氧化并表现产物的出位置选择性和立体选择性。P450的催化反应需要利用O2分子作为供氧剂,同时依赖 NAD(P)H辅助催化氧化过程的发生。而UPO可直接催化转移H2O2中的氧分子到底物中,无需额外的辅因子参与,所以 UPO具有更高的工业应用价值。除了催化有机化合物的非活性C-H键之外,UPO还可以实现卤代芳香化合物的氧化[2]、含有C=C键化合物的环氧化[3]和硫化物的氧化[4]等,因此其在食品原料加工[5]、医药行业[6]和环境治理[7]等领域有巨大的应用潜力。
研究发现,UPO主要存在于双核菌亚界(Dikarya)和高等真菌界的子囊菌门(Ascomycota)和担子菌门(Basidiomycota)中[1]。由于真菌孢子难以实现高密度发酵,从而导致大规模获得野生型UPO十分困难,目前只有少数 UPO被表达和鉴定。因此异源宿主重组表达是获得 UPO重要的途径之一,然而异源宿主重组表达具有活力的非特异性过氧合酶一直是巨大的挑战[8,9],目前报道的十余种UPO,仅有六种UPO实现了异源表达。随着高通量基因组测序技术的发展,大量微生物基因组信息被储存在公共生物数据中。利用生物信息学方法从海量数据中获得假定的酶基因序列,是获得有价值酶制剂的重要途径之一。
双孢蘑菇(Agaricus bisporus)是自然界中的一种常见食用菌,它具有较强降解腐殖质的能力,因此能更好地适应复杂的营养环境。但是,目前尚不完全了解双孢蘑菇利用各种养分资源的机制。此前Emmanuelle Morina等[10]提出假说:双孢蘑菇可能已经进化出了其特有的代谢策略和生态适应性,这都源于它具有的独特的底物转化酶,而 UPO正是该类物种特有的酶之一。本研究实现了来自Agaricus bisporus var. bisporus的非特异性过氧合酶(AbvbUPO)基因在毕赤酵母GS115进行异源分泌表达并初步研究了其催化特性,为继续探究其底物特异性揭示解其环境适应性的可能原因打下基础,以期获得生物化工和食品化工领域应用的UPO酶制剂。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
毕赤酵母表达菌株GS115,质粒pPIC9K均为本实验室保存,大肠杆菌DH5α感受态细胞购自唯地生物科技有限公司。
1.1.2 生化试剂
限制性内切酶BamHI,高保真DNA聚合酶购自TaKaRa大连生物工程公司;无缝克隆试剂盒购自中美泰和生物技术(北京)有限公司;质粒提取试剂盒购自生工生物工程(上海)股份有限公司;Westernblot的一抗为小鼠抗His-tag单克隆抗体,二抗为山羊抗小鼠IgG(H&L)二抗(HRP标记),均购自金瑞斯生物科技公司。
1.1.3 主要仪器设备
EDG-810型PCR仪,东胜创新生物技术科技有限公司;生化培养箱,重庆市永生试验仪器厂;DYY-8C型电泳仪,北京市六一仪器厂;SKY2102C型摇床,SUKUN;全自动凝胶成像仪,BIO-RAD;7000D型 GC-TQ/MS,安捷伦科技有限公司;HP-INNOWax色谱柱,安捷伦科技有限公司。
1.2 实验方法
1.2.1 非特异性过氧合酶AbvbUPO序列的合成和分析
AbvbUPO基因序列(XP_006457061.1)委托上海生工生物工程有限公司合成。使用DNAMAN软件进行序列的对比,使用ESPript[11](网站)呈现同源比对结果。
1.2.2 非特异性过氧合酶AbvbUPO的基因克隆
利用 PCR扩增技术获得目的基因片段(上游引物:5’-GAGGCTGAAGCTTACGTAGAATCACCAGG TGCTCCTCCTGGA-3’;下游引物:5’-TTAATGATGA TGATGATGATGGGATCCTTAATTGTCATTCCCATA GGG-3’),扩增条件如下:98 ℃ 5 min,98 ℃ 15 s、55 ℃ 15 s、72 ℃ 1 min 共30 个循环,循环结束后 72 ℃保持5 min。将BamHI单酶切后的pPIC9K载体与扩增得到的目的基因进行连接,转至DH5α大肠杆菌感受态细胞中并涂布至含有100 μg/mL氨苄青霉素的固体LB平板。次日,提取重组质粒并送往上海生工公司测序。
1.2.3 重组蛋白AbvbUPO的表达
(1)重组酵母的摇瓶发酵:将重组质粒pPIC9K-AbvbUPO电转化至P. pastorisGS115中,种子液按10%接种量接种至100 mL的BMGY液体培养基中30 ℃、200 r/min培养。24 h后将发酵液低温离心,去除上清液后加入100 mL的BMMY培养基进行诱导表达,每隔24 h补加0.5 mL的甲醇。甲醇诱导72 h后停止培养,将发酵液进行低温离心,收集上清液,利用 10 ku截留超滤管进行浓缩,浓缩后用SDS-PAGE凝胶电泳和Western blot检测AbvbUPO在P. pastorisGS115中的表达情况。
(2)重组酵母的发酵罐发酵:二级种子液按10%接种量接种,30 ℃、200 r/min培养24 h。将培养至对数生长期的二级种子液按 10%(V/V)接种到经过高压灭菌的5 L发酵罐中(含3 L基础盐培养基:26.7 mL/L的85%磷酸,0.93 g/L的CaSO4·2H2O,14.9 g/L的MgSO4·7H2O,18.2 g/L的K2SO4,7.13 g/L 的KOH,40 g/L的甘油,灭菌后加入 PTM1微量元素至 12 mL/L),30 ℃、800 r/min培养。当基础盐培养基的甘油被消耗完时,用 50%(V/V)的甘油进行补料(含12 mL/L的PTM1微量元素),流速根据溶氧(DO)调整,使溶解氧浓度保持在40%左右。当湿重达到160 g/L时停止补料并饥饿培养1 h,饥饿培养结束后,将温度设为22 ℃,pH控制在6.0左右。流加甲醇进行低温诱导使其溶氧控制在40%左右至132 h。酶液用10 ku切向流超滤膜包进行浓缩后检测重组蛋白的表达情况和酶活力。
1.2.4 UPO活力检测
本实验用2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)作为底物检测AbvbUPO的酶活[12]。1个酶活力单位定义为:在25 ℃和pH 4.0条件下,每分钟水解1 μmol底物(ABTS)生成对应产物(ABTS自由基)所需的酶量为1个酶活单位(U)。
1.2.5 SDS-PAGE和Westernblot检验
SDS-PAGE:将蛋白质样品用5%的浓缩胶浓缩,并通过 10%的分离凝胶进行不同分子量蛋白质的分离,最后将分离凝胶用考马斯蓝R250染色。
Westernblot:将装有SDS-PAGE凝胶和0.2 μm聚偏二氟乙烯膜(PVDF)的电转印夹放入电泳槽中低温转印。转印结束后,PVDF膜用 5%(m/V,TBST溶解)脱脂奶粉室温封闭2 h,然后与小鼠抗His标签抗体(Genscript,中国上海)一起低温过夜孵育,孵育结束后用TBTS缓冲液清洗,随后用山羊抗小鼠IgG(H&L)二抗(HRP标记)孵育,最后用DAB显色液(Solarbio,中国上海)显色以验证重组 His-tag-AbvbUPO蛋白。
1.2.6AbvbUPO的酶学性质表征
1.2.6.1 粗酶液的缓冲液置换
为了避免酶发酵液中离子成分对酶活力造成影响,进行酶活性评估前需对原有的缓冲液进行置换。利用10 ku孔径截留的超滤管置换缓冲液,按照粗酶液与20 mM的磷酸盐缓冲液(pH 7.0)的比例为1:10添加磷酸盐缓冲液,置换缓冲液多次至发酵罐缓冲液成分为微量为止。
1.2.6.2 最适反应温度和热稳定性
最适反应温度:按照方法1.2.4的活性检测方法,检测25~42 ℃范围内AbvbUPO酶液催化ABTS的活性变化。缓冲体系为 100 mM 的磷酸钠缓冲液(pH 4.0),反应时间为10 min。热稳定性:测定AbvbUPO酶液在30、35和40 ℃下孵育10~120 min下的残余酶活力。
1.2.6.3 最适反应pH
以ABTS为底物,在pH范围为3.0~7.0的缓冲液下测酶活性的变化,其他条件保持不变。其中 pH 3.0~5.0范围所使用缓冲液为100 mM的柠檬酸-柠檬酸钠缓冲液,pH 6.0~7.0的范围所使用缓冲液为100 mM磷酸盐缓冲液。
1.2.6.4 过氧化氢耐受性
将AbvbUPO酶液与不同浓度(2、5、10、20 mM)的H2O2进行等体积孵育,孵育5 min后按照反应体系内H2O2等量的原则调整加入H2O2的量进行残余活力测定。
1.2.6.5 酶级联催化反应及产物检测
向5 mL旋盖玻璃瓶中依次添加400 μL的50 mM磷酸盐缓冲液(pH 7.0)、100 μL的1 M氯化胆碱溶液,充氧后,加入50 μL的100 μM胆碱氧化酶(AnChOx)酶液,400 μL的AbvbUPO酶液,5 mM乙基苯,最后用50 mM的磷酸盐缓冲液(pH 7.0)补足1 mL。玻璃瓶放置于恒温油浴锅,于反应温度为 30 ℃、搅拌速度为500 r/min条件下反应,反应结束后用乙酸乙酯萃取,离心后取上层有机层进行GC-MS检测分析。
GC-MS检测升温条件:以10 ℃/min的升温速率从最初的50 ℃升温至190 ℃,保持3 min,以5 ℃/min的升温速率从190 ℃升温至230 ℃,然后保持6 min。
产物浓度的计算:精确称取β-苯乙醇,配置成1、2、3、4、5 mM的β-苯乙醇溶液,通过对标准品进行GC-MS检测,根据气相色谱图的吸收峰绘制β-苯乙醇的浓度标准曲线。将萃取物中保留时间与产物相对应的吸收峰代入标准曲线即得产物浓度,苯乙酮的含量仅为相对定量。
1.2.7 数据处理
用Origin 8.5软件作图并用SPSS 9.0进行统计学分析。
2 结果与讨论
2.1 非特异性过氧合酶AbvbUPO序列比对分析
对目前报道的UPO酶基因进行分析,发现UPO催化保守序列为 Pro-Cys-Pro(PCP)、Glu-Gly-Asp(EGD)和酸碱催化剂对 Arg-Glu(R-E),其中 Arg和Glu充当酸碱对在过氧化物酶催化活性中间体的形成起着重要的稳定作用[8]。AbvbUPO成熟肽基因的分子量为984 bp,编码328个氨基酸,蛋白分子量理论值大小为 35 ku,DNAMAN软件序列比对分析发现AbvbUPO 与Agrocybe aegeritaUPO(AaeUPO)、Coprinus radiansUPO和Coprinopsis cinereaUPO中氨基酸序列存在38.64%~62.93%的相似性。同源序列对比如图1所示,AbvbUPO具有UPO的催化保守序列,即 Pro81-Cys82-Pro83,Glu168-Gly169-Asp170和Arg235-Glu242,提示AbvbUPO可能具有UPO的催化特性。

图1 AbvbUPO的序列比对及同源性分析Fig.1 Multiple sequence alignment of AbvbUPO and its homologs
2.2 非特异性过氧合酶AbvbUPO基因克隆及表达
质粒谱图如图2所示,基因片段与带有组氨酸标签的pPIC9K载体连接后转化至大肠杆菌DH5α感受态中。菌落PCR呈阳性的转化子送往测序中心测序,进一步确认AbvbUPO成功克隆到pPIC9K载体上。
真核表达系统具有完善的翻译后修饰功能,可有效提升异源表达的蛋白可溶性及活性,因此选用了毕赤酵母GS115作为表达宿主。然而毕赤酵母重组菌在摇瓶发酵中,没有检测出目的蛋白条带及酶活,故将毕赤酵母重组菌在 5 L发酵罐中进行高密度发酵,Western blot结果显示AbvbUPO在毕赤酵母GS115中表达的分子量为 35 ku(图 3)。浓缩酶液具有氧化ABTS底物的酶活力,其 132 h发酵单位活力为45399.26 U/L。实验结果与Miguel Alcalde等[9]的研究结果一致,克隆至毕赤酵母X33的野生型AaeUPO在小型发酵中,表达量几乎无法达到检测限,提示野生型UPO的表达量低,小型发酵无法达到UPO的蛋白质及酶活的检测水平。目前,仅有AaeUPO在酵母中得以表征,Miguel Alcalde等[13]在毕赤酵母中,利用发酵罐高密度发酵AaeUPO定向进化后的突变体PaDa-I,培养6 d酶活可达232000 U/L。

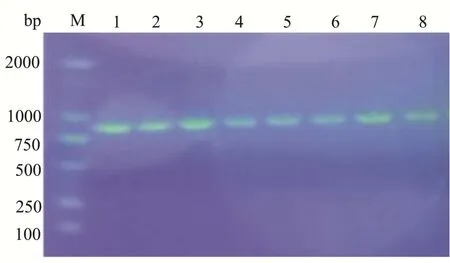
图2 质粒谱图和琼脂糖凝胶电泳检测菌落PCRFig.2 Plasmid and agarose gel electrophoresis of colony PCR

图3 SDS-PAGE和Western blot检测重组蛋白在P. pastoris GS115中表达Fig.3 SDS-PAGE and western blot analysis of the expression of the recombinant protein in P. pastoris GS115
2.3 AbvbUPO的酶学性质表征
2.3.1 温度对AbvbUPO活力的影响

图4 非特异性过氧合酶AbvbUPO最适反应温度Fig.4 Optimum temperature of AbvbUPO
本实验针对酶反应时的最适温度和热稳定性进行考察。如图4所示,AbvbUPO酶液的最适反应温度为35 ℃、30 ℃和 40 ℃可保持最大活力的 73.39~78.40%(图4)。目前被研究最透彻的AaeUPO的最适反应温度为30 ℃[14,15],其余关于UPO催化研究的报道,但研究设计温度普遍设置在 23~40 ℃之间[3,16,17],提示 UPO无法在高温下实现高效催化反应,AbvbUPO亦然。
酶的热稳定性实验显示,AbvbUPO在不同温度孵育10 min后,酶活性急剧降低,40 ℃下孵育10 min之后,仅呈现 52.97%的活性(图 5),这表明该酶蛋白解折叠所需要的能量较低,推测是 UPO的普遍特征。Diana等[18]对AaeUPO的热孵育实验也表明UPO的热不稳定性,在63 ℃孵育5 min后,AaeUPO的活力下降超过80%。提高UPO的最适反应温度和热稳定性,对于UPO的研究有着重大意义。
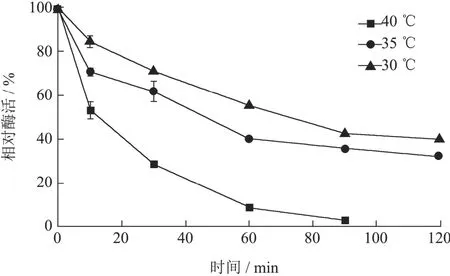
图5 非特异性过氧合酶AbvbUPO热稳定性Fig.5 Thermostability of AbvbUPO
2.3.2 溶液pH对AbvbUPO活力影响

图6 AbvbUPO催化ABTS底物的最适pHFig.6 Optimum pH of AbvbUPO catalyzing ABTS
酶活检测体系不变,仅对缓冲液的pH进行调整,由于pH小于3.0时,反应体系内会出现蛋白质析出的现象,故仅对pH大于3.0的缓冲液进行比较(图6)。结果显示,AbvbUPO催化ABTS的最适pH为3.0~4.0,与AaeUPO[9]和Marasmius rotulaUPO(MroUPO)[19]的最适pH一致,表明该酶为酸性条件下催化ABTS活性更佳。
2.3.3AbvbUPO过氧化氢耐受性
UPO是血红素氧化物酶(HTP),需要H2O2作为共底物,然而氨基酸可能会被 H2O2氧化,从而影响酶的活性[20],此外,H2O2可能将血红素氧化为α-内消旋-羟基-血红素,导致HTP的不可逆失活[21]。所以利用UPO作为生物催化剂时往往需要探索适当的H2O2浓度以降低酶活力的损失。结果表明,AbvbUPO不适宜在高浓度 H2O2的环境下长时间进行生物催化,AbvbUPO被5 mM的H2O2孵育5 min后,酶活力仅为初始活性的54.98%(图7)。据报道[8],在不同浓度H2O2与AaeUPO共底物的催化实验中,当H2O2浓度大于2.5 mM时,产物的生成率会随着过氧化氢浓度的升高而降低,Karich Alexander等[22]提出,UPO的活性的降低与血红素的丢失有关,推断是由于反应中的羟基自由基使血红素形成绿色素和胆绿素进而终止催化反应。为了更真实地反映其底物选择性和催化潜力,需要建立一种降低反应体系中 H2O2浓度的办法来降低其在催化过程中的酶活损失。

图7 AbvbUPO过氧化氢耐受性Fig.7 H2O2-tolerance of AbvbUPO
2.4 AbvbUPO参与的级联催化反应体系建立
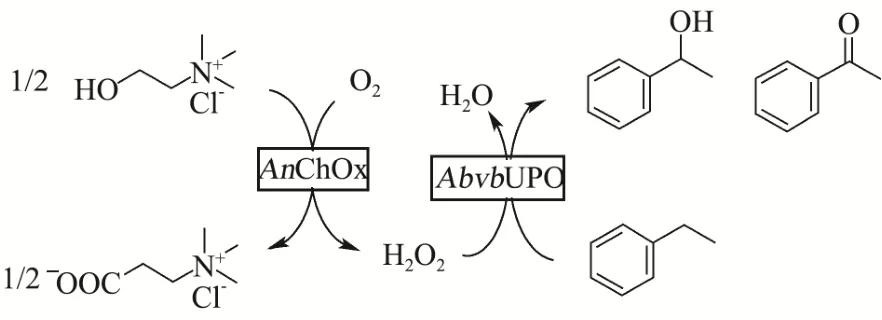
图8 AbvbUPO酶级联反应示意图Fig.8 Figure of AbvbUPO enzymatic cascade reaction
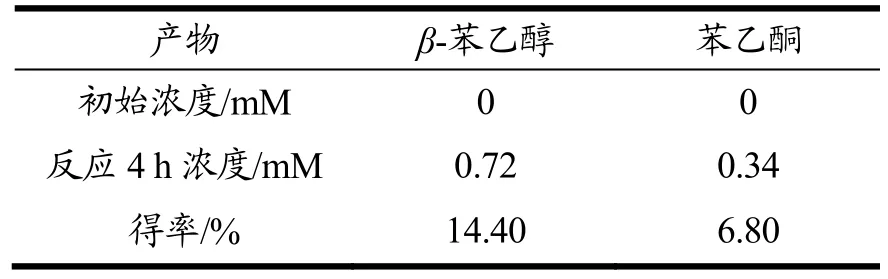
表1 AbvbUPO酶级联反应产物得率表Table 1 Productyield of AbvbUPO enzymatic cascade reaction
如上文所述,AbvbUPO不耐受高浓度的H2O2,因此采用原位生成 H2O2的酶级联反应代替一次性加入过量的H2O2作为共底物[14,23]。本实验原位生成H2O2方法(图 8)是使用氯化胆碱作为电子供体,通过来自烟草节杆菌来源的胆碱氧化酶还原分子氧来产生H2O2。β-苯乙醇是一种重要的食用香精香料,被广泛地应用在食品风味提升工艺之中[24],而它的底物乙基苯也是 UPO的常用底物[14],因此利用该催化反应验证AbvbUPO级联催化反应活性可行性。气质联用分析结果表明(图9),保留时间为4.74 min、9.07 min和9.15 min的产物分别为乙基苯、β-苯乙醇及苯乙酮。AbvbUPO能够氧化乙基苯为β-苯乙醇,且4 h内转化率可达14.40%,但随后转化率逐渐降低,推测是该酶热稳定性弱,长时间30 ℃孵育会造成酶活力的损失,同时产物中伴有副产物苯乙酮,因为反应过程中苯乙醇产物被AbvbUPO继续氧化,导致了苯乙酮的生成。Frank Hollmann等人[5]研究AaeUPO羟基化乙基苯的反应实验表明,反应前期苯乙酮会大量增加,因为苯乙醇的积累抑制了过氧化,在反应30~60 min时苯乙酮增长速率开始下降并且趋于稳定。本实验表明,AbvbUPO能与胆碱氧化酶实现级联催化反应,使AbvbUPO在有机合成及相关领域具有很大的应用潜力。

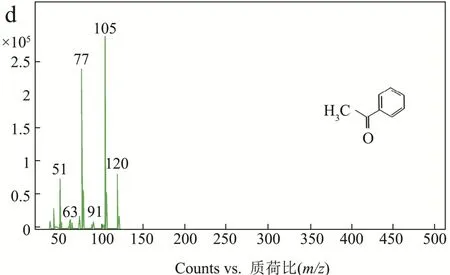
图9 GC-MS检测AbvbUPO酶级联催化反应Fig.9 GC-MS analysis data of AbvbUPO enzyme cascade reaction
3 结论
本研究将来源于Agaricus bisporus var. bisporus的非特异性过氧合酶AbvbUPO为目标蛋白,在毕赤酵母GS115中成功异源表达,并研究其催化ABTS的最适pH,最适温度和热稳定性。除此之外,针对血红素氧化酶不耐受H2O2的问题进行研究,发现AbvbUPO的H2O2耐受性较差,故通过原位H2O2生成技术,降低反应体系中H2O2的浓度,再串联AbvbUPO催化底物的氧化。本文研究结果为非特异性过氧合酶的异源表达和进一步研究其底物选择性搭建了可行的平台。
——过氧碳酸钠

