大肠杆菌O157:H7快速增菌培养基检测效果的研究
宫春波 刘磊 陶文靖 王覃
摘 要:为了验证对于大肠杆菌O157:H7菌株特异性、复苏效果以及快速生长的特点,比较了3种培养基对于大肠杆菌O157:H7的增菌效果。研究结果表明,8h培养时间内,MicroFast?快速增菌培养基对于冷损伤和热损伤的大肠杆菌O157:H7菌株具有良好的修复和增殖效果。MicroFast?快速增菌培养基营养组分适合O157菌株的生长需求,在MicroFast?快速增菌培养基中,大肠杆菌O157:H7菌株的倍增时间为13.5min,远高于mEC+n的28min,且MicroFast?快速增菌培养基能够完全抑制部分G+细菌以及部分G-细菌的干扰,对于大肠杆菌O157:H7具有特异性的选择。故MicroFast?快速增菌培养基对于大肠杆菌O157:H7菌株具有良好的选择特异性,能够短时间内(8h内)有效富集培养大肠杆菌O157:H7菌株,是一种能够实现大肠杆菌O157:H7菌株快速高效、特异增殖的培养基,将其结合检测金标卡,能够实现8h内快速检测,结果可信可靠。
关键词:MicroFast?快速增菌培养基 大肠杆菌O157:H7 增菌 效果
目前,病原微生物污染防控是食品安全的刚性需求,微生物污染是食品不合格的主要原因,也是造成食物中毒的主要原因,尤其以细菌性食物中毒为主,食品中大肠杆菌污染率最高达到了41.1%,大肠杆菌O157则为3.7%[1]。肠出血性大肠杆菌O157:H7是肠出血性大肠杆菌(EHEC)的一个血清型,是引起食源性疾病主要血清型[2],主要临床症状为突发性腹痛、腹泻、血便,严重时并发肾衰竭,病死率高。大肠杆菌O157:H7主要污染肉类食品[3,4],蔬菜中也时有检出[5],是食品中潜在危害巨大的食源性致病菌。因此,快速、特性、高效的检出食品中大肠杆菌O157:H7,对于其引起的食源性疾病防控以及暴露病例的治疗具有重要的意义。本文比较了MicroFast?快速增菌培养基(简称MF培养基)、改良EC肉汤培养基(简称:mEC+n)和FP培养基对大肠杆菌O157:H7的增菌效果,以期验证不同培养基的增菌优势和特异性,为探索省时、高效、特异的快速检测方法提供依据。
1 材料与方法
1.1菌种
大肠埃希氏菌O157:H7(ATCC12478/NCTC12900)为实验用标准阳性菌株。
大肠杆菌FSCC146255/146264、ATCC25922/8739、CMCC44102/44103(Escherichia coli)、肠杆菌ATCC14028/ 43864/49027(Enterobacteria),沙门氏菌CICC21482 CMCC 50333/50220/50115/ 50335(Salmonella),李斯特氏菌ATCC 19115、CMCC54002/ 22260(Listeria),假单胞菌ATCC 27853、CMCC10104(Pseudomonas),枯草芽孢杆菌ATCC 6633、CMCC63501(Bacillus subtilis),为特异性检测用菌株。
1.2 培养基
MicroFast?快速增菌培养基,简称MF培养基,北京良润生物科技有限公司;改良EC肉汤培养基,简称为mEC+n培养基,按照GB 4789.36-2008规定步骤配置,备用;FP培养基,国外某品牌培养基。
1.3 仪器设备
紫外可见分光光度计(UV-2450),日本岛津;隔水式电热恒温培养箱(GHP-9270),金坛市城东久久实验仪器厂;净化工作台(YJ-875),吴江市华都净化设备公司;自动电热压力蒸汽灭菌器(LDZX-40C1),上海申安医疗器械厂;电子天平(BSA323S),北京赛多利斯。
1.4 方法
1.4.1 培养基的制备
按照说明书或者GB 4789规定的要求和步骤进行,按照需要制作液体培养基和固体培养基。
1.4.2 菌株修复
将阳性标准菌株进行制备热损伤和冷损伤。热损伤菌体制备:将标准阳性菌株的菌悬液(108~109cfu/mL)置于55℃水浴锅、加热15min后取出,室温冷却30min,定义为热损伤菌体细胞,备用。冷损伤菌体制备:将菌悬液置于-20℃冰箱、冷冻2h,然后取出室温预热30min,定义为冷损伤菌体细胞,备用;正常对照组:未做处理的菌悬液,定义为正常组菌体细胞。将相同浓度的大肠埃希氏菌O157菌悬液菌,分别按照上述规定的方法进行菌体损伤处理,36±1℃、培养8h后,稀释进行平板计数,每组做5个平行,取平均值。
1.4.3 生长速度
吸取0.2mL大肠埃希氏菌O157 NCTC12900的菌悬液(108~109cfu/mL),按照2%的接种量,分别接种到盛有10mL MF培养基、mEC+n培养基和FP培养基的18×180mm试管中,每组10支试管,36±1℃培养,每隔1h测定其OD600吸光度值,每只试管测3次,取平均值绘制其生长曲线。同时通过平板计数法计数对数期各时间点的菌落形成单位数,计算倍增时间。
1.4.4 特异性
无菌吸取0.2mL对照标准菌株菌悬液(108~109cfu/mL),接种于盛有10mL不同培养基中,36±1℃、培养18h,观察培养管的浑浊程度,统计结果。
2 结果与分析
2.1 MF培养基、mEC+n培养基和FP培养基对菌株复苏效果
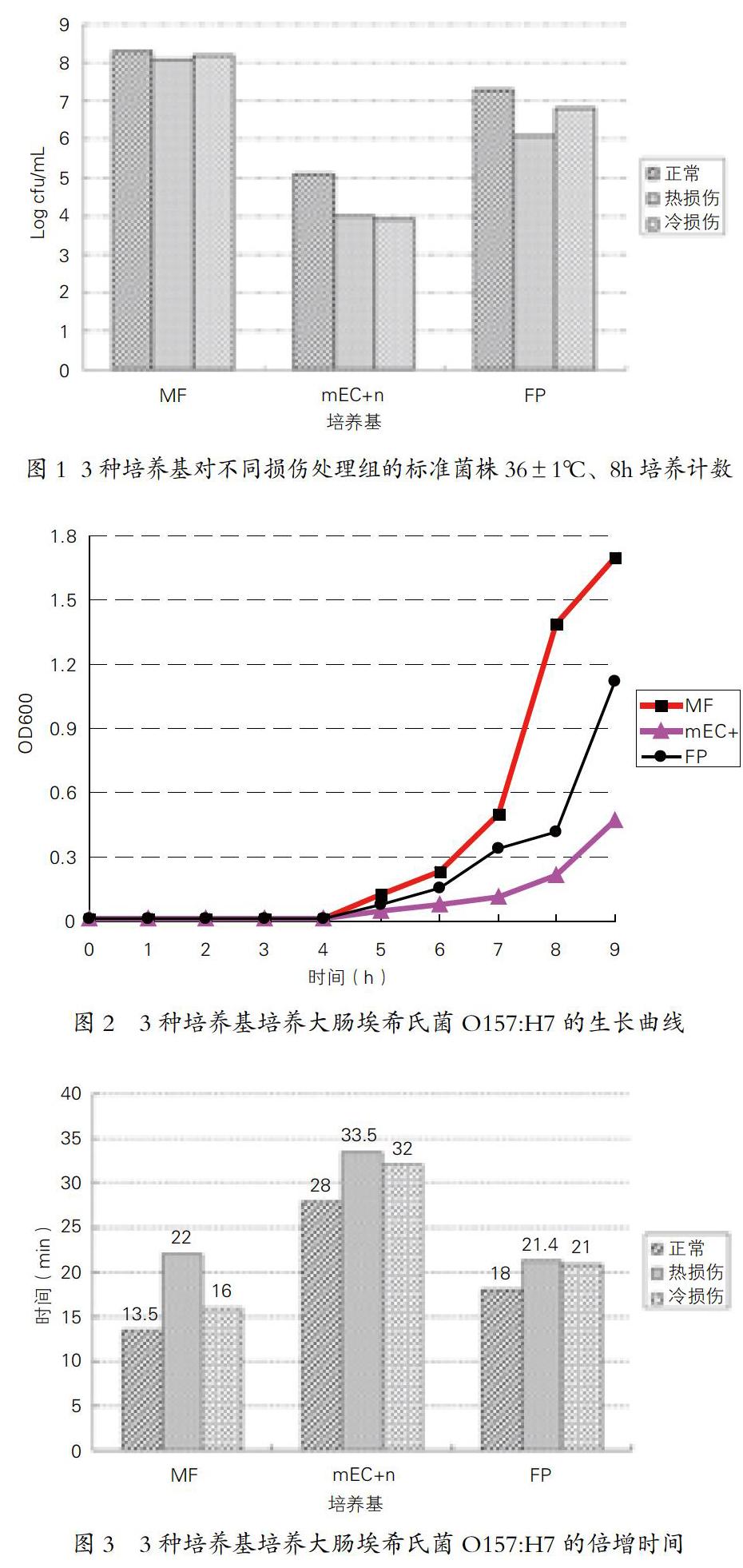
热损伤、冷损伤往往导致细菌菌体细胞生理状态的破坏,部分成为存活但不能培养的菌体细胞(viable but non-euhurable state,VBNC),无法再常规培养基增殖生长[6],具体到食品卫生微生物检测,由于培养基的差异或者营养成分的缺失,往往不适合VBNC菌体细胞的增殖,从而无法计数检测VBNC,增加了假阴性的几率。图1表明,热或冷损伤菌体细胞在MF培养基上复苏效果好于mEC+n培养基和FP培养基,尤其是高于GB 4789.36-2008规定培养基计数值的3个数量级,说明MF培养基成分能够利于O157菌株的复苏和增殖,促进损伤细胞的复苏,特别是8h培养时间,远远低于GB常规检测规定的时间,具有耗时短,增殖复苏效果好的特点,适合快速检测的前期培养和目的菌株的初分离。
2.2 MF培养基、mEC+n培养基和FP培养基对菌株生长影响
大肠埃希氏O157:H7标准菌株在3种培养基上生长速度存在差异(如图2),尽管菌体在3种培养基上进入对数生长期的时间接近,但对数生长期的菌体生长速度各异,MF培养基、FP培养基均优于GB 4789.36-2008规定的mEC+n培养基,MF培养基生长速度最快,其倍增时间最短,尤其是对于冷损伤菌体(如图3),表现出良好的修复和增殖功效,说明MF培养基组分适合大肠埃希氏菌O157:H7的生长,提供生长因子满足其增殖的要求。
2.3 MF培养基、mEC+n培养基和FP培养基抑菌情况
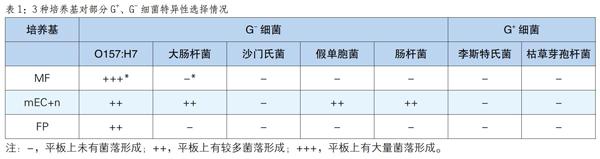
特异性验证结果表明(见表1),MF培养基、mEC+n培养基和FP培养基均能够较好的抑制G+细菌,李斯特氏菌、枯草芽孢杆菌在3种培养基上均检测不到菌落的形成,说明培养基能够有效抑制G+生长,减少了假阳性结果,提高了可信度。对于G-细菌,MF培养基均能抑制沙门氏菌、肠杆菌、假单胞菌和大肠杆菌,尤其对于大肠杆菌的抑制,说明MF培养基对于O157:H7特异性强,具有良好的选择性。mEC+n培养基抑制效果相对较弱,不能够很好地抑制大肠杆菌、肠杆菌和假单胞菌。3种培养基均能选择性地培养O157:H7菌株,MF培养基特异性要优于其他2种培养基,mEC+n培养基选择性最弱。食品卫生微生物检测中选择性培养基的特异性是检测结果的基石,其选择性高低决定着结果的可靠、可信程度,尤其快速检验逐渐将成为主流检测方法,因此选择性培养基特异性更加重要。实验结果说明,MF培养基对于O157的检测具有优良的特异性,其选择性培养结果可信可靠,优于同类培养基产品。
3.讨论
微生物污染是食品不合格的主要原因,也是造成食物中毒的主要病因,尤其细菌性污染往往是食源性疾病暴发的主要诱因。大肠杆菌O157:H7作为肠出血性大肠杆菌的一种,其往往侵染肉类及其制品,蔬菜及其制品中也时有报道。目前,常规方法检测O157需要18~24初分离培养,生化鉴定、血清分型等步骤,往往耗时、费力,不利于食源性疾病病例的对症治疗,也不利于污染食品的后期处理,因此快速高效、特异可靠的快检方法逐渐成为食品卫生检验微生物检验以及食源性疾病病因检测的理想方法。实现快速检测可以从三方面考虑[7]:其一,实验设备简化;其二,前处理方法简单快速;其三,简单、快速和准确地判定分析方法。由此可知,微生物检测中提高选择性培养基的特异性、快速性以及可信度,可以大大缩短检测时间,提高检测快速性。针对大肠杆菌O157的MicroFast?快速增菌培养基具有修复性好,特异性强以及适合O157生长的组分。验证试验证明MF培养基对O157具有良好的选择特异性,选择性优于FP培养基和mEC+n培养基,并且能够有效的抑制部分G+、G-细菌。MicroFast?快速增菌培养基能够8h内特异性初分离到O157,结合金标准卡法,完全能够实现8h内检测O157,远远低于GB 4789.36-2008的18~24h要求,其检测限值(1cfu/25g)、快速性以及特异性可与生物芯片技术(8h)和Lateral Flow(8.4h)技术媲美,而检测成本则较低。因此,MicroFast?快速增菌培养基及其快速检测组合方法能够满足食品中O157快检以及食源性疾病病因快速检测的要求。
参考文献:
[1]安静.你吃的食品安全吗?现阶段的食品安全风险EB/OL:摘编自旭日干、庞国芳主编《中国食品安全现状、问题及对策战略研》. http://blog.sciencenet.cn/blog-528739-957755. html,2016-1-6.
[2]李凡,刘晶晶,徐志凯.医学微生物(第7版)[M].北京:人民卫生出版社,2008,120.
[3] 郑冬冬,毕旺来,王宏勋,等. 武汉肉类食品中大肠杆菌O157∶H7分离株stx亚型和毒力特征分析[J].食品科学,2014,135(8):94-98.
[4] 崔山,张万吉. 山东省零售肉类样品中分离,鉴定携带志贺毒素基因(stx)的0157和非O157大肠杆菌[J].科技与企业,2013,(18):280,283.
[5] 邱庆超,胡传寿,周良彬,等.蔬菜中大肠杆菌O157的分离与鉴定[J].中国酿造,2013,31(9):85-87.
[6] 郭潇,雷晓凌.活的不可培养的细菌的研究进展[J]. 微生物学杂志,2010,30(3):82-86.
[7] 王晶,王林,黄晓蓉,主编.食品安全快速检测技术[M].北京:化学工业出版社,2005.

