miR-29a-3p和miR-144a-3p下调人非小细胞肺癌细胞COL11A1表达并抑制其增殖、迁移和侵袭
赵田甜,左 玮,淦 鑫
(南昌大学第一附属医院呼吸与危重症医学科,江西 南昌 330006)
肺癌是世界范围内最常见的恶性肿瘤,也是癌症相关性死亡人数最多的恶性肿瘤[1]。据最新流行病学数据显示,肺癌的5年生存率仅为15.7%~17.4%[2]。在所有肺癌患者发病人数中,非小细胞肺癌(non-small cell lung cancer,NSCLC)最为常见,占所有肺癌总发病数的85%[2]。与小细胞肺癌相比,虽然NSCLC的生长速度相对较慢,但NSCLC确诊时,大多数患者已处于中晚期[3]。目前,小分子酪氨酸激酶抑制剂和免疫治疗剂虽然给NSCLC患者带来了的生存益处,但NSCLC的5年生存率仍然很低[3-4]。因此,迫切需要继续寻找NSCLC治疗的策略。
Ⅺ型胶原α1(collagen type XI alpha 1,COL11A1)属于胶原蛋白家族成员之一,是间质细胞外基质的主要成分。有研究表明,COL11A1在胃癌、结肠癌、胰腺癌和复发性肺癌等多种恶性肿瘤中表达上调,且其异常高表达与肿瘤的恶性转移和预后不良有关[5-8]。但COL11A1在这些肿瘤中具体的生物学功能却不明确。因此,本研究目的之一是探讨COL11A1在NSCLC中的关键作用。
众所周知,microRNAs (miRNAs)在肿瘤的发生发展过程中发挥着重要作用。众多miRNAs可作为胃癌、肝癌、甲状腺癌和膀胱癌等多种肿瘤的诊断和治疗的标志物[9-12]。因此,对NSCLC中miRNAs的鉴定和筛选有助于识别NSCLC新的诊断或治疗性生物标志物。在本研究中,我们发现COL11A1在NSCLC组织和细胞中明显上调。COL11A1的下调抑制了NSCLC细胞的增殖、迁移和侵袭。目前,COL11A1表达与miRNA调节在NSCLC进展中的内部联系尚不清楚。因此,我们尝试通过targetScan 7.2软件寻找与COL11A1存在潜在靶向关系的miRNAs,鉴定它们在NSCLC中与COL11A1的内在联系,并试图分析miRNAs/COL11A1轴在NSCLC发病机制中的关键作用,为其在NSCLC治疗中的提供潜在的应用策略。
1 材料与方法
1.1 材料
1.1.1试剂 COL11A1 siRNA、阴性对照siRNA(negative control siRNA,NC-siRNA)、COL11A1抗体、Ki67抗体和基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)抗体购自Santa Cruz;EdU试剂盒、CCK-8试剂盒、BCA蛋白定量试剂盒、双荧光素酶报告基因检测试剂盒、β-actin抗体和二抗购自上海碧云天公司;RPMI 1640培养基、胎牛血清、TRIzol试剂和Lipofectamine 2000试剂购自Invitrogen;TaqMan反转录试剂盒和SYBR Green qPCR试剂盒购自Applied Biosystems;miR-29a-3p模拟物(miR-29a-3p mimic)、miR-144a-3p mimic、let-7a-5p mimic、miR-26a-5p mimic和阴性对照miRNA(negative control miRNA,NC-miR)由苏州吉玛基因股份有限公司合成。
1.1.2NSCLC组织收集 本研究纳入2018年9月~2019年6月南昌大学第一附属医院胸外科和肿瘤科行肿瘤切除术的20例NSCLC患者(临床Ⅱ~Ⅲ期,其中6例发生淋巴结转移,14例未发生淋巴结转移),并收集肿瘤组织与配对的癌旁非肿瘤组织(距离肿瘤边缘约2 cm)。NSCLC患者均为首次确诊,且术前未进行放化疗。本实验通过了本院伦理委员会批准,且所有患者均知情同意参与本研究。
1.1.3细胞 人肺癌细胞A549、H460、H520和H1299为本实验室自有;肺上皮细胞BEAS-2B和16-HBE购自上海一研生物科技有限公司。
1.1.4仪器 小型垂直蛋白电泳转印系统(Bio-Rad公司,美国);iBright CL750型蛋白凝胶智能成像系统(Invitrogen公司,美国);BX53M型金相显微镜(Olympus公司,日本);QuantStudio 7 Flex型实时荧光定量PCR系统(Applied Biosystems公司,美国);FLx800型荧光酶标仪(BioTek公司,美国)。
1.2 方法
1.2.1细胞培养 A549、H460、H520、H1299、BEAS-2B和16-HBE细胞均接种在添加有10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养液中,在37 ℃、5% CO2的培养箱中培养。
1.2.2细胞转染 收集H520对数期细胞,接种于直径35 mm培养皿中,按照转染试剂制造商的说明书步骤,利用Lipofectamine 2000试剂将COL11A1 siRNA(10 nmol·L-1)、NC-siRNA(10 nmol·L-1)、miR-29a-3p mimic(20 nmol·L-1)、miR-144a-3p mimic(20 nmol·L-1)、let-7a-5p mimic(20 nmol·L-1)、miR-26a-5p mimic(20 nmol·L-1)和NC-miR(20 nmol·L-1)转染入细胞。在转染后48 h,收集细胞用于后续检测。
1.2.3RNA提取与RT-qPCR检测 按照制造商说明书步骤,运用TRIzol试剂提取NSCLC组织、癌旁非肿瘤组织、NSCLC细胞系和正常细胞系BEAS-2B和16-HBE中总RNA,利用TaqMan反转录试剂盒将各样本总RNA逆转为cDNA,以各样本cDNA和各目的基因引物并利用SYBR Green qPCR试剂盒通过7500荧光定量PCR系统进行RT-qPCR检测。miR-29-3p、miR-144-3p、let-7-5p和miR-26-5p以U6为内部参照,COL11A1以GAPDH为内部参照,以2-ΔΔCt法计算各目的基因相对表达量。qPCR运用的引物序列(5′-3′): miR-29a-3p (正向):GCGGCGG TAGCACCATCTGAAAT,miR-29a-3p (反向):ATCC AGTGCAGGGTCCGAGG;miR-144a-3p (正向): GCG CGCTACAGTATAGATGATG,miR-144a-3p(反向): GCTGTCAACGATACGCTACG;let-7a-5p(正向): CG ATTCAGTGAGGTAGTAGGTTGT,let-7a-5p(反向): TATGGTTGTTCTGCTCTCTGTCTC;miR-26a-5p(正向): ACACTCCAGCTGGGTTCAAGTAATCCAGGA,miR-26a-5p(反向): TGGTGTCGTGGAGTCG;U6(正向): GGAGCGAGATCCCTCCAAAAT,U6(反向): GGCTGTTGTCATACTTCTCATGG;COL11A1(正向): TGGTGATCAGAATCAGAAGTTCG,COL11A1(反向): AGGAGAGTTGAGAATTGGGAATC;GAPDH(正向): GTGGACATCCGCAAAGAC,GAPDH(反向): AAAGGGTGTAACGCAACTA。
1.2.4细胞活性和增殖检测 用CCK-8法检测细胞活性,按照说明书步骤,将已转染的细胞种植在96孔中(4 000细胞/孔),继续培养24、48和72 h,在各检测时间点时,加入10 μL CCK-8溶液并继续孵育2 h,用酶标仪在490 nm波长处检测吸光值。用EdU法检测细胞增殖,按照说明书步骤,将已转染的细胞种植在96孔中(4 000细胞/孔),继续培养24、48和72 h,在各检测时间点时,加入10 μmol·L-1EdU溶液并继续孵育45 min,4%多聚甲醛固定15 min,0.3%Triton-100透膜5 min,内源性过氧化氢酶封闭液封闭15 min,PBS洗涤细胞2次,加入50 μL Click反应液避光孵育30 min,PBS洗涤细胞2次,加入20 μL Streptavidin-HRP工作液孵育30 min,PBS洗涤细胞2次,加入100 μL TMB显色液孵育10 min,用酶标仪在650 nm波长处检测吸光值。
1.2.5Transwell检测 用Transwell(滤膜8 μm孔径,24孔板)法检测细胞迁移与侵袭。100 μL已转染的细胞悬液(5 000细胞/孔)加入Transwell上室滤膜上表面用于检测细胞迁移,加入Transwell上室基质胶包被的滤膜上表面用于检测细胞侵袭;下室加入600 μL含20%胎牛血清的培养基。在37 ℃、5% CO2下孵育24 h。取出腔室并擦除滤膜上表面细胞,95%甲醇固定滤膜下表面细胞,用0.5%结晶紫染色20 min,显微镜下对细胞计数。
1.2.6Western blot检测 用RIPA裂解组织和细胞,并提取蛋白。用BCA试剂盒对蛋白定量,每样本取等量蛋白,按照常规Western blot步骤进行操作。其中按照1 ∶1 000比例孵育一抗(COL11A1、Ki67和MMP-2),并采用ImageJ软件,以β-actin为内部参照量化COL11A1、Ki67和MMP-2的相对表达量。
1.2.7荧光素酶报告实验 将人COL11A1野生型(wild type,WT)和突变型(mutation type,MUT)3′-UTR进行PCR扩增,并克隆到pGL3-荧光素酶报告质粒中。用Lipofectamine 2000试剂将pGL3-COL11A1-3′UTR WT质粒+NC-miR、pGL3-COL11A1-3′UTR WT质粒+miR-29a-3p mimic、pGL3-COL11A1-3′UTR MUT质粒+NC-miR、pGL3-COL11A1-3′UTR MUT质粒+miR-29a-3p mimic或pGL3-COL11A1-3′UTR WT质粒+NC-miR、pGL3-COL11A1-3′UTR WT质粒+miR-144a-3p mimic、pGL3-COL11A1-3′UTR MUT质粒+NC-miR、pGL3-COL11A1-3′UTR MUT质粒+miR-144a-3p mimic共转染入H520细胞中,48 h后,按照制造商说明书步骤,用双荧光素酶报告基因检测试剂盒测定萤火虫和海肾荧光素酶相对发光度(relative light unit,RLU)。报告基因荧光活性=萤火虫荧光素酶RLU/海肾荧光素酶RLU。
2 结果
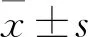
2.1 COL11A1在NSCLC组织和细胞中表达增高相对于癌旁组织,在NSCLC肿瘤组织中COL11A1的mRNA水平(Fig 1A)和蛋白水平(Fig 1B、C)明显增加(P<0.01);且相对于非转移的NSCLC的肿瘤组织,存在淋巴结转移的NSCLC肿瘤组织中COL11A1的mRNA水平(Fig 1D)和蛋白水平(Fig 1E、F)也明显增加(P<0.01)。在细胞学中,相对于正常肺上皮细胞系BEAS-2B和16-HBE,在NSCLC细胞系H460、H520、A549和H1299中COL11A1的mRNA水平(Fig 1G)和蛋白水平(Fig 1H、I)也明显增加(P<0.01)。
2.2 敲低COL11A1抑制H520细胞增殖、迁移与侵袭通过转染COL11A1 siRNA用于敲低H520细胞中COL11A1的表达(Fig 2A、B),发现敲低COL11A1明显抑制Ki67表达(Fig 2C、D)、细胞活性(Fig 2E)、细胞增殖(Fig 2F)、MMP-2表达(Fig 2G、H)、细胞迁移(Fig 2I、J)和侵袭(Fig 2I、K)(P<0.05或P<0.01)。
2.3 与COL11A1具有靶向关系的miRNAs的寻找与验证TargetScan 7.2软件预测有4个miRNAs(miR-29a-3p、miR-144a-3p、let-7a-5p、miR-26a-5p)与COL11A1的3-UTR区域具有潜在的结合序列,因此,本实验首先检测此4个miRNAs在NSCLC组织中的表达,结果(Fig 3A)显示,与癌旁组织比较,在NSCLC肿瘤组织中此4个miRNAs表达水平均明显降低(P<0.01)。在H520细胞上检测miR-29a-3p(Fig 3B)和miR-144a-3p(Fig 3C)表达水平,发现与BEAS-2B和16-HBE比较,在H520细胞中miR-29a-3p和miR-144a-3p表达水平也明显降低(P<0.01)。进一步对H520转染4个miRNAs的mimic(Fig 3D、E),发现与NC-miR比较,在H520细胞中转染miR-29a-3p mimic和miR-144a-3p mimic能明显抑制COL11A1表达(P<0.01),而转染let-7a-5p mimic或miR-26a-5p mimic对COL11A1表达无影响,提示miR-29a-3p和miR-144a-3p可能与COL11A1具有靶向关系,而let-7a-5p和miR-26a-5p与COL11A1不具有靶向关系。为验证miR-29a-3p或miR-144a-3p与COL11A1是否具有靶向关系,对预测的miR-29a-3p(Fig 3F)或miR-144a-3p(Fig 3H)的靶向结合位点进行点突变,双荧光素酶证实COL11A1是miR-29a-3p(Fig 3G)或miR-144a-3p(Fig 3I)的靶基因。
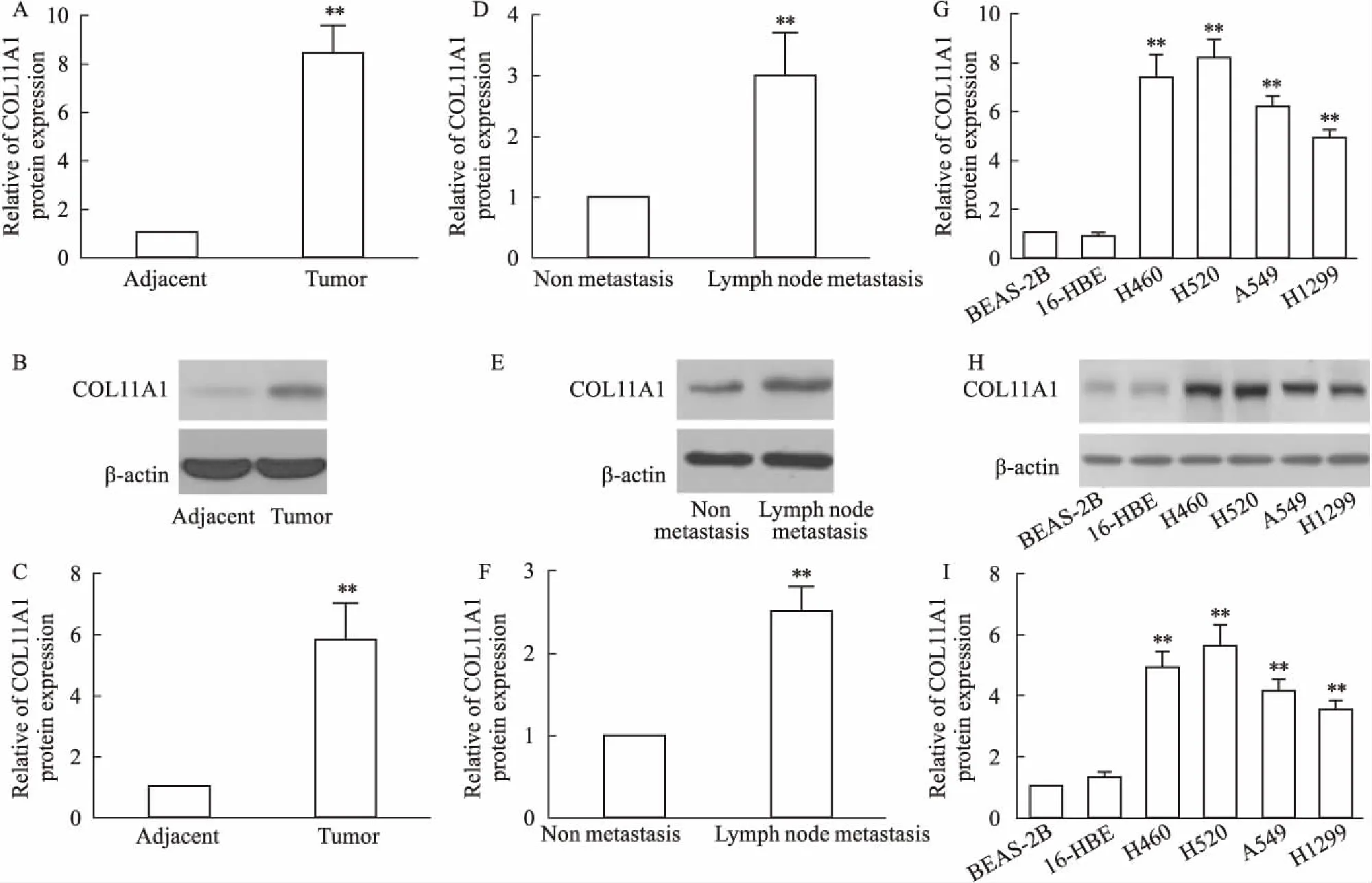
Fig 1 Over-expression of COL11A1 in NSCLC tumor tissues and cells
2.4 过表达miR-29a-3p或miR-144a-3p抑制H520细胞增殖、迁移与侵袭通过转染miR-29a-3p mimic或miR-144a-3p mimic显著H520细胞的细胞活性(Fig 4A)、细胞增殖(Fig 4B)、抑制Ki67表达(Fig 4C、D)、MMP-2表达(Fig 4E、F)、细胞迁移(Fig 3G、H)和侵袭(Fig 3G、I)(P<0.05或P<0.01)。
3 讨论
肺癌是最常见的恶性肿瘤之一,在我国肺癌的发病率和死亡率均占据所有肿瘤的首位[13]。NSCLC约占所有肺癌的85%,且NSCLC起病隐匿、早期病症不明显、容易被忽视,造成约75%的NSCLC患者确诊时已处于中晚期[2]。因此,研究NSCLC发生发展的机制,明确NSCLC的基因靶点,对NSCLC的诊断和治疗具有重要意义。最近的研究显示,COL11A1可以调节卵巢癌、结肠癌和胃癌等多种肿瘤细胞的细胞增殖、凋亡、化疗敏感性、侵袭和迁移,其在多种肿瘤中发挥致癌和促癌的特性[5-6,14-15]。且已有研究发现,COL11A1可能是NSCLC有价值的诊断标志物,其可参与调节NSCLC细胞增殖、化疗敏感性、迁移与侵袭[8,16]。但在NSCLC中调节COL11A1表达改变的上游分子仍不明确,有待进一步研究。本实验首先确认了COL11A1在NSCLC肿瘤组织和NSCLC细胞中高表达,敲除COL11A1表达能抑制NSCLC细胞增殖、迁移与迁移,这与之前的研究一致[12]。
众所周知,miRNAs可通过调控其靶基因的表达来发挥其生物学功能[10-11]。TargetScan7.2预测软件显示有4种miRNAs(miR-29a-3p、miR-144a-3p、let-7a-5p和miR-26a-5p)与COL11A1的3’-UTR区可能具有潜在结合序列。因此,本研究通过荧光素酶报告基因实验和miRNAs mimic转染技术对与COL11A1可能具有靶向关系miRNAs进行了筛选与确认,结果发现,在NSCLC细胞中miR-29a-3p和miR-144a-3p与COL11A1具有靶向关系,且miR-29a-3p和miR-144a-3p可负调控靶基因COL11A1表达。已有研究表明,此2种miRNAs在甲状腺癌、肝癌和胶质瘤等多种肿瘤中可作为肿瘤抑制因子发挥作用[10-11,17]。本实验进一步研究结果显示,miR-29a-3p和miR-144a-3p在NSCLC肿瘤组织和细胞中低表达,且过表达miR-29a-3p和miR-144a-3p能发挥与COL11A1敲低类似的生物学作用。这些结果表明,miR-29a-3p和miR-144a-3p能通过下调靶基因COL11A1表达抑制NSCLC细胞增殖、迁移与侵袭。
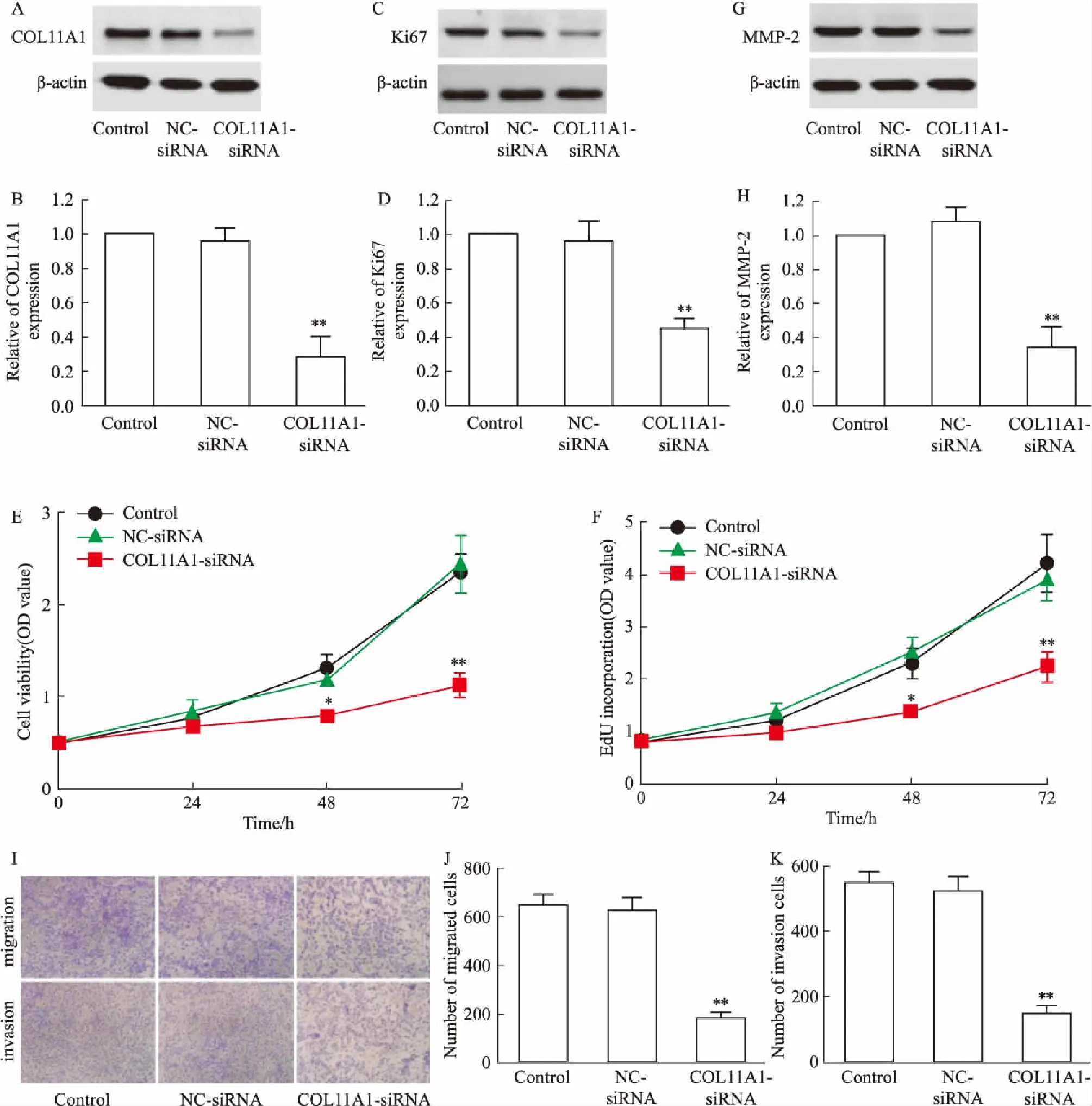
Fig 2 Proliferation,migration and invasion of H520 cells inhibited by knockdown of COL11A1
总之,我们的研究表明,miR-29a-3p和miR-144a-3p可能在NSCLC进展中作为一种潜在的肿瘤抑制因子。此外,miR-29a-3p和miR-144a-3p通过直接靶向COL11A1抑制NSCLC细胞增殖、迁移与侵袭。
Fig 3 Search and validation of miRNAs with a targeted relationship with COL11A1
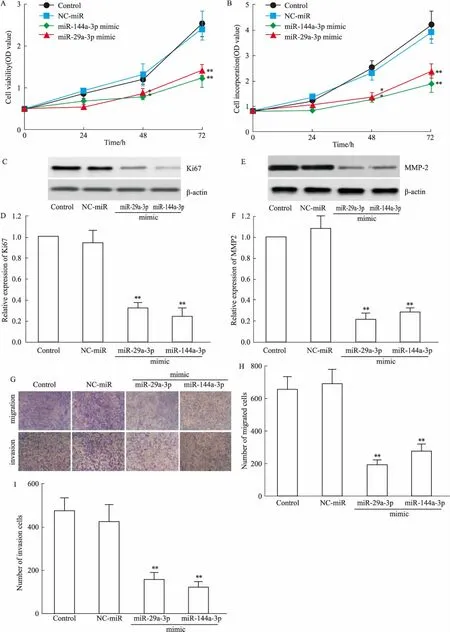
Fig 4 Proliferation,migration and invasion of H520 cells
——一道江苏高考题的奥秘解读和拓展

