LY294002抑制TFF3阳性甲状腺乳头状癌TPC-1细胞恶性生物学行为
郭梦姚,裴 达,林 旭,张文静,王 树,吴靖芳,薛 刚,2
(河北北方学院1. 形态学实验室、2. 附属第一医院头颈外科,河北 张家口 075000)
甲状腺乳头状癌(papillary thyroid cancer,PTC)是甲状腺癌最常见的病理类型,近年来甲状腺癌的发病率较过去增长了300%,而PTC约占新发病例的90%,治疗以外科治疗为主辅以内分泌治疗,放射疗法或者靶向药物治疗。虽然甲状腺癌基因组研究已取得很大进展,但仍有约4%的PTC致癌驱动程序和表观遗传突变原因尚未完全明确[1]。因此,了解甲状腺癌发病分子和遗传学机制,探索新的治疗靶点具有重要的临床意义。
肠三叶因子3(intestinal trefoil factor,TFF3)属于三叶因子家族,研究表明,TFF3作为癌基因与肿瘤细胞的恶性程度呈正相关,如在肝细胞癌中具有抗凋亡、促增殖等生物特性[2],课题组前期研究发现,敲低TFF3表达后,甲状腺乳头状癌细胞增殖受到抑制,推论这可能与TFF3影响PI3K/AKT信号通路使细胞阻滞于G0/G1期有关[3]。而PI3K/AKT通路特异性抑制剂4-吗啉基-8-苯基-4氢-1-苯并吡喃-4-酮(LY294002)是否对TFF3阳性甲状腺乳头状癌细胞有抑制作用未见报道,本研究旨在研究PI3K靶分子抑制剂LY294002对TFF3阳性TPC-1细胞的作用及机制,为寻找治疗TFF3阳性甲状腺癌的有效靶向药物提供治疗策略。
1 材料与方法
1.1 材料
1.1.1细胞株 甲状腺乳头状癌细胞株TPC-1(保存于河北北方学院形态学实验室),TFF3过表达TFF3-TPC-1细胞株实验室前期构建。
1.1.2主要仪器及试剂 IncuCyte ZOOM长时间动态活细胞成像及分析系统(Essen BioScience,美国);流式细胞仪2040R(ACEA NovoCyteTM系列,美国);LY294002(HY-10108,MedChemExpress-MCE,美国);DMSO(D2650,Sigma,美国);RPMI 1640培养基(11875093,Gibco,美国);AnnexinV-FITC/PI细胞凋亡双染试剂盒(556547,BD,美国);兔p-Akt多抗(sc-7985-R)、鼠Bax单抗(sc-70408)、鼠Bcl-2单抗(sc-7382)均购自美国Santa Cruz公司;鼠β-actin单抗(CW0096M)、山羊抗小鼠IgG(CW0102)、山羊抗兔IgG(CW0103)均购自北京康为世纪生物科技有限公司;鼠NF-κB-p65单抗(YM3111)、兔cleaved-caspase-9多抗(YC0012)、兔cleaved-caspase-3多抗(YC0004)均购自美国ImmunoWay Biotechnology Company,CA公司;兔p-IκB-α多抗(bs-2513R)、兔IκB-α多抗(bs-1287R)均购自北京博奥森生物技术有限公司;Transwell细胞培养小室(3422,Corning Costar,美国)。
1.2 方法
1.2.1细胞培养及分组TPC-1细胞株和TFF3-TPC-1细胞株 以RPMI 1640培养基(含10% FBS,1%青链霉素混合液)于37 ℃,5% CO2饱和湿度的温箱中培养,待细胞融合率达到80%时用于实验,LY294002按照说明书溶于DMSO制成5 mmol·L-1母液备用。实验对象分为3组:① 过表达组(Overexpression):TFF3-TPC-1细胞株以含有0.05% DMSO无血清RPMI 1640培养基培养;② Control组(Control):TPC-1细胞加入等量的无血清含有0.05% DMSO的RPMI 1640培养基培养;③ 实验组(抑制剂组):TFF3-TPC-1细胞分别加入含终浓度为25、50、75 μmol·L-1的LY294002等量无血清培养基培养。
1.2.2倒置显微镜观察各组细胞形态学变化 将各组细胞培养48 h后,倒置显微镜下观察各组细胞形态学变化及生长状态,拍照。
1.2.3生长曲线检测各组细胞增殖活力 取对数生长期的各组细胞常规胰蛋白酶消化,接种于96孔板(2×103cells/孔),每组设3个平行复孔,最外侧边缘加入200 μL PBS防止边缘效应,根据分组要求将96孔板置于IncuCyte ZOOM进行培养。24 h后对各组细胞进行换液处理以保证药物浓度。根据IncuCyte ZOOM长时间动态活细胞成像及分析系统生成数据绘制生长曲线。
1.2.4Transwell小室检测各组细胞侵袭能力 Matrigel基质胶4 ℃过夜冻融制成匀浆状,按1 ∶6比例加入无血清RPMI 1640培养基稀释,取100 μL稀释液加入Transwell小室底部膜上室置于在37 ℃孵箱2 h,待凝固成胶后上室分别加入过表达组,Control组以及含不同浓度的LY294002(25、50、75 μmol·L-1)处理的实验组细胞悬液100 μL,细胞密度维持在 5×105mL-1培育,下室加入500 μL培养基。将Transwell小室置于37 ℃孵箱培育48 h后取出,PBS清洗后使用0.1%结晶紫染色30 min,PBS清洗3遍,镜下随机选取5组视野拍照观察,计算平均数,实验重复3次。
1.2.5划痕实验检测细胞迁移水平 将TPC-1细胞株和TFF3-TPC-1细胞株接种于96孔板中(3×103cells/孔),常规培养,待生长至单层贴壁细胞且融合度达到90%后,使用96孔划痕器(Wound Maker Tool)单向移动形成均匀一致的“一”字划痕,PBS清洗划痕造成的脱落细胞,根据实验分组要求加入不同干预因素的培养基,每组细胞设立3个复孔,上机培养48 h,使用IncuCyte监测记录0、24、48 h的3组细胞划痕愈合的实时动态全过程。ImagePro图像分析软件比较细胞愈合面积和迁移水平。划痕愈合指数/%=(划痕宽度0 h-划痕宽度12或24 h)/划痕宽度0 h×100%。
1.2.6流式细胞仪检测细胞凋亡 过表达组、Control组以及含不同浓度的LY294002(25、50、75 μmol·L-1)的实验组细胞培养48 h,PBS洗涤两遍后使用不含EDTA胰酶消化,细胞悬液以1 000g,4 ℃离心5 min收集沉淀细胞,弃上清,1.5 mL Binding-buffer重悬,再次同条件离心,每组收集2×105个细胞加入300 μL PBS重悬。根据试剂盒说明分别加入Annexin V-FITC和PI,混匀避光,25 ℃孵育15 min,再次加入400 μL PBS上机检测各组细胞凋亡。
1.2.7Western blot检测不同蛋白表达 0.25%胰酶消化并收集各组细胞,提取总蛋白,BCA法测定各组细胞蛋白浓度制成上样蛋白。每组实验对象蛋白取20 μg上样量进行SDS-PAEG凝胶电泳,以200 mA恒流湿转1 h后至PVDF膜,室温5%脱脂奶粉封闭1 h,PBST清洗。稀释一抗β-actin、p-Akt、NF-κB-p65、cleaved-caspase-3、cleaved-caspase-9、Bcl-2、Bax(工作液浓度1 ∶1 000)、p-IκB-α、IκB-α(工作液浓度1 ∶500),4 ℃孵育过夜,PBS洗膜10 min×3次,室温二抗孵育1 h(HRP 标记羊抗小鼠/兔IgG 1 ∶2 500),PBST洗去二抗,ECL超敏化学发光试剂显色。ImageJ软件分析目的蛋白灰度值,以目的蛋白灰度值与β-actin灰度值之比表示各组目的蛋白相对表达量。
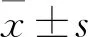
2 结果
2.1 LY294002对TFF3-TPC-1细胞形态学影响倒置显微镜下观察发现(Fig 1):过表达组和Control组细胞外形无明显差别,长势良好,均为贴壁生长的长梭形细胞,边界清晰,悬浮脱落细胞较少;经不同浓度LY294002处理48 h后的实验组细胞随着加药浓度的增加悬浮细胞和细胞碎片变多,边界不清且有融合现象,间隙变大,排列稀疏,胞核固缩,变圆且透亮细胞逐渐增多。

Fig 1 Cell morphology changes in overexpression group, control group and experimental group
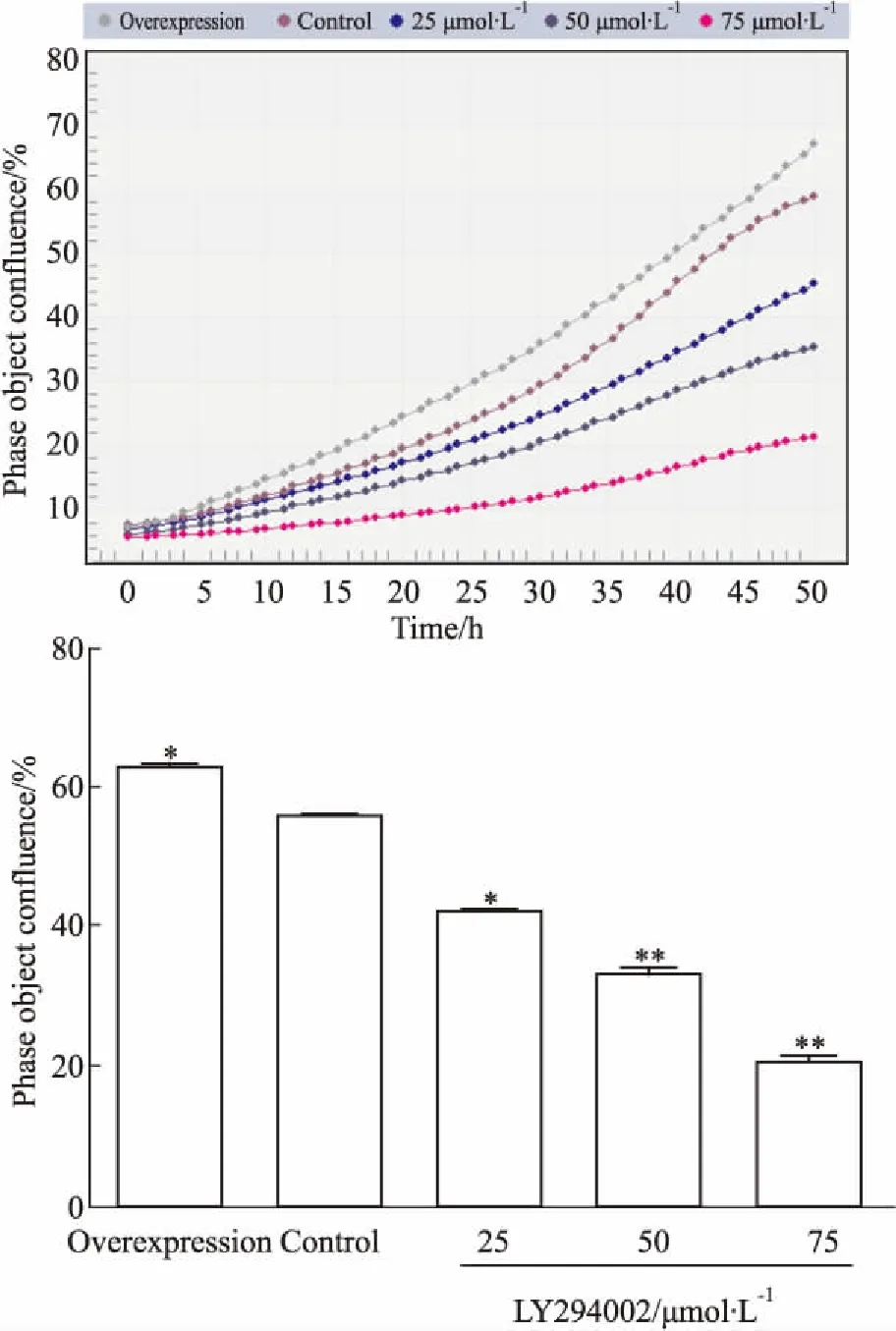
Fig 2 Cell proliferation activity
2.2 LY294002抑制TFF3-TPC-1细胞增殖活力如 Fig 2的生长曲线显示:LY294002对TFF3-TPC-1细胞抑制作用呈浓度-效应依赖性,随着LY294002浓度增加和加药的作用时间延长,TFF3-TPC-1细胞融合率逐渐降低,75 μmol·L-1组在第48 h抑制作用最强,细胞融合率明显低于Control组和过表达组。过表达组细胞在铺板48 h时后细胞融合率明显高于Control组(P<0.05);统计结果显示,在第一个24 h内各组细胞融合率差异不明显,培养至48 h后,各浓度实验组融合率明显低于Control组;过表达组高于Control组(P<0.05或P<0.01)。
2.3 LY294002抑制TFF3-TPC-1细胞侵袭性Transwell侵袭结果显示(Fig 3):过表达组,Control组,实验组(25、50、75 μmol·L-1)穿膜细胞逐渐减少;过表达组OD值明显高于Control组(0.78±0.02vs0.64±0.03),实验组(25、50、75 μmol·L-1)OD值和Control组相比逐渐降低(0.55±0.02,0.39±0.01,0.26±0.01vs0.64±0.03),差异有统计学意义(P<0.05或P<0.01)。
2.4 LY294002抑制TFF3-TPC-1细胞迁移能力划痕实验结果显示(Fig 4):过表达组细胞划痕愈合面积明显高于Control组和实验组(Tab 1),过表达组划痕愈合指数高于Control组,实验组(25、50、75 μmol·L-1)划痕愈合指数同Control组相比逐渐降低。随着LY294002加药时间延长和药物浓度增加,实验组细胞迁移距离逐渐减少,划痕愈合指数逐渐降低,差异有统计学意义(P<0.05或P<0.01)。
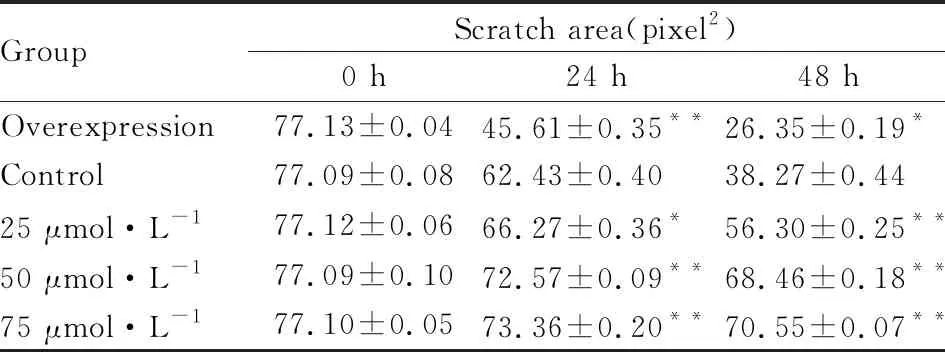
Tab 1 Comparison of healing area of cell scratches in each group
2.5 LY294002诱导TFF3-TPC-1细胞凋亡流式细胞术结果显示(Fig 5):TFF3过表达组细胞细胞凋亡水平低于Control组(0.89%±0.03vs2.4%±0.06)(P<0.05),随着LY294002加药浓度(25、50、75 μmol·L-1)增加,凋亡率呈浓度依赖性增高,不同浓度LY294002实验组细胞凋亡率均高于Control组(6.22%±0.02%,10.8%±0.02%,24%±0.072%,4%±0.06%vs2.4%±0.06%),差异有统计学意义(P<0.05或P<0.01)。
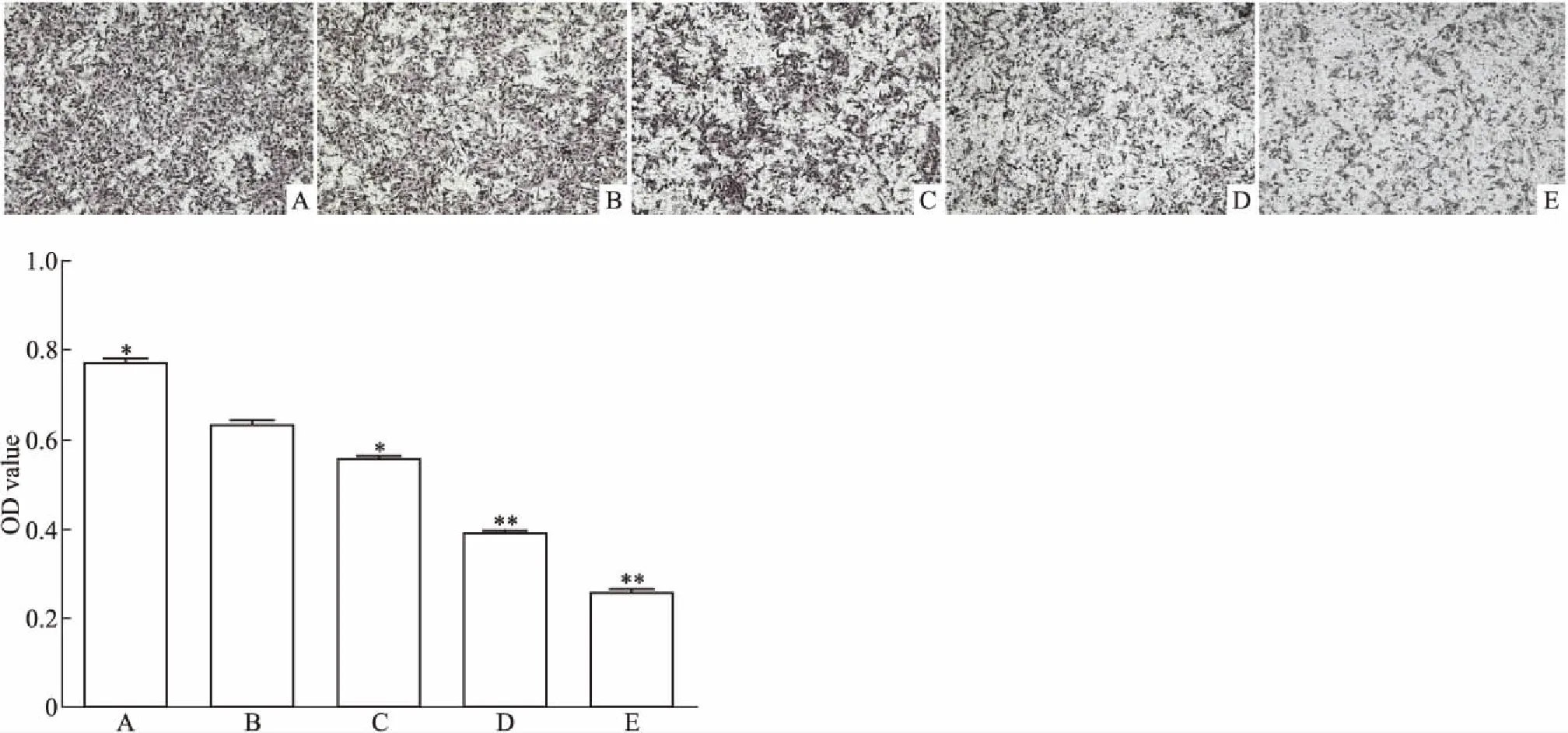
Fig 3 Cell invasion of each group by Transwell
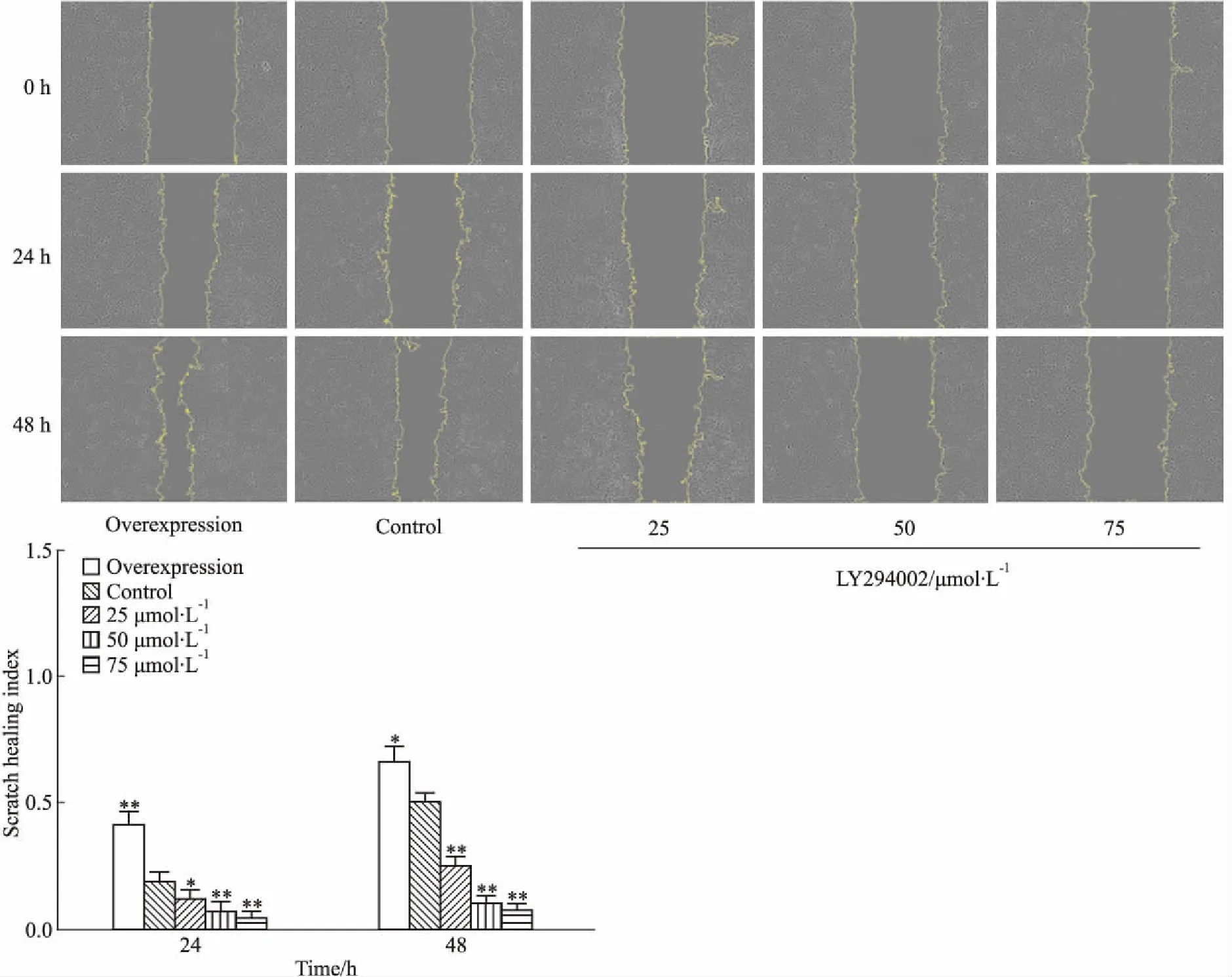
Fig 4 Detection of cell migration by scratch wound-healing vs Control
2.6 LY294002通过抑制AKT磷酸化促凋亡Western blot结果显示(Fig 6):与Control组比较,实验组细胞随着LY294002加药浓度(25、50、75 μmol·L-1)增高,PI3K/AKT通路蛋白及抗凋亡相关蛋白p-Akt、p-IκB-α、NF-κB-p65、Bcl-2表达量逐渐降低;过表达组中通路蛋白及抗凋亡蛋白表达量高于Control组(P<0.05或P<0.01),而促凋亡蛋白IκB-α、cleaved-caspase-9、cleaved-caspase-3、Bax在各浓度实验组中表达量高于Control组,过表达组中促凋亡蛋白表达则低于Control组(P<0.05或P<0.01)。
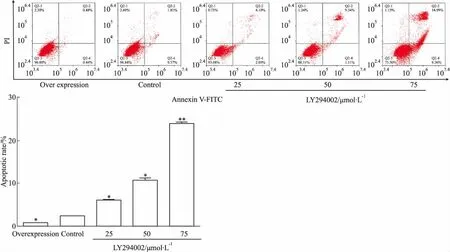
Fig 5 Detection of apoptosis rate by flow vs Control
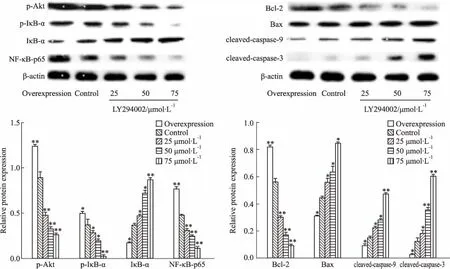
Fig 6 Expression levels of p-Akt, p-IκB-α, IκB-α, NF-κB-p65, cleaved-caspase-9,cleaved-caspase-3, Bcl-2, and Bax protein in each group of cells by Western
3 讨论
PI3K/AKT信号转导途径过度激活与人类多种癌症如前列腺癌,肝癌等发生发展关系密切。Akt通过磷酸化下游底物mTORC1、NF-κB等来调节细胞生物学行为,包括促进肿瘤细胞生长、侵袭、增殖、抑制细胞凋亡等[4]。因此,针对PI3K/AKT的特定抑制剂的开发和研究成为癌症治疗中新的热点。LY294002是一种以槲皮素为基础5羟黄酮合成化合物,通过和PI3K竞争性结合ATP位点进而抑制Akt磷酸化。LY294002可以有效抑制多种癌细胞的增殖和迁移,如LY294002能够抑制钙敏感受体激动剂GdCl3所引起的肺癌A549细胞侵袭,减少细胞迁移距离和穿滤膜细胞数量[5-7]。LY294002也可以呈剂量依赖、时间依赖性抑制PI3K/Akt/mTOR/p70S6K信号通路进而抑制食管鳞状细胞癌(ESCC)细胞增殖,通过shRNA稳定敲除mTORC2的核心亚基Rictor减弱LY294002诱导的Akt(Ser473)/ PRAS40(Thr246)的磷酸化,增强食管癌ECa109和EC9706细胞周期阻滞和细胞凋亡[8]。
本研究利用TFF3-TPC-1细胞、野生TPC-1细胞和不同浓度LY294002处理的实验组作为细胞模型,探讨PI3K/AKT特异性靶分子抑制剂LY294002对TFF3-TPC-1细胞增殖、侵袭和迁移等恶性行为的影响及机制。根据实验结果,我们观察到过表达组的TFF3-TPC-1细胞抗凋亡能力增加,细胞的增殖,侵袭,迁移等肿瘤恶性生物学行为增强。实验组中,LY294002对TFF3-TPC-1细胞增殖、侵袭、迁移具有不同程度抑制作用;且实验组细胞凋亡率随着LY294002浓度的增加而升高,具有效应-浓度依赖性。
在肝癌(HCC)中PI3K/PTEN/AKT/mTOR信号通路常被激活,p-Akt表达升高,应用PI3K抑制剂Copanlisib可以抑制细胞周期蛋白D1/CDK4/CDK6信号转导,导致细胞周期阻滞并诱导HCC细胞死亡[9]。本项研究中Western blot证实TFF3阳性的过表达组细胞Akt磷酸化水平升高以及PI3K/AKT通路蛋白p-IkB-α和NF-κB-p65和抗凋亡相关蛋白表达上调。p-Akt表达水平明显高于Control组和各浓度LY294002的实验组。Shen等[10]研究发现经转染转染CXCL8的结肠癌(LoVo)细胞上调了Akt的磷酸化进而激活了PI3K/AKT/NF-κB途径,使CXCL8阳性LoVo细胞表现出EMT样表型并具有更强的增殖,迁移和侵袭能力。Pl3K/AKT通路的激活也参与了磷酸化抑制IκB-α蛋白活化,p-IκB-α促使IκB-α从NF-κB上解离,使NF-κB自由迁移到细胞核中并激活凋亡抑制基因转录[11]。研究发现,蟾蜍灵和华蟾毒配基与索拉非尼单独或联合作用均可降低p-Akt,p-NF-κB-p65,Bcl-2蛋白表达,且联合作用明显,通过下调AKT/NF-κB信号通路, 抑制肝癌Hep G2细胞增殖[12]。本研究中,实验组细胞p-Akt表达被LY294002不同程度抑制,低表达p-Akt下调了p-IκB-α表达水平,IκB-α降解减少,总表达升高,胞质中NF-κB-p65向细胞核转运减少,随着LY294002浓度增加调控作用越明显。Ma等[13]研究发现,被LY294002处理后的HCC细胞侵袭和迁移能力下降,抗凋亡基因Bcl-2 mRNA被抑制并上调促凋亡基因Bax mRNA表达,进而诱导细胞凋亡。同样,在本实验组细胞中,低表达NF-κB-p65下调抗凋亡基因Bcl-2,而促凋亡蛋白Bax表达增加,线粒体外膜通透性升高,进而释放凋亡启动因子,高表达的cleaved-caspase-9、cleaved-caspase-3剪切为活性亚基,最终激活凋亡执行因子caspase-3。
综上所述,PI3K/AKT的特异性抑制剂LY294002可以有效抑制TFF3-TPC-1细胞增殖,侵袭,迁移并促进细胞凋亡。根据研究结果推论,LY294002有效抑制TFF3阳性甲状腺乳头状癌TPC-1细胞恶性生物学行为的机制可能与LY294002通过抑制Akt磷酸化下调PI3K/AKT通路及下游NF-κB等转录因子活性有关。
Zhang 等[14]报道,TFF3阳性肺腺癌细胞(ADC)H1299-TFF3和H1975-TFF3细胞增殖和存活能力增强且MAPK/ERK通路被激活,TFF3分子抑制剂AMPC和与MEK1/2抑制剂单独或联合应用阻断MAPK/ERK通路后TFF3阳性ADC的生物学恶性程度明显降低。本研究仅单独应用PI3K/AKT抑制剂LY294002作用TFF3阳性的TPC-1细胞,降低TFF3-TPC-1细胞的恶性生物学行为,而联合应用TFF3分子抑制剂能否更好产生协同作用还需后续验证。
(致谢:本研究在河北北方学院人体形态学实验完成,感谢附属医院及实验课题组老师和同学们的指导与帮助!)

