HIP-55介导胞内信号转导的分子机制研究
陈星卉,韩 峰,卢应梅
(1. 南京医科大学药学院,心脑血管病重点实验室,江苏 南京 211166; 2. 浙江大学城市学院,医学院,浙江 杭州 310015;3.南京医科大学基础医学院,生理系,江苏 南京 211166)
MAP4K1(又名HPK1) 作为MAP4K家族的成员,是一种哺乳动物Ste20相关的丝氨酸/苏氨酸激酶。它能通过MAP3K转导信号至MAP2K,从而激活c- Jun N末端激酶(c-JunN-terminal kinase,JNK)。因此,HPK1蛋白能够将胞外信号从质膜传递到细胞核从而调控在哺乳动物细胞的增殖、分化或应激调节等生命功能。HIP-55 (HPK1-interacting protein of 55 ku) 作为与HPK1蛋白相结合的一种接头蛋白能够增加MAP4K1和JNK的激酶活性。此外,由于HIP-55具有多蛋白结合结构域,因而主要承担信号转导的功能。目前关于HIP-55主要围绕调节细胞增殖与凋亡、心血管调控、免疫调节与中枢神经调控。本文将以HIP-55蛋白的生物学功能为基础,重点介绍其胞内的信号转导通路和该信号参与的病理生理过程调控,为其在信号转导关联的临床疾病研究奠定理论基础。
1 HIP-55蛋白结构及生物学功能研究
1.1 HIP-55蛋白分布与表达HIP-55是一种含有多种结构域的接头蛋白,是在1996年由Sparks等[1]首次从含有SH3结构域的蛋白中纯化而得,能够与骨架蛋白F-actin、HPK1相结合的一种新型接头蛋白,N端与肌动蛋白F-actin相结合的结构域和C端的SH3结构域[2](Fig 1)。HIP-55通过SH3结构域与Synapsin 1、dynamin 1、synaptojanin 1[3]和Fgd1[4]蛋白相结合,在小鼠胚胎时期HIP-55蛋白表达量呈先升后降的趋势[2]。2006年,Connert等[5]首次应用HIP-55敲除老鼠证实其主要表达于脑、胸腺、脾脏、心脏和肺中。然而,综合数据库资料显示,HIP-55虽普遍存在于人体组织器官,但是在卵巢和肌肉中表达量很少或无表达。细胞水平上表明,HIP-55定位于细胞骨架与细胞膜上。2009年,Goroncy等[6]首次对HIP-55的晶体结构进行解析,并证实ADF-H结构域为长螺旋结构 (Fig 2)。
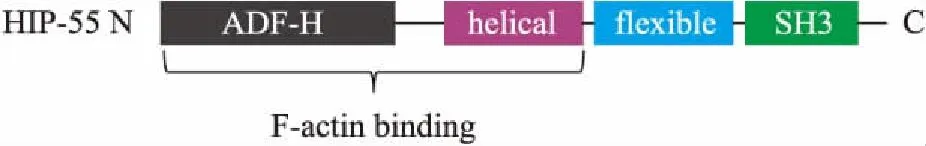
Fig 1 Schematics of domain structure of HIP-55 proteins
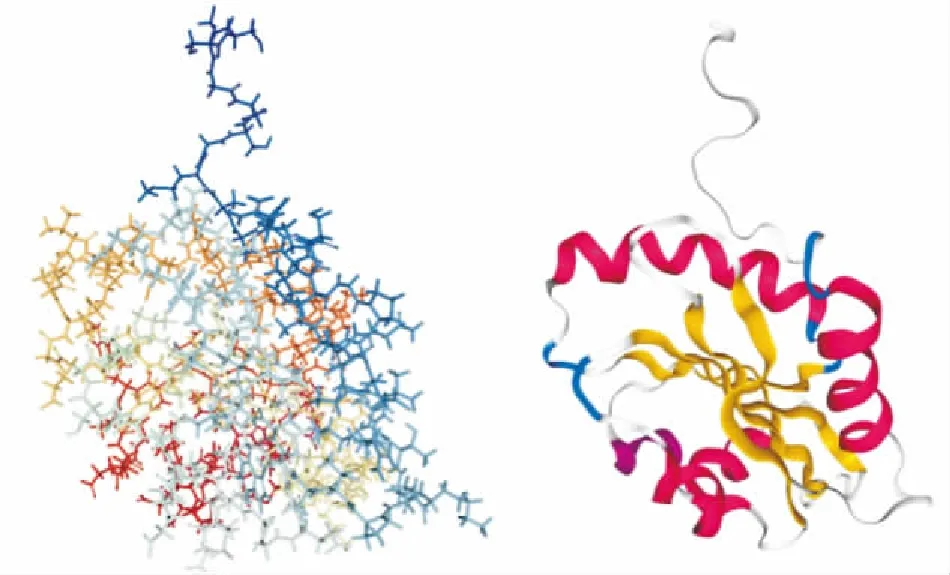
Fig 2 Schematic diagram of HIP-55 protein crystal structure
1.2 HIP-55生物学功能HIP-55蛋白分布广泛,体内众多细胞均可表达,因此所行使的生物学功能也多种多样。已有文献表明HIP-55能够抑制心脏成纤维细胞的增殖分化且下调心脏收缩力,调控心血管功能[7]。HIP-55对免疫系统也具有调控作用,已有文献报道HIP-55调控白细胞粘附能力[8]和吞噬能力[9]。在高速流动血液的条件下,HIP-55对于多型核中性粒细胞(PMN) 从管内外渗及扩散也是至关重要的。此外,HIP-55能够激活T细胞[10]和B细胞[11]:HIP-55能够激活T细胞和B细胞的增殖分化能力、细胞因子产生能力、激活能力,还可以促进T细胞形成免疫突触(immunological synapse,IS) 有利于与抗原递呈细胞 (antigen-presenting cells,APCs) 相结合,达到激活T细胞的目的[11]。在中枢神经系统中,HIP-55参与到网格蛋白所介导的内吞(clathrin-mediated endocytosis,CME) 过程中[3,12],保持突触前膜活动与功能完整性[13],调控神经元形态[14-15]。Connert等[5]于2006年首次在全敲HIP-55老鼠中发现存在神经系统障碍且神经元突触的递质循环受到损伤。
2 HIP-55信号参与生理过程调控的分子机制研究
2.1 HIP-55的磷酸化修饰HIP-55作为酪氨酸激酶的反应底物可以通过Syk、Lyn和Blk磷酸化,从而将信号传导至构成细胞骨架的蛋白中[9]。Liu等[16]应用质谱联用磷酸肽富集技术(mass spectrometry combined with phosphopeptide enrichment technique) 系统鉴定哺乳动物细胞中HIP-55蛋白的磷酸化位点。该研究成果为进一步研究不同亚型的HIP-55磷酸化提供了依据,也为进一步研究其在该蛋白参与的信号转导在生理与病理状态下的生物学功能提供了参考。
2.2 HIP-55参与调控细胞增殖等生命活动许多蛋白参与细胞内信号转导从而调控细胞凋亡、增殖、影响细胞周期等生理和生化过程,已有文章报道胞外信号可通过G蛋白偶联受体TGR5将AKT蛋白激酶B磷酸化,从而影响细胞的生命活动[17]。同样HIP-55作为一种接头蛋白也能够参与到多种信号转导过程中,调控多条胞内信号通路[2,13]。HIP-55通过胞内信号转导参与到细胞增殖分化、迁移侵袭及凋亡等生命活动中。蛋白磷酸化是一类常见的翻译后修饰,在许多细胞生命功能中起重要作用[18-20]。由于HIP-55是酪氨酸激酶的反应底物,HIP-55通过在其酪氨酸位点337和347上磷酸化可以参与不同生理功能的调控:能够促进细胞足小体(podosome rosette) 的形成进而参与到成纤维细胞转化过程中[21];促进胚胎期的神经元由脑室区(ventricular zone,VZ) 或脑室下区(subventricular zone,SVZ) 产生并逐渐向大脑皮层多极迁移[22];HIP-55丝氨酸位点269磷酸化能够调控FHL2/HIP-55复合体的活性,进而调控肿瘤细胞的增殖和侵袭[23]。此外,HIP-55还可以通过GTPase参与细胞的生命活动的调控中 (Fig 3):HIP-55通过抑制RhoA家族信号通路转导,与能够上调细胞侵袭和RhoA的蛋白FHL2通过N端ADF-H结构域相结合,激活Rho GTPase信号通路协同调控细胞侵袭过程[23]。当细胞受到趋化迁移刺激时,HIP-55通过Rac1蛋白激活诱导F-actin肌动蛋白重排[2],并且可以使HIP-55快速富集到片状伪足。在趋化因子刺激时Arp2/3与HIP-55共定位形成动力区域参与到F-actin细胞骨架重排引起片状伪足的形成[24]。另一方面,HIP-55与GTPase Dynamin相互作用也可以参与到细胞内吞及膜转运过程[3]。HIP-55作为肌动蛋白结合蛋白,能够被凋亡状态细胞的Caspase裂解从而引起细胞骨架和形态的改变参与细胞凋亡过程中。
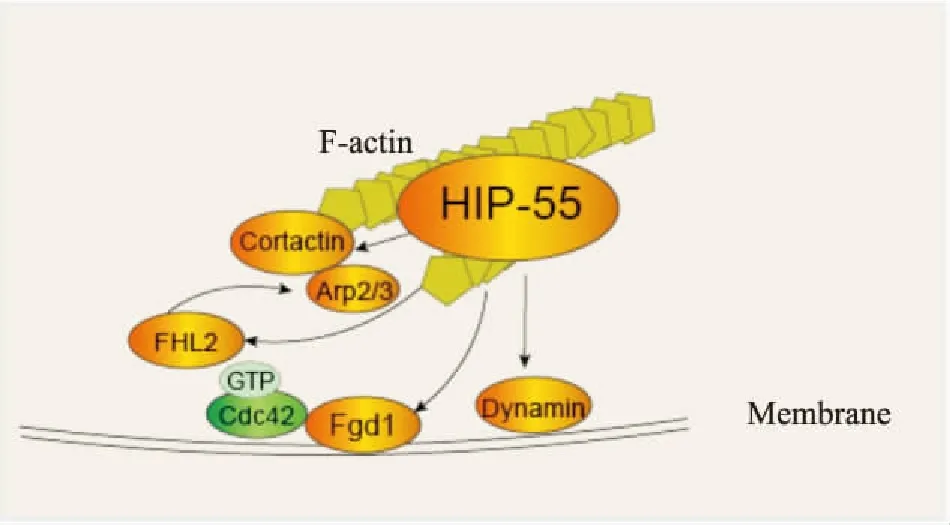
Fig 3 Participation of HIP-55 in regulation of cell activities through GTPase
2.3 HIP-55参与免疫系统调控HIP-55作为HPK1/JNK信号通路的上游激活蛋白,可以和HPK1结合抑制由T细胞受体(TCR) 激活诱导产生的细胞因子上调。当TCR激活后发现JNK和HPK1活性降低,并且在HIP-55敲除的T细胞中发现TCR激活功能发生损伤,p38蛋白的磷酸化也相应下调[16]。同时TCR激活后,HIP-55能够与HPK1结合并将其复合体转运至T细胞与抗原递呈细胞(APC) 接触位置[25],证明TCR激活过程中需要HIP-55调控的HPK1/JNK信号通路参与(Fig 4)。对于B细胞受体(BCR),HIP-55同样通过招募B细胞抑制性因子HPK1到达BCR上从而削弱B细胞活性[11]。白细胞从血液流向发炎组织的迁移粘附能力受到整合素调控,是免疫应答产生的关键,而β2整合素(CD11/CD18) 的激活对于白细胞从高速流动的血液中捕获到粘附在血管内壁是至关重要的。2009年,Barbara Walzog实验室利用全敲HIP-55老鼠发现在全敲老鼠体内的HIP-55缺失引起β2整合素(CD11/CD18) 数量下调[8],提示HIP-55作为接头蛋白可参与由β2整合素调控的免疫细胞的粘附作用影响白细胞生命活动。该研究团队进一步发现HIP-55通过肌动蛋白的调控参与到β2整合素介导的白细胞吞噬过程中[9]。
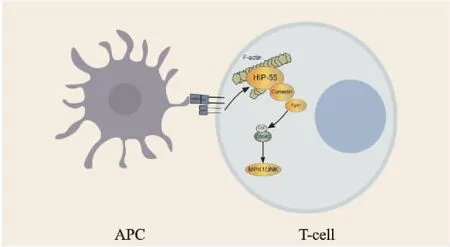
Fig 4 T cell activation regulated by Hip -55 through HPK1/JNK signaling pathway
2.4 HIP-55与神经突触功能调控在中枢神经系统中,神经信号传递由突触囊泡释放神经递质开始,之后突触前膜回收已释放神经递质的突触囊泡以维持整体突触的结构及功能完整性。已有研究表明HIP-55可以调控神经递质囊泡回收过程,其机制是HIP-55的SH3结构域与GTPase Dynamin的结合参与由网格蛋白包被囊泡及网格蛋白所介导的内吞(clathrin-mediated endocytosis,CME)过程[3,12]。另一方面,突触前活性区的重要组成蛋白Piccolo能够和HIP-55结合参与神经递质在突触前活动区邻近位置的内吞过程,支持突触前的活动与功能完整性[13]。此外,肌动蛋白对于神经元的骨架重排非常重要,HIP-55作为与肌动蛋白相结合的接头蛋白,可以通过RhoA家族蛋白Cdc42调节细胞骨架重排调节生长锥(Growth Cone)[4]。具体机制为:Fgd1直接与Cortactin和HIP-55在细胞骨架上结合,通过特异性激活Cdc42进一步上调N-WASP和Arp2/3复合体活性,促使伪足的形成 (Fig 5)。在早期发育的神经元中敲低HIP-55能够正向调控轴突长度[24]和树突棘长度[14],然而SH3结构域过表达后下调树突棘及蘑菇型树突棘的密度[14]。另有报道证实HIP-55能够与抑制小脑浦肯野细胞分化的Cobl蛋白结合,协同下调细胞树突分枝点数量及树突分支密度[15]。
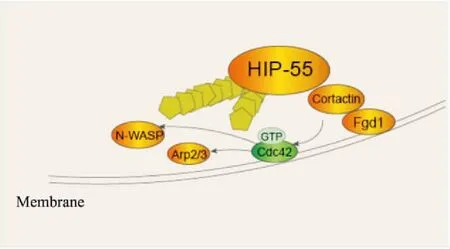
Fig 5 Cytoskeleton arrangement regulated by HIP-55
3 HIP-55信号参与病理过程调控的分子机制研究
3.1 HIP-55参与肿瘤细胞凋亡过程HIP-55可以通过HPK1/JNK通路促进肿瘤细胞增殖[23],当过表达HIP-55能够降低HPK1的活性激活肿瘤分化能力[23,26]。另一条促进肿瘤细胞增殖存活的机制是HIP-55通过AKT激酶的调控与14-3-3形成稳定的复合物[27],从而下调肿瘤细胞凋亡能力。此外,通过对已发表数据库进行筛选,发现HIP-55在宫颈癌和胰腺癌患者中高度表达[28],揭示HIP-55可能作为一种潜在的检测肿瘤细胞的指标蛋白。在癌症患者中,HIP-55在十二种肿瘤组织中均有上调,这些数据提示当HIP-55过表达诱发肿瘤细胞的生成。此外,Yang等[26]利用HIP-55敲低的A549肺癌细胞系,用微阵列法分析证实HIP-55参与肿瘤细胞的存活,下调由依托泊苷(etoposide) 引起的肿瘤细胞凋亡过程。
3.2 HIP-55与心力衰竭相关的心肌功能调控心力衰竭往往导致心肌组织重构,而心肌纤维化是心肌组织重构过程中的关键步骤。β-肾上腺素能受体 (β-adrenergic receptors,β-ARs) 能够引起心肌纤维化, ERK1/2 MAPK信号通路是β-ARs介导心脏成纤维细胞增殖的重要途径,当在心脏成纤维细胞中过表达HIP-55之后,由β-肾上腺素能受体激动剂异丙肾上腺素(ISO) 诱导的ERK1/2磷酸化程度下调。且在成纤维细胞中当HIP-55过表达时能抑制p38磷酸化和激酶活性,进一步揭示HIP-55通过下调p38 MAPK通路抑制ISO引起的成纤维细胞增殖[29]。此外,心肌收缩力对保持正常血流输出量和心脏正常功能至关重要,当HIP-55敲低时能够激活心脏收缩力,其机制是HIP-55通过肌动蛋白结合对心脏收缩力进行调控。
4 总结与展望
目前关于HIP- 55的研究主要从其蛋白结构特性入手,针对其能够与多种蛋白相互作用并且参与多种信号转导(Tab 1),从而发现信号转导异常所引起的病理现象。越来越多的研究表明,HIP-55对免疫应答、心血管系统调控、细胞的增殖与凋亡以及神经功能调节等方面起着重要作用,具有广泛的生物学效应。由于在肿瘤患者的组织中检测到高表达的HIP-55,因此可以作为一种潜在的检测肿瘤细胞增殖的指标蛋白。然而,关于HIP-55的亚细胞定位、动物整体水平HIP-55的缺失导致的发育功能障碍以及器官形态变化的机制尚未揭示,并且对于HIP-55突变或者其信号转导异常关联的临床疾病相关资料报道尚少。因此,随着对HIP-55及其介导的信号通路深入研究,有助于深入理解细胞骨架运动和细胞凋亡过程等调控机制。鉴于HIP-55是一种由受体介导的接头蛋白,开发HIP-55作为一种新型药物靶标以及对其参与的信号转导途径的转化医学研究更具意义。

Tab 1 HIP-55 interacting proteins in mammals

