基于PKD1/HDAC7轴研究丹参酚酸B对大鼠缺血心肌组织的保护作用
刘 暖,杨 雷,刘 萍
(南阳理工学院河南省张仲景方药与免疫调节重点实验室,河南 南阳 473004)
心肌梗死(myocardial infarction,MI)等缺血性疾病会引发大量心肌细胞死亡,导致患者左心室不良重构、心功能受损、生活质量低下[1]。丹参为治疗MI等缺血性心肌疾病的经典中药材之一,丹参酚酸B(salvianolic acid B,SAB)属于水溶性酚酸类化合物,为丹参的代表性单体成分[2]。课题组前期的实验研究证实,蛋白激酶D1(protein kinase D1,PKD1)具有促进血管新生的作用[3-4],并且可以下调MI后心肌胶原蛋白的表达,进而逆转MI后的心室重塑,保护缺血受损的心肌[5]。PKD1在体内发挥上述对缺血心肌的部分保护效应需要依赖和IIa类组蛋白去乙酰化酶7(group IIa histone deacetylase 7,HDAC7)的结合,形成PKD1/HDAC7轴才能够完成[6]。CID755673为PKD1的特异性阻断剂。本研究拟分析MI大鼠SAB给药及应用阻断剂14 d后心肌组织的形态学变化及PKD1和HDAC7蛋白的表达,阐述SAB是否通过调控PKD1/HDAC7轴保护缺血受损的心肌组织。
1 材料
1.1 实验动物40只Wistar大鼠,SPF级,♂,8周龄,体质量(200±20)g,购自北京维通利华公司,动物生产许可证号:SCXK(京)2016-0011;动物质量合格证号:11400700315978。
1.2 药物与试剂SAB(上海陶素公司,批号:115939-25-8),CID755673(简称CID,美国MCE公司,批号:2018276);TUNEL染色试剂盒(上海翊圣公司,批号:40308ES20);PKD1(上海圣克鲁斯公司,批号:Sc-1796)、HDAC7(武汉三鹰生物公司,批号:DF6435)的一抗抗体;Cy3荧光标记的羊抗兔IgG二抗(武汉博士德公司,批号:BA1032);其它试剂为国产分析纯。
1.3 主要仪器LSM 800激光共聚焦显微镜和ZEN 2.3 lite分析软件(德国蔡司公司);CUT6062病理切片机和MTMI全密闭自动脱水机(德国赛利公司)。
2 方法
2.1 动物造模大鼠随机分为假手术组(Sham)、心梗模型组(MI)、SAB给药组(SAB)和CID阻断剂组(CID)。结扎左冠状动脉前降支复制MI模型,Sham组不进行结扎操作,其他手术程序和MI组保持一致。14 d实验周期中,大鼠均腹腔注射给药,具体给药剂量为:SAB组:50 mg·kg-1·d-1,CID组:50 mg·kg-1·d-1SAB+40 μg·kg-1·d-1CID,Sham和MI组:等量生理盐水。14 d后,处死大鼠,进行检测分析。
2.2 HE染色将处死后大鼠的心脏剪取左心室,含室间隔部分,参照之前的方法[3],制成纤薄的组织切片,HE染色,厚度4 μm,置入普通显微镜的40×物镜镜头下观察。
2.3 Masson染色组织取材同HE染色。参照之前的方法[3],制成Masson染色切片。染色后,以胶原纤维为主的肉芽和瘢痕组织示蓝绿色,心肌组织示红色。胶原纤维区域大小用ZEN 2.3 lite软件进行分析,其占左心室的比例用胶原容积分数(collagen volume fraction,CVF)值确定。
2.4 TUNEL染色组织取材同HE染色,按照试剂盒说明,石蜡切片,根据TUNEL染色操作步骤,并滴加DAPI复染,置入避光暗室中5 min,PBST清洗3次×1 min,封片。置入LSM 800激光共聚焦显微镜的40×物镜镜头下观察,计数染色阳性的细胞数/视野,取5个不重复视野/切片。
2.5 免疫组化(immunohistochemistry, IHC)组织取材同HE染色。参照之前的方法[3],将组织祛除干扰杂质后结合PKD1(1 ∶500稀释)或HDAC7(1 ∶200)一抗,4 ℃冰箱中放置12 h,重复PBS冲洗3次×3 min,羊抗兔IgG二抗(1 ∶1 000)标记室温15 min,DAB染色3 min。置入普通显微镜的40×物镜镜头下,计数5个不重复视野染色阳性的细胞数的平均值。
2.6 免疫荧光(immunofluorescence, IF)组织取材同HE染色,切片脱蜡后微波处理15 min,PBS冲洗3次×3 min后兔血清封闭切片,加入一抗抗体PKD1(1 ∶50)或HDAC7(1 ∶50),4 ℃孵育过夜。d 2取出,PBST冲洗3次×3 min,和Cy3标记的荧光二抗共孵育1 h,滴加DAPI复染,封片。LSM 800激光共聚焦显微镜的40×物镜镜头下观察,ZEN 2.3 lite分析软件计算红蓝荧光比值。
2.7 免疫印迹(Western blot, WB)用RIPA裂解缓冲液(添加蛋白酶抑制剂)浸泡冰箱中冻存的左心室心肌组织,制成组织匀浆后,离心分离提取总蛋白,BCA法确定总蛋白量。每份标本取40 μg蛋白行凝胶电泳,转膜、封闭,孵育PKD1(1 ∶500)或HDAC7(1 ∶100)的一抗抗体,PBS冲洗3次×3 min后和羊抗兔二抗(1 ∶1 000)共孵育,持续2 h,Odyssey扫描仪扫描蛋白条带。α-View SA软件计算样本蛋白/GAPDH参照蛋白的值。
3 结果
3.1 SAB对MI大鼠组织形态学的影响由Fig 1可见,相比Sham组大鼠完整的心肌细胞和组织结构,MI组大鼠心肌组织完整性受到严重破坏,以肉芽和瘢痕组织为主,间杂以残存的肥大心肌细胞;SAB治疗组大鼠完整的心肌和细胞较Sham组增多,少见肉芽和瘢痕组织;CID阻断剂组大鼠心肌组织和细胞结构和MI组相似。这表明SAB可改善心梗后受损的心肌组织形态学。

Fig 1 Effect of PKD1 on histomorphology of MI rats (HE×400)
3.2 SAB对MI大鼠心肌纤维化的影响由Fig 2可见,Sham组大鼠心肌成分也有少量胶原纤维,呈网状分布,以红色心肌纤维为主; MI组大鼠蓝色纤维,胶原占比较Sham组升高(P<0.01);SAB组大鼠心肌组织结构和Sham组接近,以红色心肌组织为主,和MI组相比,胶原占比下降(P<0.01);CID组大鼠心肌组织结构和MI组接近,主要是肉芽和瘢痕组织,和SAB组相比,胶原占比升高(P<0.01)。这表明SAB可减少心梗后受损心肌组织的胶原占比。
3.3 SAB对MI大鼠心肌细胞凋亡的影响由Fig 3可见,Sham组大鼠心肌组织几乎全部呈蓝色荧光(示正常心肌细胞);MI组大鼠心肌组织中蓝色和红色荧光(示凋亡细胞)混合呈现,细胞凋亡计数较Sham组增加(P<0.01);SAB组大鼠心肌组织中主要呈现蓝色荧光,间杂少量红色荧光,细胞凋亡计数较MI组减少(P<0.01);CID组大鼠心肌组织中蓝色和红色荧光混合呈现,接近于MI组大鼠,细胞凋亡计数较SAB组增多(P<0.01)。这表明SAB可抑制因心梗后心肌组织受损导致的细胞凋亡。
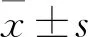
3.4 SAB对MI大鼠心肌组织中PKD1和HDAC7蛋白表达的影响分别应用IHC染色(阳性表达蛋白示棕黄色)、IF染色(阳性表达蛋白示红色荧光)和WB染色(阳性表达蛋白示灰黑色)检测心肌组织中PKD1和HDAC7的蛋白表达。由Fig 4~7可见,三种检测结果呈现一致的趋势,均表明:Sham组大鼠的PKD1基础表达量较高,HDAC7基础表达量很低;与Sham组相比,MI组大鼠PKD1表达明显降低(P<0.01),而HDAC7表达和Sham组基本一致;与MI组相比,应用了SAB后,PKD1和HDAC7的表达明显升高(P<0.01),也高于Sham组(P<0.01);CID组和MI组基本一致,PKD1和HDAC7表达阳性的细胞数量均较SAB组明显减少(P<0.01)。这表明SAB可上调心梗后心肌组织内PKD1和HDAC7的表达。

Fig 2 Effect of SAB on myocardial fibrosis in MI rats n=10)

Fig 3 Effect of SAB on cardiomyocyte apoptosis in MI rats n=10)
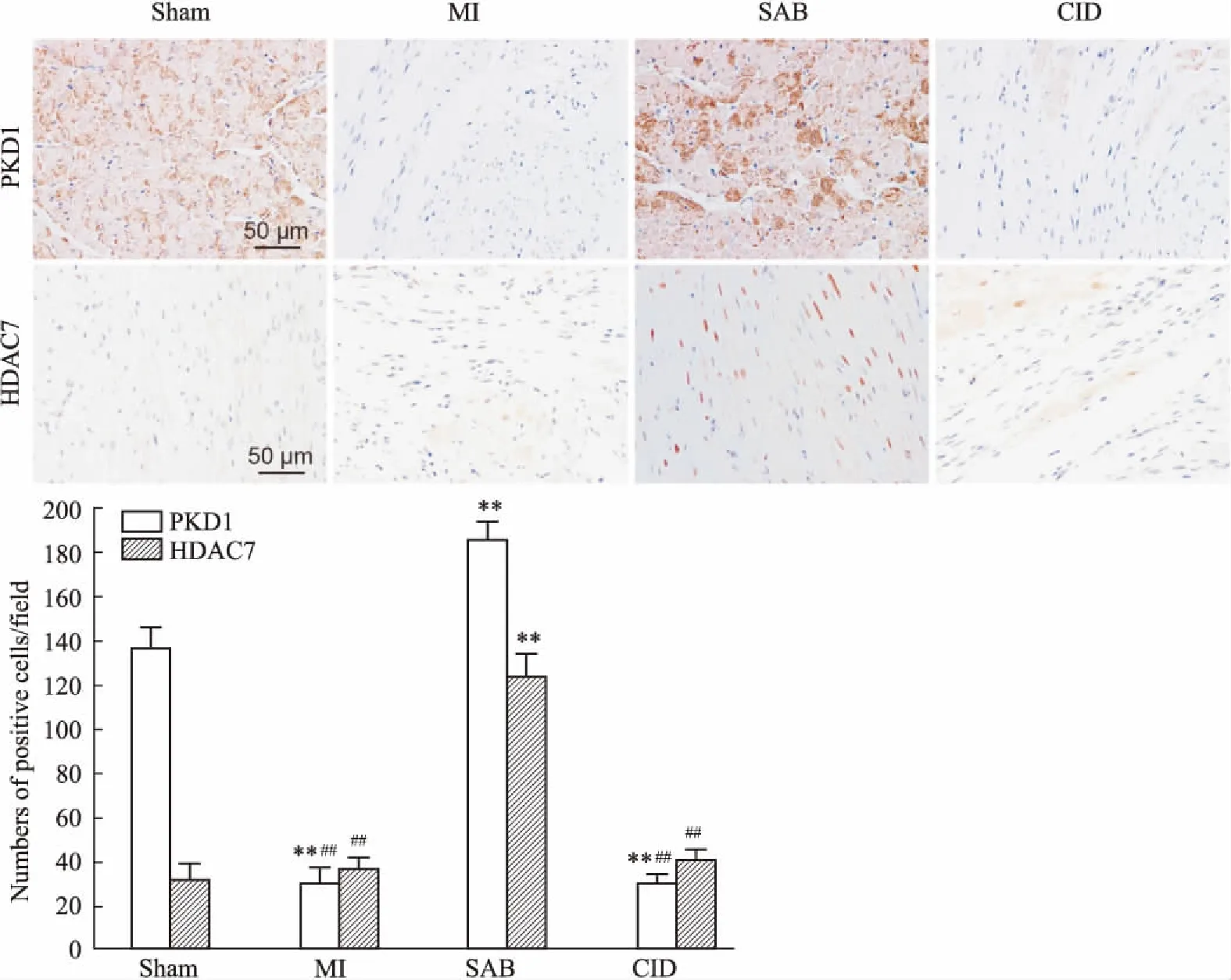
Fig 4 Effect of SAB on PKD1 and HDAC7 protein expression in myocardium of MI rats
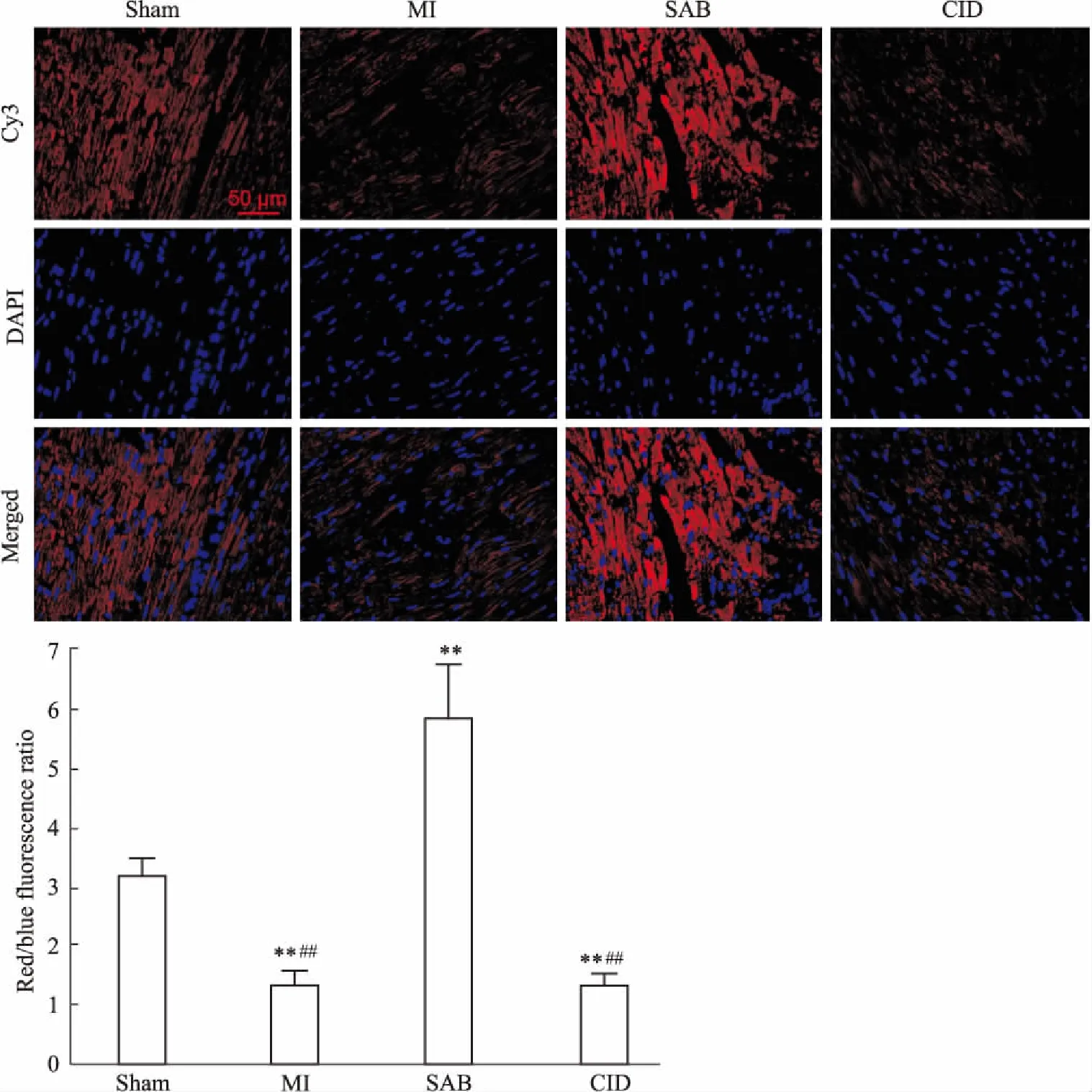
Fig 5 Effect of SAB on PKD1 protein expression in myocardium of MI rats (IF)

Fig 6 Effect of SAB on HDAC7 protein expression in myocardium of MI rats (IF)
Fig 7 Effect of SAB on PKD1 and HDAC7 protein expression in myocardium of MI rats (WB) n=10)
4 讨论
本研究大鼠组织形态学变化表明,MI组大鼠心肌梗死后缺血坏死的组织由肉芽组织或者瘢痕组织替代,后两种组织的主要成分为胶原纤维,所以MI组大鼠CVF占比较高;并且心肌缺血受损后除了心肌细胞坏死外,还伴发着病理性凋亡,这也解释了本研究MI组出现红色荧光的细胞数明显增多的原因。无论是坏死还是凋亡,心肌细胞的总量最终都会减少,又无法通过新的再生细胞的补充,剩余的功能细胞负荷加重,心肌细胞需要肥大来适应这一病理学进程,这是HE染色图片中出现部分肥大细胞的原因,和文献报道[7]的MI后残存的心肌组织中有30%的心肌细胞出现肥大相一致。心肌细胞坏死、凋亡和病理性肥厚,如果不能采取有效的干预措施,将会出现心功能衰竭的严重后果[5, 8]。SAB给药干预14 d后,大鼠心肌组织恢复较好,肉芽或者瘢痕组织明显减少,CVF占比和凋亡细胞数量急剧下降,但这一药理学作用可以被CID所阻断。这表明,SAB可以保护MI后大鼠缺血损伤的心肌组织,而CID可以抑制SAB的保护作用。
PKD1和HDAC7的蛋白表达分别应用IHC染色、IF染色和WB染色三种不同方法进行检测分析,检测结果保持一致。正常的心肌组织中存在一定量的PKD1表达,但HDAC7的表达量很低。PKD1较高的基础表达量可能与PKD1本身的生物学功能和生理学效应比较广泛,表达位点较多相关[9],HDAC7的基础表达量过低,可能是其正常情况下处于非活化状态,需要PKD1激活并迁移至细胞核中,才能和其发生生物学偶合后磷酸化激活而发挥生物学效应[9]。MI后受损心肌组织中的PKD1较Sham组减少明显,这也和心梗心肌的功能部分丧失密切相关;HDAC7的表达和Sham组接近,表明损伤并不诱发HDAC7的表达上调。
SAB用药后,PKD1和HDAC7的表达均明显上调,并且伴随着缺血心肌组织受损的明显减轻。之前的研究证实[5],PKD1用药可以改善MI大鼠心肌组织的血流动力学参数,抑制胶原调控关联蛋白,对抗心肌纤维化,减轻细胞凋亡,并能够对抗缺血心肌组织中的产生的过度炎症反应而保护心肌组织[8]。同时,PKD1是参与促血管新生的重要调控蛋白之一,可以直接上调VEGF的表达,促进毛细血管的新生,增加缺血心肌的微循环血供[6, 9-10]。VEGF反过来也可以通过VEGFR2-PKC信号通路激活PKD1,介导内皮细胞(endothelial cells,ECs)的增殖、迁移和管腔形成[9-10]。PKD1还具有介导内皮祖细胞(endothelial progenitor cells,EPCs)[4]和间充质干细胞(mesenchyma stem cell,MSCs)[11]增殖、迁移和管腔形成的作用,而EPCs和MSCs是诱导内源性血管生成的重要的细胞来源。HDAC7是PKD1的底物之一,可被VEGF介导的PKD1信号转导刺激磷酸化激活后,由细胞核向细胞质迁移集聚,促进ECs的迁移、增殖和微血管的出芽新生[9, 12]。结合以上文献报道和本研究结果表明,SAB可能通过调控PKD1/HDAC7轴在促缺血心肌组织血管新生,增加缺血心肌微循环血供,保护受损心肌中发挥着关键的作用。
本研究还发现,应用PKD1的特异性阻断剂CID后,PKD1/HDAC7的表达明显下调。这进一步表明,SAB很可能通过调控PKD1/HDAC7轴而保护缺血受损的心肌组织。

