基于羧基载体LX-1000IDA的脂肪酶固定化研究
朱 衡,张继福,张 云,胡云峰*
(1. 中国科学院南海海洋研究所,广东 广州 510301; 2. 中国科学院热带海洋生物资源与生态重点实验室(中国科学院南海海洋研究所),广东 广州 510301;3. 南方海洋科学与工程广东省实验室(广州),广东 广州 511458; 4. 中国科学院大学,北京 100049; 5. 广东省中医院,广东 广州 510120)

目前最适合的解决办法就是将脂肪酶固定化,使用的固定化方法包括包埋法[16]、吸附法、共价结合法和交联法等[17]。另外,联合固定化方法也在研究中表现优异。如:钱明华等[18]用大孔树脂 HPD750为载体,以聚乙二醇二缩水甘油醚为交联剂,得到的固定化酶使用10次,仍保留34.86%的酶活,4 ℃保存30 d后保留64.81%酶活;林海蛟等[19]利用硅藻土和乙二醇缩水甘油醚进行吸附-交联固定化海洋脂肪酶,连续操作5次后依然保留47%的酶活性;徐珊[20]利用包埋-交联法固定化海洋脂肪酶,在重复使用7次后保持60%左右酶活;杨秀芳等[21]利用壳聚糖为载体,采用包埋-交联法固定β-呋喃果糖苷酶,得到酶活较好的固定化酶。目前,带有氨基、羧基、羟基等修饰基团的合成树脂在固定化酶制备中表现优异。如:徐珊等[22]利用国产环氧树脂LXEP-120固定化猪胰脂肪酶,优化后的固定化酶使用10次仍保留70%的酶活;朱衡等[23]使用氨基载体结合双功能试剂戊二醛固定化海洋脂肪酶,得到的固定化酶最适反应温度较游离酶提高了10 ℃,使用6次后保留40%酶活。
共价结合法联合交联法[24]所获得的固定化酶具有稳定性高、不易脱落和机械强度大等优势,相比于包埋法和吸附法,在实际生产应用中更具工业价值。与戊二醛和环氧试剂等交联剂不同,碳二亚胺EDC (C8H17N3,1-(3-二甲氨基丙基)-3-乙基碳二亚胺)本身作为一种蛋白质和核酸的交联剂,可实现快速的多肽缩合反应,EDC分子呈现线性结构,可用于羧基和伯胺的缩合反应。羧基载体LX-1000IDA是一种羧基功能化的无机载体,具有高孔容和比表面积,而且载酶量大、固定化酶活性高、颗粒均匀和机械强度高。本文使用交联剂EDC和羧基载体进行海洋脂肪酶的固定化研究,反应过程如图1。为优化固定化条件,利用单因素实验、Plackett Burman试验、正交试验优化得到最佳固定化条件。考虑到实际制备环境和条件,进行了模拟扩大固定化实验。对制备的固定化酶酶学性质鉴定表明,本文所制备的固定化酶表现优异。

图1 固定化脂肪酶IDA-LIPASE制备原理示意Fig. 1 Preparation principle of immobilization of lipase IDA-LIPASE
1 实验试剂、仪器与方法
1.1 实验试剂
LX-1000IDA购于西安蓝晓科技新材料股份有限公司;EDC (C8H17N3,CAS:25952-53-8)购于上海麦克林试剂公司;海洋假丝酵母脂肪酶(CAS: 9001-62-1)购于上海鼓臣生物技术有限公司;磷酸氢二钠、磷酸二氢钠购于Generay Biotech。
橄榄油购于上海麦克林试剂公司;聚乙烯醇购于天津大茂化学试剂厂,利用实验用水配置质量分数4%的聚乙烯醇溶液,聚乙烯醇-橄榄油(体积比3∶1),混合后超声,超声功率40%,开2 s,关1 s,超声5 min,摇匀后再次超声5 min,4 ℃冰箱备用;浓盐酸购于广东白云区良田光明化工厂;无水乙醇购于广东光华科技股份有限公司;异辛烷购于天津大茂化学试剂厂;无水醋酸铜、吡啶购于上海麦克林试剂公司。
1.2 实验仪器
发酵摇床(上海实维仪器);高速离心机(Beckman);酶标仪(Tecan);超声破碎仪(新芝生物科技);低温冰箱(中科美菱);电热烘箱(一恒科学仪器);恒温水浴锅(一恒科学仪器);涡旋振荡仪(Tomos);pH计(Sartorius)。
1.3 实验方法
1.3.1 脂肪酸浓度测定
以油酸为标准物,配制不同浓度的油酸溶液,用醋酸铜显色,测定铜皂的吸光度,以吸光度对油酸浓度绘制标准曲线:
y=0.006 2x-0.005 5,R2=0.999 8。
1.3.2 酶活性测定
以乳化橄榄油为底物反应15 min,加入无水乙醇和盐酸终止酶反应,并使底物乳液破乳,用异辛烷萃取生成的脂肪酸,并用醋酸铜显色,通过测定铜皂的吸光度得到生成脂肪酸的量,计算出脂肪酶的活力。
酶活力定义:一定条件下,在1 min内催化底物生成1 μmol脂肪酸所需要的酶量。
游离酶溶液的酶活力计算公式为
U游=cV异/(Vt),
式中:c为脂肪酸的浓度,mmol/L;V异为异辛烷萃取溶液的体积,mL;V为酶液的用量,mL;t为反应时间,min。
固定化酶的酶活力计算公式为
U固=cV异/(mt),
式中:c为脂肪酸的浓度,mmol/L;V异为异辛烷萃取溶液的体积,mL;m为固定化酶的用量,g;t为反应时间,min。
1.3.3 脂肪酶的固定化
预处理载体LX-1000IDA:取适量载体置于培养皿中的滤纸上,30 ℃烘箱过夜干燥。
固定化:取洁净干燥的50 mL离心管,精确称取所需载体LX-1000IDA,加入10 mL所需浓度的交联剂,再加入10 mL配置好的游离酶液,于适当温度下,进行一定时间的振荡,保证充分反应。抽滤除去未结合的游离酶及交联剂,30 ℃烘干待测酶活。
1.3.4 单因素实验
1.3.4.1 载体、酶液和交联剂的添加顺序对固定化酶的活性影响
设定LX-1000IDA载体量为0.5 g,游离酶液为10 mL(质量浓度为2 g/L),交联剂EDC为10 mL(终质量分数0.4%),固定化时间为6 h,固定化温度为25 ℃,pH为7.0,考察载体、酶液和交联剂的添加顺序对固定化酶的活性影响(见表1),重复3次确定最终结果。

表1 载体、酶液和交联剂添加顺序方案设计
1.3.4.2 缓冲液浓度对固定化酶的活性影响
设定LX-1000IDA载体量为0.5 g,游离酶液为10 mL(质量浓度为2 g/L),交联剂EDC为10 mL(终质量分数0.4%),固定化时间为6 h,固定化温度为25 ℃,pH为7.0,考察缓冲液离子浓度(0.05、0.1、0.2 mol/L,pH7.0)对固定化酶的活性影响,重复3次确定最终结果。
1.3.4.3 pH对固定化酶的活性影响
设定LX-1000IDA载体量为0.5 g,游离酶液为10 mL(质量浓度为2 g/L),交联剂EDC为10 mL(终质量分数0.4%),固定化时间为6 h,固定化温度为25 ℃,考察不同pH环境(4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)对固定化酶活性的影响,重复3次确定最终结果。
1.3.4.4 EDC浓度对固定化酶的活性影响
设定LX-1000IDA载体量为0.5 g,游离酶液为10 mL(质量浓度为2 g/L),固定化时间为6 h,固定化温度为25 ℃,pH为4.5,考察EDC终质量分数(0.2%、0.4%、0.6%、0.8%)对固定化酶的活性影响,重复3次确定最终结果。
1.3.4.5 温度对固定化酶的活性影响
设定LX-1000IDA载体量为0.5 g,游离酶液为10 mL(质量浓度为2 g/L),交联剂EDC为10 mL(终质量分数0.4%),固定化时间为6 h,pH为4.5,考察温度(20、25、30、35、40 ℃)对固定化酶的活性影响,重复3次确定最终结果。
1.3.4.6 载体量对固定化酶的活性影响
设定游离酶液为10 mL(质量浓度为2 g/L),交联剂EDC为10 mL(终质量分数0.4%),固定化时间为6 h,固定化温度为25 ℃,pH为4.5,考察载体量(0.2、0.4、0.6、0.8、1.0、1.2 g)对固定化酶的活性影响,重复3次确定最终结果。
1.3.4.7 固定化时间对固定化酶的活性影响
设定LX-1000IDA载体量为0.4 g,游离酶液为10 mL(质量浓度为2 g/L),交联剂EDC为10 mL(终质量分数0.4%),固定化时间为6 h,固定化温度为25 ℃,pH为4.5,考察固定化时间(2、4、6、8、10 h)对固定化酶的活性影响,重复3次确定最终结果。
1.3.5 Plackett Burman试验筛选对酶活影响较为显著因素
通过PB试验筛选固定化实验的主要影响因素,针对pH、EDC浓度、温度、载体量、时间5个因素,利用Design expert软件进行Plackett Burman试验设计,试验因素水平如表2。

表2 Plackett Burman试验因素水平
将得到的绝对酶活数据利用Design expert软件进行方差分析,筛选出对酶活影响较为显著的3个因素。
1.3.6 正交试验优化最佳固定化条件
将PB试验筛选出的对酶活影响较为显著的3个因素进行正交试验,其余因素皆用单因素实验得出的最佳条件,正交试验设计方案如表3。
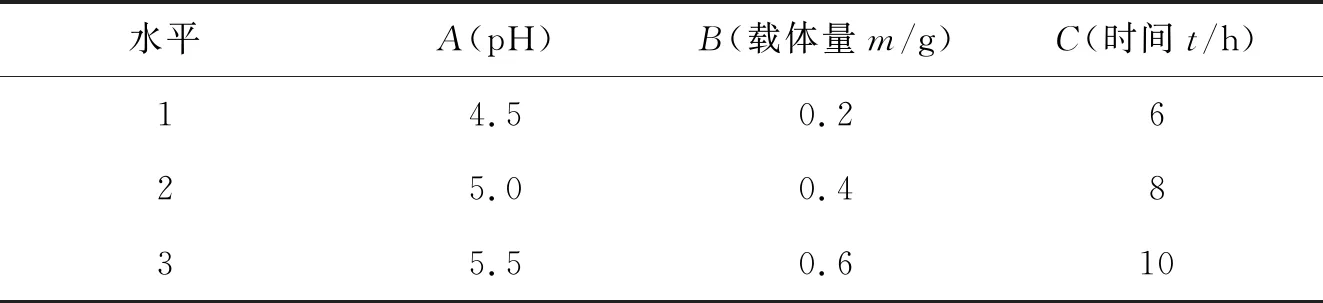
表3 正交试验因素水平
将得到的绝对酶活数据利用Minitab 17进行数据分析,最终确定最佳固定化条件。
1.3.7 最佳条件固定化扩大实验
依据单因素实验、Plackett Burman试验和正交试验得到的最佳固定化条件,对实际固定化酶制备进行10倍放大模拟试验。
1.3.8 固定化酶与游离酶的酶学性质比较
1.3.8.1 最适反应pH
按照最适固定化条件制备的固定化酶和游离酶,在40 ℃反应温度下,在pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0的缓冲液环境中进行酶活测定,重复3次并进行比较。
1.3.8.2 最适反应温度
按照最适固定化条件制备的固定化酶和游离酶,在1.3.8.1小节确定出的最适反应pH下,在不同温度(25、30、35、40、45、50、55、60 ℃)环境中进行酶活测定,重复3次并进行比较。
1.3.8.3 热稳定性
按照最适固定化条件制备的固定化酶和游离酶,①采用不同温度(40、50、60、70 ℃)水浴环境中孵育3 h后,在以上确定出的最适反应条件下进行酶活测定;②分别在70 ℃孵育环境中孵育3 h,每隔30 min取出一部分测定酶活。利用以上2种方法探究固定化酶与游离酶热稳定性的表现,重复3次并进行比较。
1.3.8.4 酸碱耐受性
按照最适固定化条件制备的固定化酶在不同pH (5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5)磷酸缓冲液环境中孵育3 h;游离酶利用不同pH磷酸缓冲液配置酶液,静置3 h。两者均在以上确定出的最适反应条件下进行酶活测定;重复3次并进行比较。
1.3.8.5 操作稳定性
按照最适固定化条件制备的固定化酶在相同的底物环境中重复进行催化底物水解反应,以第1次的酶活为100%,重复使用7次观察固定化酶重复使用性。
1.3.8.6 储存稳定性
按照最适固定化条件制备的固定化酶分装成0.1 g 1.5 mL EP管,与pH7.0的游离酶同时在4 ℃冰箱中保存一个月,每隔5 d于9:00测定当天的酶活,并进行比较。
2 结果与分析
2.1 单因素实验
2.1.1 载体、酶液和交联剂的添加顺序对固定化酶的活性影响
载体、酶液和交联剂的添加顺序对固定化酶的活性影响见图2(a)。由图2(a)可知:方案4制备的固定化酶的活性最高,即载体、酶液和EDC一起添加,进行振荡固定化得到的固定化酶活性最好。这是由于将3者同时混合加入,接触反应的概率更高,交联固定化的效果最佳,而分批次加入酶液和EDC试剂会存在交联不彻底或者固定化不充分的情况,导致交联不牢固,进而固定化酶的活性降低。因此利用方案4进行后续实验。
2.1.2 缓冲液浓度对固定化酶的活性影响
缓冲液浓度对固定化酶的活性影响见图2(b)。由图2(b)可知:缓冲液浓度对固定化酶的影响较小,在0.05、0.1、0.2 mol/L缓冲液环境中进行固定化,酶活变化范围在5%左右。在缓冲液浓度较低时随着浓度升高,制备的固定化酶的活性也升高,在缓冲液浓度为0.1 mol/L时最高,若继续提高缓冲液浓度,制得的固定化酶的酶活反应下降。因此后续实验选取0.1 mol/L为最佳缓冲液浓度。
2.1.3 pH对固定化酶的活性影响
pH对固定化酶的活性影响见图2(c)。由图2(c)可知:固定化酶的酶活随pH增大而减小,在pH 4.5时达到最佳酶活,因此在后续实验中将固定化pH设定为4.5。这可能是因为交联剂EDC在酸性pH的环境中活性最好,而在碱性环境中会影响交联过程中表面电荷的分布,干扰交联基团的反应,阻碍反应的进程,进而影响交联情况,对固定化酶的活性会有较大影响。
2.1.4 EDC质量分数对固定化酶的活性影响
EDC质量分数对固定化酶的活性影响见图2(d)。由图2(d)可知:固定化酶的活性随着交联剂EDC的质量分数增加呈现出先增加后降低的趋势,在终质量分数0.6%达到最佳的固定化酶活性,因此在后续实验中选取0.6%为最佳交联剂质量分数。这可能是在DEC低于0.6%时,EDC浓度太低不能完全对游离酶进行交联,但是超过0.6%会导致交联剂浓度过高,影响与载体的连接,同时还会导致催化过程中底物与酶的接触,影响催化效果。
2.1.5 温度对固定化酶的活性影响
温度对固定化酶的活性影响见图2(e)。由图2(e)可知:固定化酶的活性随着温度升高,在25 ℃达到最佳酶活,在温度大于25 ℃时,虽然酶活逐渐降低,但是仍比20 ℃的酶活好。这可能是因为温度适当提高有利于分子热运动,使得分子间扩散速率提高,促进酶液、载体与交联剂间的接触,进而增加固定化的充分性,适当的温度范围能保证脂肪酶的活性,但温度过高会导致酶失活。为了最佳效果及成本考虑,选取25 ℃为最佳固定化温度。
2.1.6 载体量对固定化酶的活性影响
载体量对固定化酶的活性影响见图2(f)。由图2(f)可知:随着载体量增大,固定化酶的活性呈现出先升高后降低的趋势,在0.4 g达到最佳酶活。载体量少于0.4 g时,游离酶不能被充分固定化,可能会使得酶液有剩余,而在大于0.4 g后,随载体量增加,固定化酶的活性趋于平稳,说明添加0.4 g载体是最合适的配比,若大于0.4 g就可能产生一些无效的连接或者交联非目的酶,导致活性下降。因此,后续试验选取0.4 g为最佳载体量。
2.1.7 固定化时间对固定化酶的活性影响
固定化时间对固定化酶的活性影响见图2(g)。由图2(g)可知:随着固定化时间的增加,固定化酶的活性呈现先升高后降低的趋势,在8 h达到最佳。这是由于固定化时间过短会导致固定化不完全,固定化效率低。但固定化时间过长,长时间(大于8 h)的振荡孵育,可能导致一些已经固定化的酶脱落,引起酶活的降低。因此固定化时间选取8 h。
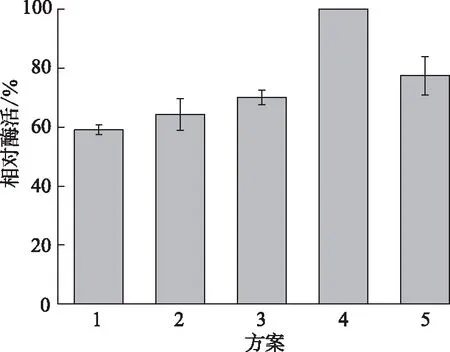
(a)载体、酶液和交联剂的添加顺序

(b)缓冲液浓度
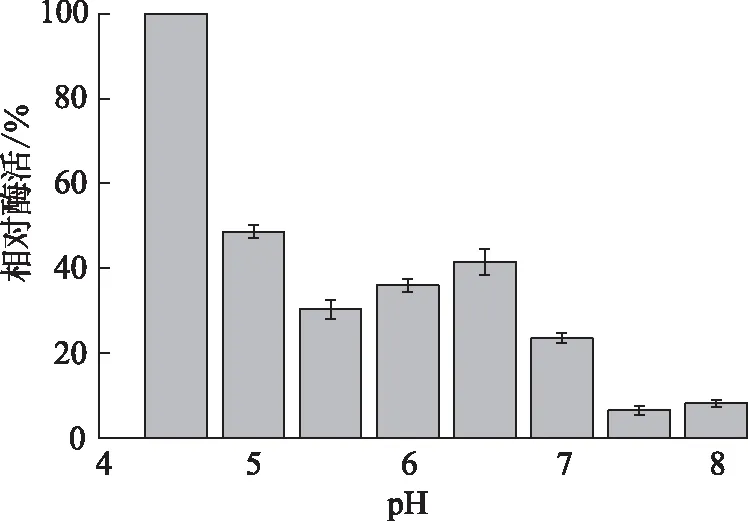
(c)pH

(d)EDC质量分数

(e)温度

(f)载体量
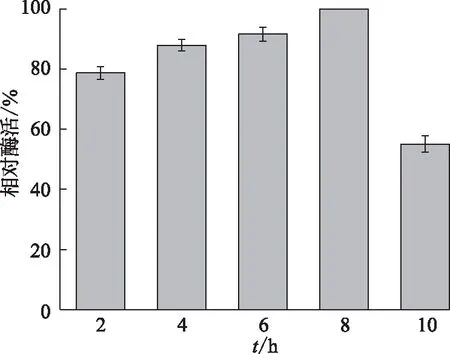
(g)固定化时间
2.2 Plackett Burman试验筛选主要显著因素
Plackett Burman试验结果如表4,将得到的绝对酶活数据在Design expert软件进行方差数据分析,结果如表5。由表5可知:该模型参数合理,信噪比充足可信。pH、载体量、时间3个因素的P值小于0.05,为显著因素。因此选择pH、载体、时间为固定化条件中影响显著的因素,进行后续正交试验优化条件。
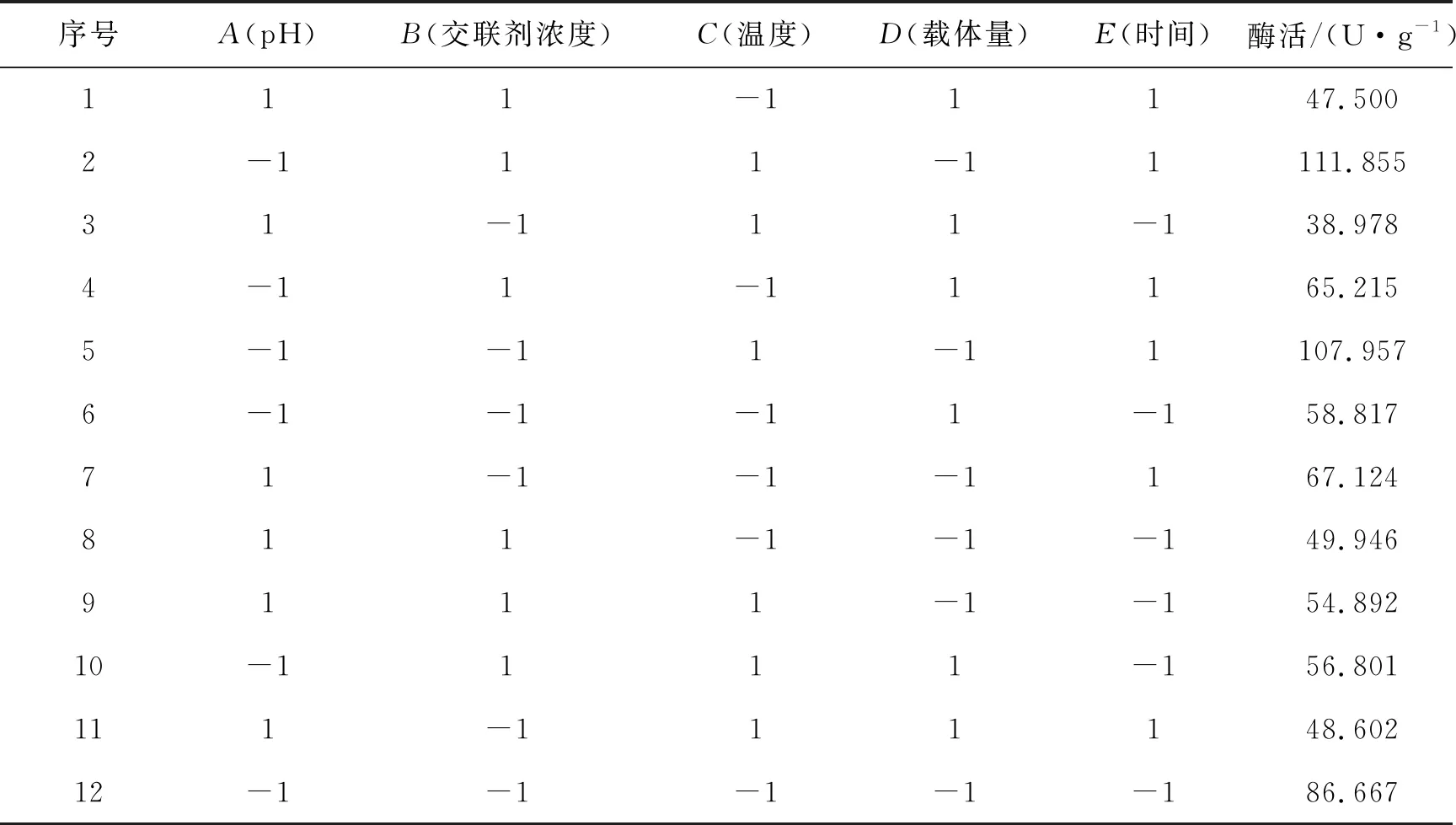
表4 Plackett Burman试验结果
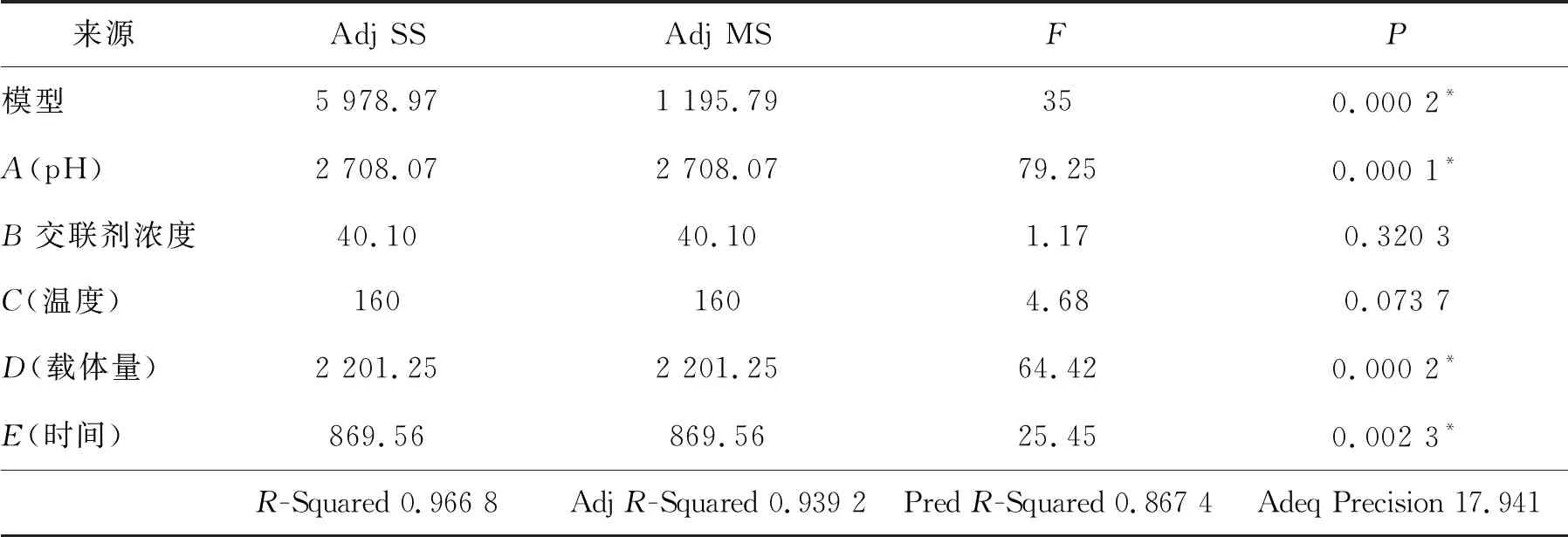
表5 Plackett Burman试验结果分析
2.3 正交试验优化最佳固定化条件
根据Plackett Burman试验结果发现对酶活具有显著影响的3个因素是:pH、载体量、时间,按照表3进行正交试验,正交试验结果见表6,利用软件对正交试验结果进行方差分析(表7),可以得出:pH、载体量、时间确实是影响显著的因素,其P值远远小于0.5,与Plackett Burman试验结果一致。由均值响应表(表8)可以看出,这3个因素的影响排序是:pH>载体量>时间,最佳固定化条件为:pH 4.5、载体量0.2 g、时间6 h。结合单因素中的最优条件温度25 ℃、EDC质量分数0.6%,可以得到最佳固定化条件为:pH 4.5、 载体量0.2 g、时间6 h、温度25 ℃、EDC质量分数0.6%。在此条件下制备的固定化酶的酶活为114 U/g。

表6 正交试验设计及结果

表7 正交试验方差分析

表8 均值响应
2.4 最佳固定化条件扩大实验
经过单因素实验、Plackett Burman试验、正交试验确定的最佳固定化条件为:pH 4.5、载体量0.2 g、时间6 h,温度25 ℃、EDC质量分数0.6%。在实验探索阶段利用50 mL的离心管一次仅能制备0.2 g固定化酶,为提高效率,在最佳条件的基础上,我们进行放大10倍的扩大实验,结果发现扩大固定化后,固定化酶的绝对酶活是未扩大前酶活的约2倍(210 U/g)。表明我们的研究完全可以为实际工业扩大化制备固定化酶。
2.5 固定化酶与游离酶的酶学性质比较
2.5.1 最适反应pH
由图3(a)可知,在pH 5.0~8.5内,游离酶的最适反应pH为7.5,而固定化酶IDA-LIPASE最适反应pH为8.0,固定化酶相比于游离酶的最适反应pH向碱性方向移动0.5。由两者变化趋势也可以发现,在碱性环境中,固定化酶表现更佳,可以更好地耐受碱性环境。这可能是由于固定化连接上了载体和交联剂,脂肪酶表面的电荷环境受到干扰,离子平衡被打破,在碱性环境可以保持其表面微环境的平衡,使得结构更加稳定;或者碱性环境使得固定化酶能够更容易地向活性构象转换,从而能更利于酶促反应的发生。
2.5.2 最适反应温度
由图3(b)可知,固定化酶IDA-LIPASE相比于游离酶,最适反应温度由40 ℃升高为50 ℃,在温度较高的环境中能更好地发挥催化效应。这是由于固定化后,载体本身具有较高机械强度,可以抵挡热的攻击,同时,载体、交联剂、酶分子形成的大分子,具备更加稳定的立体结构,在应对高强度的热袭击和振荡过程中可以稳定自身结构的弹性,因此固定化酶的最适反应温度得到提高,在较热环境中会表现出更佳的催化活性潜力,在实际工业应用中更具有优势。
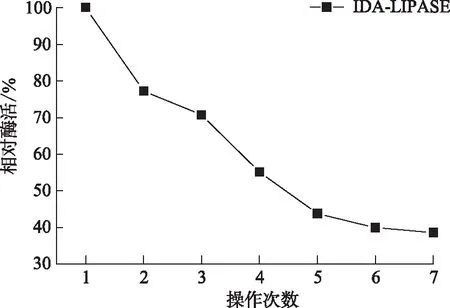
2.5.3 操作稳定性
固定化酶具有工业化应用潜力的一大优势就是其重复利用性,相比于游离酶液只能使用一次,固定化酶可以在使用后简单分离,进行重复使用,由图3(c)可以看出,固定化酶IDA-LIPASE在重复使用4次时还有50%的酶活,在重复使用第7次时还保留40%左右的酶活,表现出较好的操作稳定性。
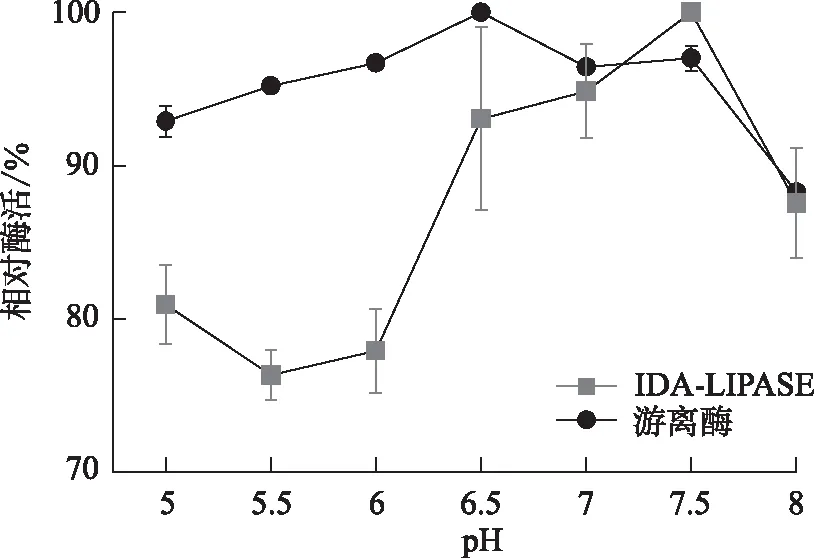
2.5.4 酸碱稳定性
由图3(d)可以看出,在酸性环境中孵育,固定化酶IDA-LIPASE相比于游离酶没有较好的表现,但是在碱性环境中,固定化酶的耐受性得到提高,但是也与游离酶相差不大。可能是由于长时间酸碱环境的孵育和浸泡对IDA-LIPASE的离子环境有较大影响,导致连接键不稳定,因此会有酶活的损失。
2.5.5 热稳定性
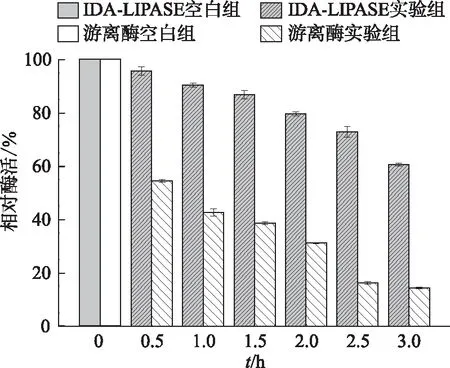
热稳定性通过2种方法进行测定,由图3(e)和(f)可知:①在40、50、60、70 ℃孵育3 h后,固定化酶IDA-LIPASE相比于初始酶活有不同程度的提高,最高提高约25%,而游离酶则随孵育温度的提高,以50 ℃为分界,酶活先升高后降低;②在70 ℃的水浴锅中孵育3 h,每隔0.5 h取出一部分测剩余酶活,发现固定化酶相比于游离酶,酶活损失更小,游离酶在0.5 h仅剩55%左右的酶活,而固定化酶在3 h后还保留60%的酶活。
由此可以得出:固定化酶IDA-LIPASE相比于游离酶对热的耐受性是相当出色的,游离酶固定化后,酶结构更加稳定,能抵抗高温环境,在实际催化反应中有较宽的温度适应范围。
2.5.6 储存稳定性
游离脂肪酶液和固定化脂肪酶IDA-LIPASE保存在4 ℃冰箱30 d,每隔5 d测定其酶活,观察其随时间变化的趋势。由图3(g)可知:储存30 d,固定化酶的活性保留率更高,剩余84.6%的酶活,而游离酶仅剩余79%的酶活。
3 讨论
碳二亚胺EDC作为蛋白质偶联剂,可以将羧基载体与酶蛋白的氨基进行化学结合固定化。有研究显示碳二亚胺可以作为固定化酶的交联剂,固定胰凝乳蛋白酶[25-26],其在45 ℃ 孵育4.5 h后,固定化酶的剩余活性高达92.5%。本文工作也印证了碳二亚胺作为固定化交联剂的作用,且固定化效果良好。Zhu Yuanting等[27]利用EDC偶联羧基化的磁性纳米颗粒固定化猪胰脂肪酶,获得的脂肪酶在70 ℃中保留60%的初始酶活,其耐热性低于本文所制备的固定化酶,且制备过程复杂,磁性纳米颗粒的成本更高。Zhu Jun等[28]利用丝瓜络固定化脂肪酶,丝瓜络海绵通过柠檬酸羧基与纤维素羟基之间的热化学酯化反应,引入了游离羧基,以1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)为缩合试剂,与脂肪酶氨基反应进行固定化,需要在丝瓜络中先引入羧基,因此增加了制备复杂性和不均一性,其固定化脂肪酶的最高活性为45.8 U/g,所得酶活低于本文所制备的固定化酶。

(a)最适反应pH

(b)最适反应温度
(c)操作稳定性
(d)酸碱耐受性
(e)在70 ℃下孵育3 h酶活变化

(f)在不同温度下孵育3 h剩余酶活

(g)储存稳定性

本工作为使用EDC和羧基载体固定化脂肪酶提供了具体的工作流程和参数支持,所使用的载体、酶粉等均已实现工业级制备,该方法也具有实际应用的可能性,所制备的固定化酶IDA-LIPASE在酶学性质测定中表现良好,在模拟扩大制备的实验中也证实该方法有潜力进行工业应用,可以适应固定化酶工业量产的需求。众多科研人员将精力投入于实验室级别制备新型材料,十分具有创新性,但是真正应用到工业生产仍需要花费很长时间的研究,而且在保证大批量、高质量和高均一性的要求下实现新型材料的应用仍然具有挑战性。
4 结语
本实验利用碳二亚胺EDC作为羧基载体LX-1000IDA的活化剂,通过脂肪酶的表面氨基,将脂肪酶固定于羧基载体上达到固定化的目的,形成固定化海洋脂肪酶IDA-LIPASE。结果如下:1) 筛选出的固定化方案为将载体、EDC和游离酶同时加入反应管,在此基础上利用单因素实验、Plackett Burman试验、正交试验得到的优化固定化条件为:pH 4.5、载体量0.2 g、时间6 h、温度25 ℃、EDC质量分数0.6%;2) pH、时间、载体量是对固定化酶的活性影响显著的因素,这3个因素的影响排序是:pH>载体量>时间;3) 模拟扩大固定化的实验结果显示:扩大10倍,获得的固定化酶的活性由114 U/g提高到210 U/g;4) 相比于游离酶,固定化脂肪酶IDA-LIPASE最适反应温度提高10 ℃,最适反应pH向碱性方向移动0.5,重复使用性良好,重复催化第7次还剩余40%左右的酶活,可以长时间耐受70 ℃或更高的高温,另外,在4 ℃保存30 d后剩余84.6%酶活,具有良好的储存稳定性。
依据本实验所优化的固定化条件,基于羧基载体所制备的固定化酶IDA-LIPASE具备较好的环境耐受性、操作稳定性和保存稳定性,同时,具备扩大化生产的潜力,在实际的工业制备和催化反应中能够发挥比较稳定的催化能力,具有较好的工业应用价值,可以进一步应用于污水净化、皮革处理、食品添加剂中酯类合成、香料合成和生物柴油生产等实际生产的尝试。例如,可以开发该固定化脂肪酶用于合成酯类食品添加剂[29],开发该固定化脂肪酶合成香料产品[30];此外,还可以尝试开发该固定化脂肪酶合成生物柴油[31]。固定化脂肪酶制剂在化工、能源和环境保护等诸多工业领域都具有巨大应用价值和潜力。

