响应面法优化金枪鱼蛋白抗痛风活性肽制备工艺
李桂芬,何定芬,郑霖波,张家玮,叶常青,谢 超
(1.浙江国际海运职业技术学院,浙江舟山 316021;2.浙江海洋大学食品与医药学院,浙江舟山 316022;3.舟山市常青海洋食品有限公司,浙江舟山 316022.)
痛风在现代社会中是很常见的一种疾病。人体中的嘌呤类物质经过代谢会产生尿酸,正常情况下其在血液中浓度为200~410 μmol·L-1,男性的尿酸含量一般高于女性[1]。一旦人体血液中尿酸含量过高,就会出现高尿酸败血症[2],从而导致关节等地方出现尿酸盐结晶的析出沉积,出现痛风的症状。血尿酸浓度长时间在高水平,会诱发高血压[3]、糖尿病[4]及冠心病[5]等各类疾病。黄嘌呤氧化酶(XOD)是人体嘌呤代谢的终端酶和关键酶,人体的尿酸浓度在某种程度上可以通过XOD 活性表现,因此测定XOD 活性可以确定尿酸含量水平[6]。COOPER N,et al[7]、GEORGE S K,et al[8]以及李忠琴[9]等人用液相色谱法检测XOD 活性,还有辣根过氧化物酶法[10]等检测手段。
国内外研究表明一些生物肽具有抗痛风活性,比如乳清蛋白[11]、糖巨肽和G600 乳脂[12]、鲨鱼软骨[13]等。生物活性肽一般由四种途径产生,天然生物活性肽、人工合成肽、蛋白水解肽以及微生物发酵制备肽,蛋白水解肽是获得生物活性肽最重要也是最普遍的手段[6]。多肽因其特殊性,有很广的应用范围,研究具有抗痛风、防治高尿酸血症作用的生物活性肽有很高的社会价值。
金枪鱼(Thunnus),别名吞拿鱼,属硬骨鱼纲、驴形目、金枪鱼属[14],是一种生活在热温带海域的洄游鱼类,各大海域均有分布[15]。金枪鱼具有很高的营养价值,富含多种不饱和脂肪酸,非常适合食用以补充人体所需的营养[16]。本文以金枪鱼为原料,通过单因素实验结合响应面法优化复合酶解工艺参数,获得金枪鱼抗痛风活性肽,为研究抗痛风活性肽提供理论依据,具有一定的社会价值。
1 材料与方法
1.1 材料与试剂
金枪鱼,舟山市常青海洋食品有限公司提供。将金枪鱼去除头部以及内脏之后置于绞肉机中得到金枪鱼鱼糜,收集分装鱼糜置于-20 ℃冰箱中冻藏。实验开始前4 h 取出在室温下解冻备用。
中性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶以及碱性蛋白酶均购于南宁东恒华道生物科技有限责任公司。
磷酸二氢钾,磷酸氢二钠,磷酸二氢钠,磷酸二氢氨,乙酸铵盐酸,均为分析纯,购于国药集团化学试剂有限公司。
黄嘌呤,黄嘌呤氧化酶,尿酸,别嘌呤醇,甲醇,均为色谱纯,购于美国Sigma 公司。
1.2 仪器与设备
仪器与设备见表1。

表1 仪器与设备Tab.1 Instruments and equipment
1.3 方法
1.3.1 金枪鱼生物肽的制备
取解冻好的金枪鱼鱼糜20 g,加至100 g 去离子水中,调节溶液的pH,达到加入蛋白酶的最适pH 值,加入0.2 g·100-1·mL-1[17]的蛋白酶进行酶解,酶解温度均控制在45 ℃,酶解完成后水浴加热至95 ℃持续15 min进行灭酶[18]。冷却后去酶解液10 000 r·min-1离心10 min,取上清液置于10 mL 离心管中密封,放置于-20℃的冰箱中保存备用。
1.3.2 蛋白回收率测定
采用凯氏定氮法[19]测定金枪鱼鱼糜与上清液中总氮。蛋白回收率计算公式如下:
蛋白回收率=(m上清液×N上清液)÷(m鱼糜×N鱼糜)
m上清液:上清液质量;N上清液:上清液N 元素含量;m鱼糜:鱼糜质量;N鱼糜:鱼糜N 元素含量。
1.3.3 黄嘌呤氧化酶(XOD)抑制活性测定
1.3.3.1 配制溶液:
磷酸缓冲液(PBS):分别称取磷酸氢二钠(Na2HPO4·12H2O)和磷酸二氢钠(NaH2PO4·2H2O)30.083 8 g及2.4962 g,加入超纯水后定容至500 mL。
黄嘌呤:6.4 mg 黄嘌呤溶解于1 mL NaOH 中,再加入100 mL PBS 溶液,调节pH 至7.5。
黄嘌呤氧化酶:抽取120 μL 黄嘌呤氧化酶液,加入PBS 至10 mL。
流动相:0.015 mol·L-1磷酸二氢胺溶液。
1.3.3.2 预处理
稀释样品到50 mg·mL-1,实验组为50 μL 样品与150 μL 黄嘌呤混合液,对照组为50 μL PBS 与150 μL黄嘌呤混合液,全部置于酶标板中,均做3 个平行组。在恒温30 ℃下静置10 min,随后加入黄嘌呤氧化酶50 μL,从加入时开始计时,每间隔30 s 测一次吸光值,持续测试50 次。测量结束后加入高浓度HCl 使反应终止,取反应液用去离子水稀释10 倍后过水性膜,保存反应液。
1.3.3.3 尿酸生成量
色谱柱:戴安DIONEX-IonPac 离子色谱柱(5 μm,4.0×250 mm)
液相条件:洗脱液为15%甲醇85%磷酸二氢胺混合溶液,进样体积为20 μL,流速1 mL·min-1,检测波长为290 nm,运行时间15 min[6]。
1.3.3.4 结果分析
XOD 抑制率=1-(对照组尿酸峰面积÷样品组尿酸峰面积)
1.3.4 酶的筛选
选取中性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶以及碱性蛋白酶五种蛋白酶,在各酶最适酶解条件下分别进行单酶酶解,反应相同时间(6 h)获得酶解液,测定酶解液的蛋白回收率和XOD 抑制率,对比确定最佳的2 种蛋白酶。选取两种最佳蛋白酶后进行复合酶解,复合比例为1:1,料液比1:2。
1.3.5 单因素实验
在用复合酶酶解鱼糜时会有许多因素影响酶解的过程,本实验选取其中3 个对实验影响较大的因素进行单因素实验,分别是酶解温度、加酶量以及酶解时间。通过对3 个因素的单独考察,测定其蛋白回收率和XOD 抑制率,得到最优的酶解单因素条件。
1.3.6 响应面试验设计
利用响应面试验对多个因素进行拟合实验,通过响应值的对比,从而获得最佳的复合酶解条件。本实验选取的3 个因素为酶解温度、加酶量以及酶解时间,响应值为蛋白回收率及XOD 抑制率,使用Design-Expert 10.0 软件进行响应面分析。
1.3.7 分子量测定
参照袁蕊[20]液相色谱法测定。
2 结果与分析
2.1 酶的筛选
图1 展现了不同种类的蛋白酶在酶解金枪鱼糜时呈现的不同效果。观察图1-a 可以看出,在酶解时蛋白回收率较高的是中性蛋白酶、胰蛋白酶和碱性蛋白酶;图1-b 为XOD 抑制率,其中表现较好的中性蛋白酶、木瓜蛋白酶和胰蛋白酶。综合上述,最终选择中性蛋白酶和胰蛋白酶作为复合酶对金枪鱼进行酶解,复合比例1:1,复合酶解时pH 为7.5。
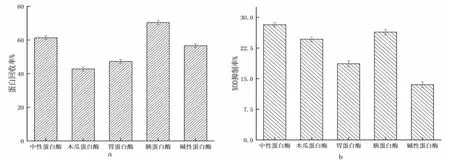
图1 不同蛋白酶对酶解效果的影响Fig.1 The influence of different proteases on the enzymatic hydrolysis
2.2 单因素试验
2.2.1 复合酶酶解温度
复合酶解条件:复合酶酶解时间6 h,加酶量900 U·g-1。自变量为复合酶酶解温度35.0、37.5、40.0、42.5、45.0、47.5、50.0、52.5、55.0 ℃,实验结果见图2。
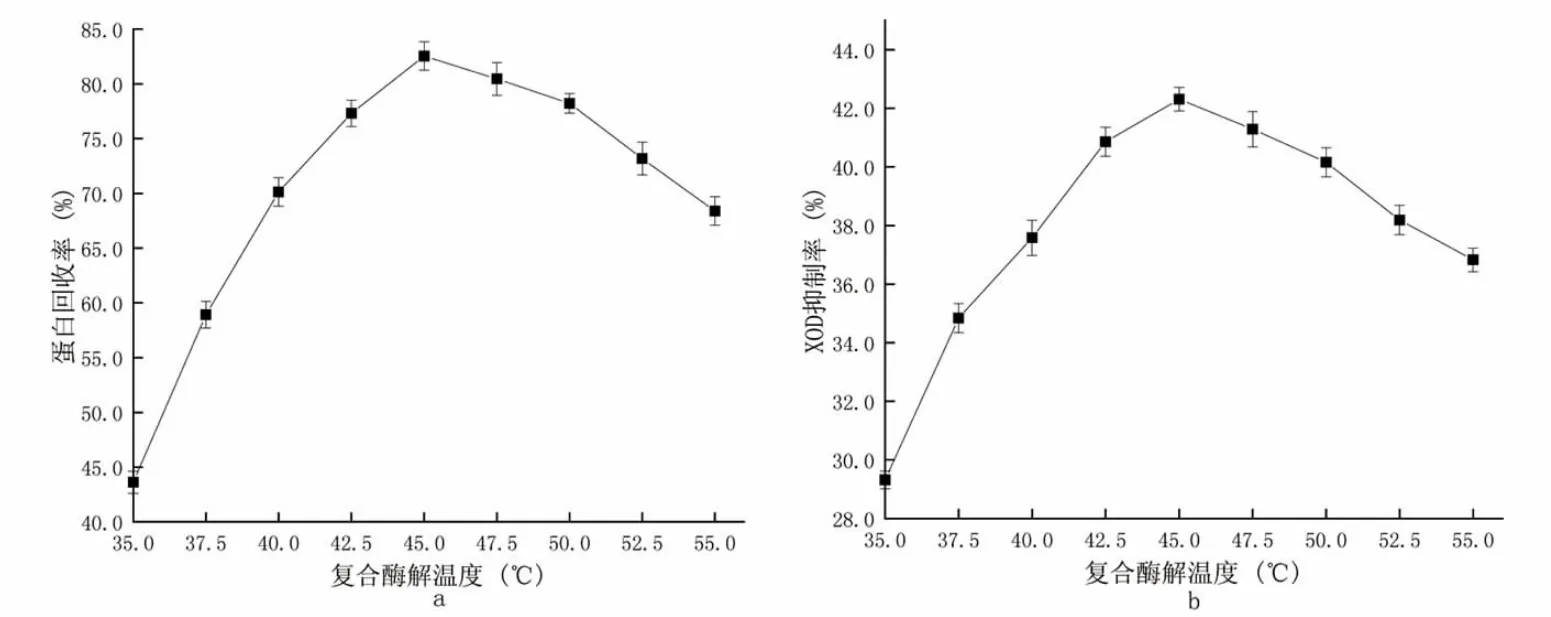
图2 复合酶解温度对酶解效果的影响Fig.2 The effect of compound enzymolysis temperature on the enzymolysis effect
图2 所示为复合酶解时不同的酶解温度对酶解效果的影响。分析图2-a,可以发现当酶解温度较低35 ℃时,蛋白回收率只有43.62%,此时因为酶解环境温度低,酶活力下降导致酶解反应速率下降;之后随着温度的升高,酶活性上升推动酶促反应加快,在45 ℃时蛋白回收率达到最大值82.54%;继续升温后蛋白回收率则出现下降趋势,分析原因可能是温度过高导致部分酶失去活性,导致酶促反应下降。图2-b 反映了酶解温度变化时XOD 抑制率的变化,其变化趋势与蛋白回收率相似,其原因可能是具有XOD 抑制效果的肽在酶解效果较差时没有被酶解得到导致抑制率降低,当酶解效果较好时此类肽增多,提高了XOD抑制率。综合上述,得到复合酶解最佳温度为45 ℃。
2.2.2 复合酶酶解加酶量
复合酶解条件:复合酶酶解时间6 h,酶解温度45 ℃。自变量为复合酶加酶量150、300、450、600、750、900、1 050、1 200、1 350 U·g-1,实验结果见图3。
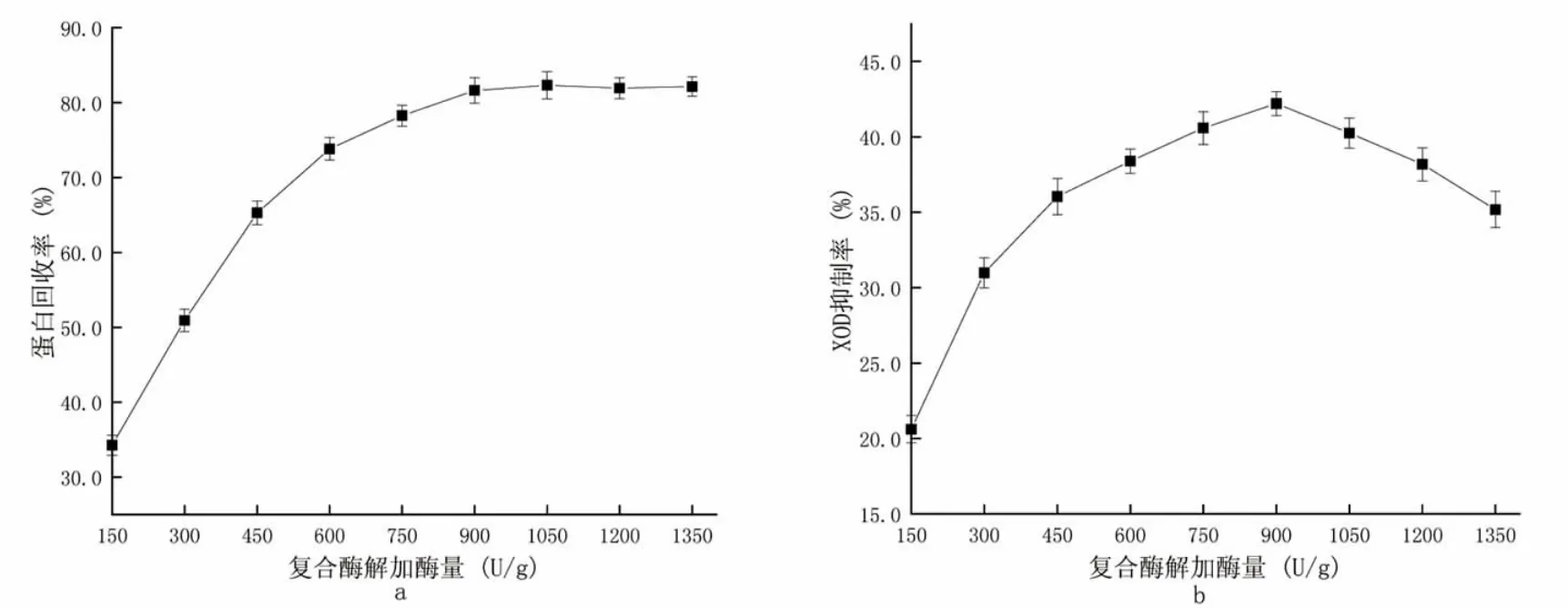
图3 不同复合酶加酶量对酶解效果的影响Fig.3 The effect of different compound enzymes on the enzymatic hydrolysis effect
从图3 可以看出,随着加酶量的增多,蛋白回收率以及XOD 抑制率也随之提高,在加酶量到达900 U·g-1后蛋白回收率基本不再发生变化,而XOD 抑制率则出现了下降的趋势。可能是当加酶量较低时,酶含量少,酶促反应速率很低,从而蛋白回收率以及XOD 抑制率都处于较低水平;当加酶量到达900 U·g-1后,游离氨基态氮含量处于饱和状态,酶促反应速率基本不再变化;然而继续添加蛋白酶后,过量的蛋白酶会影响XOD 抑制肽的活性,同时也让酶解液颜色加深,出现不良气味[21]。因此,最佳的酶添加量为900 U·g-1。
2.2.3 复合酶酶解时间
复合酶解条件:复合酶酶解加酶量900 U·g-1,酶解温度45 ℃。自变量为复合酶酶解时间4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0 h,试验结果见图4。
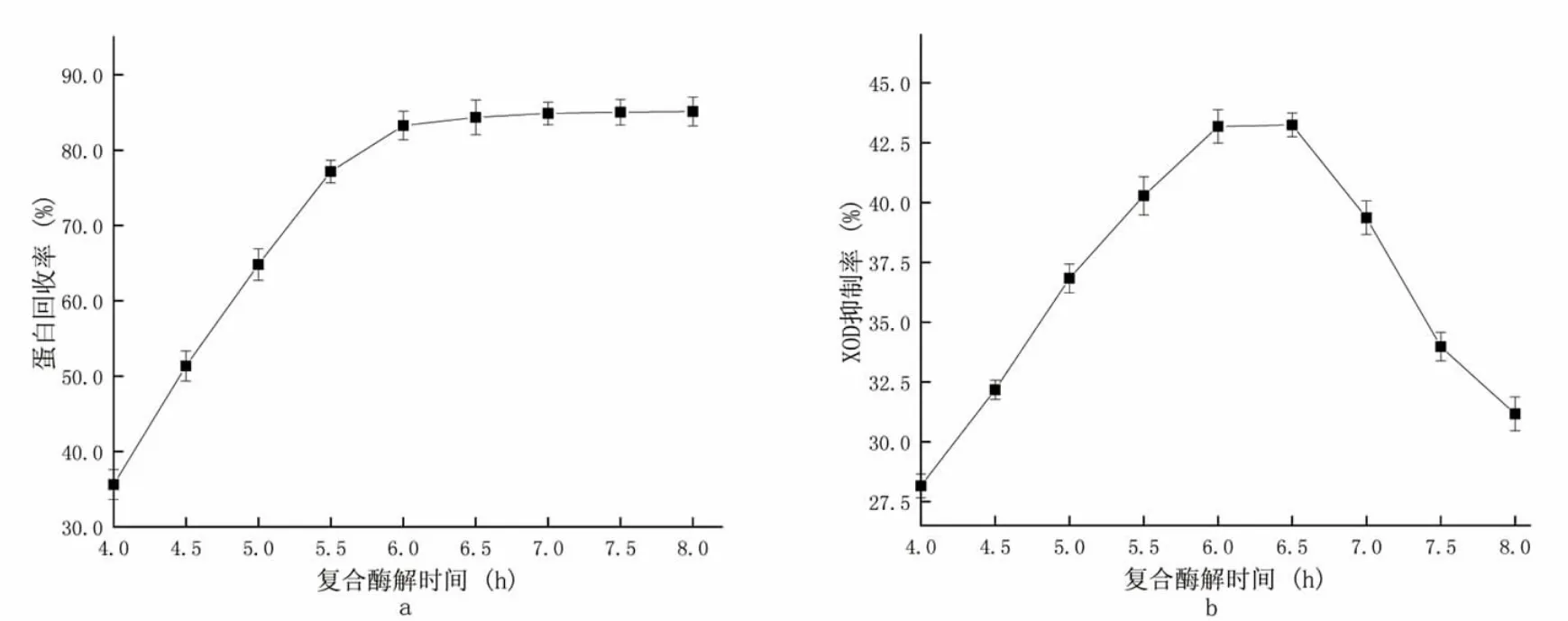
图4 不同复合酶解时间对酶解效果的影响Fig.4 The effect of different compound digestion time on the digestion effect
图4-a 为不同复合酶酶解时间对蛋白回收率的影响。从图中可以看出,当酶解时间为4 h 时因酶解时间不足,蛋白回收率只有35.62%,当酶解时间延长,底物被充分反应,蛋白回收率不断提高,当酶解时间达到6 h 之后变缓,基本不再升高,此时游离氨基酸基本饱和。分析图4-b,前期随着酶解时间的延长有XOD抑制活性肽在不断被析出,增加了XOD 抑制率,在6.5 h 时达到最大抑制率43.24%;但是随着时间继续延长,抑制率出现了明显的下降,可能是随着时间的延长,酶促反应在不断进行,抑制活性肽又被水解成了更短的肽链,从而失去了抑制性。结合两者,得出最佳的酶解时间为6.5 h。
2.3 响应面优化
2.3.1 响应面设计方案及结果
根据单因素实验结果,进行响应面优化试验设计,设计结果见表2,试验结果见表3。
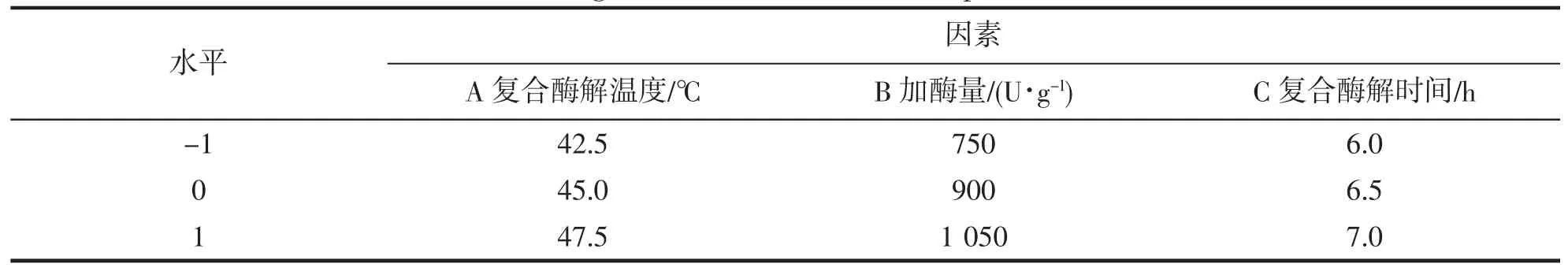
表2 响应面设计因素及水平Tab.2 Design factors and levels of response surface
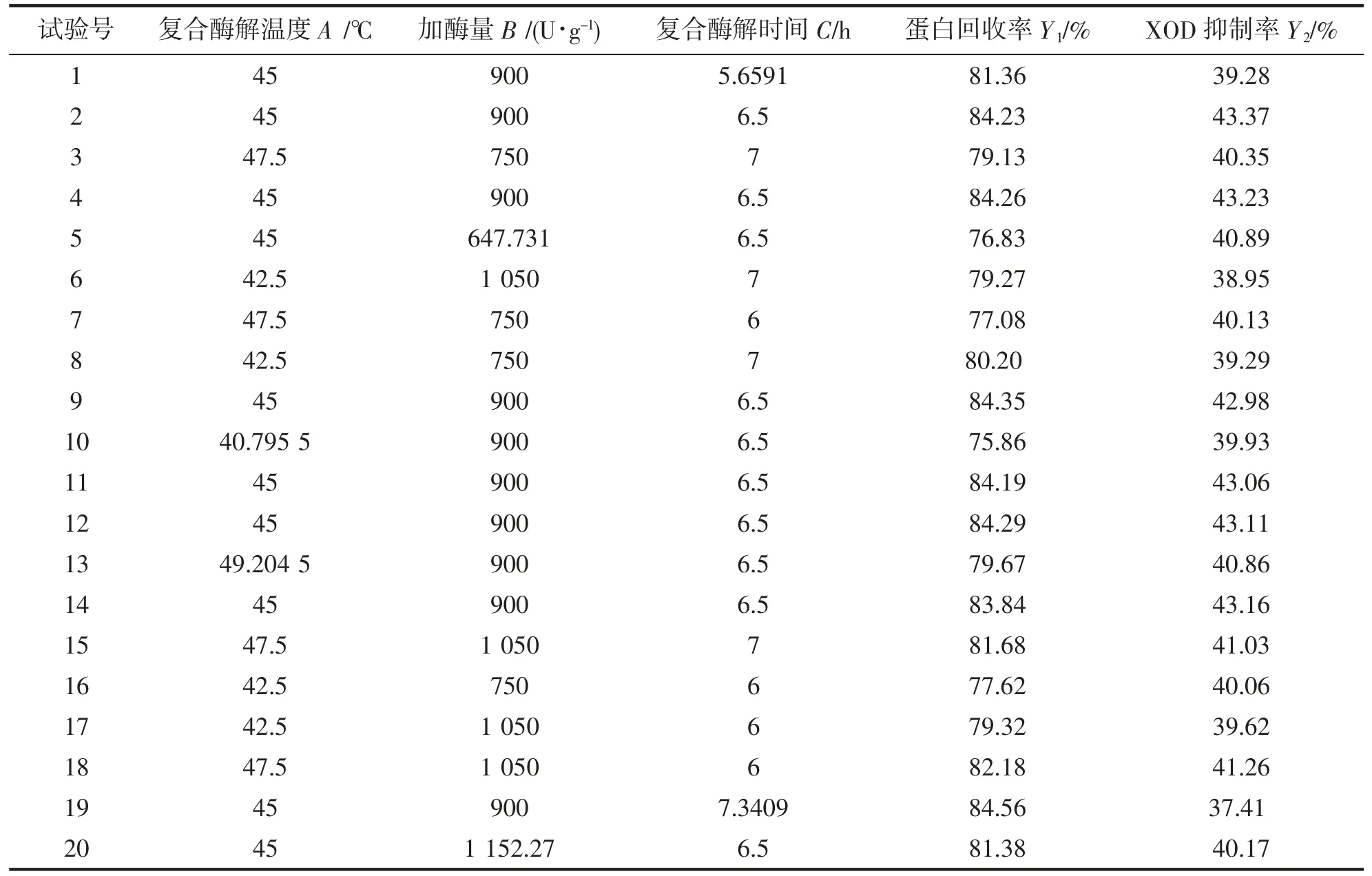
表3 响应面设计结果Tab.3 Design results of response surface
2.3.2 回归方程建立及方差分析
利用软件分析表3 中的数据,得到回归方程:
Y1=84.2+0.74A+1.18B+0.69C+0.86AB-0.12AC-0.65BC-2.3A2-1.83B2-0.46C2
式中系数数值的大小表示对蛋白回收率的影响大小,而符号表示该因素的影响方向。蛋白回收率回归模型方差分析见表4。
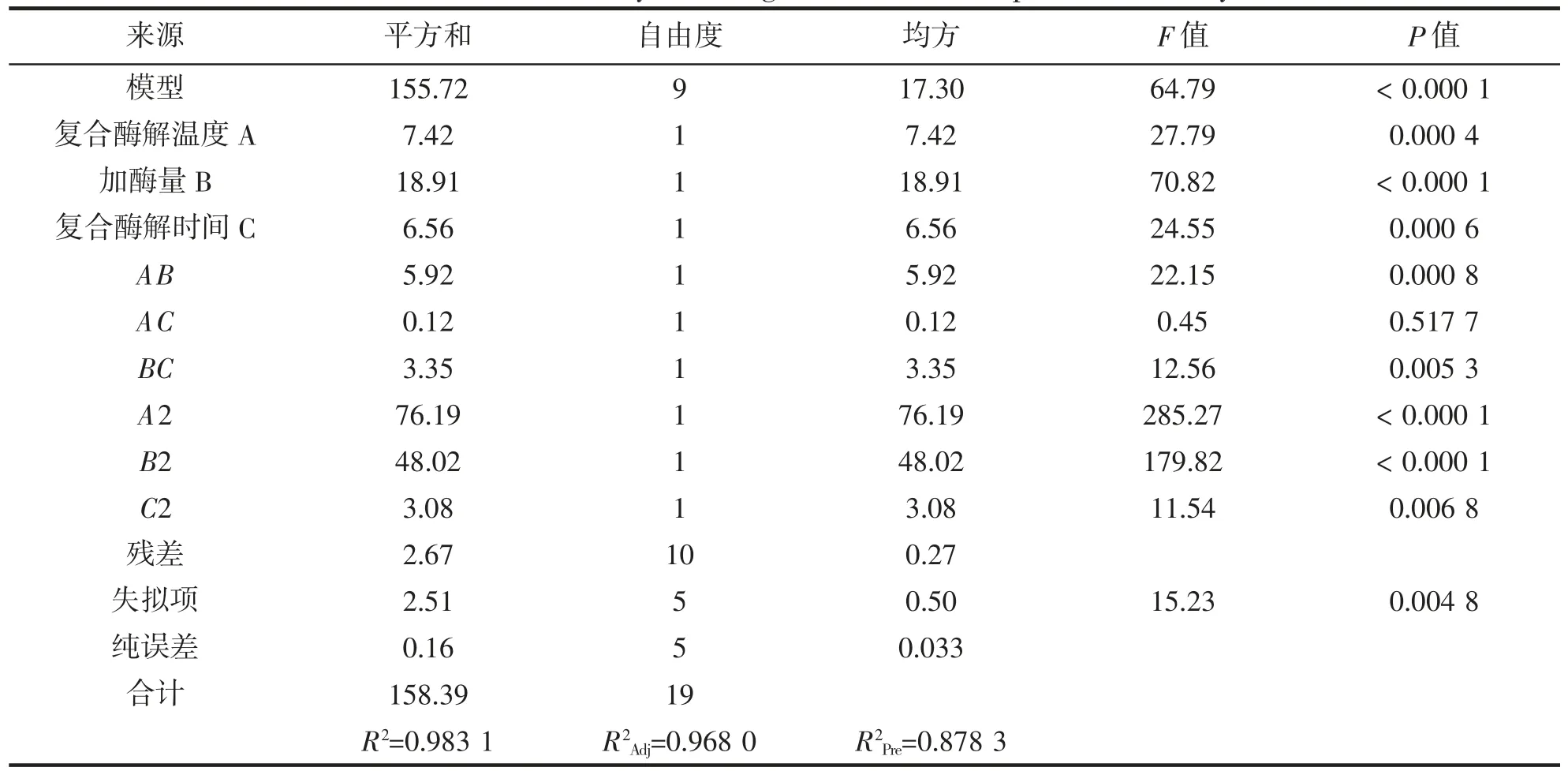
表4 蛋白回收率回归模型方差分析Tab.4 Variance analysis of regression model of protein recovery
表中显示该模型P<0.000 1,水平为极显著模型,R2=0.983 1 且失拟项2.51 远大于0.05,证明该模型有很好的模拟效果,贴合实际实验,拟合效果好,可以作为复合酶解金枪鱼糜过程中蛋白回收率的预测和分析工具。同时该模型的矫正决定系数R2Adj=0.968 0 远大于0.8,变异系数CV=0.64%,进一步表明该模型拟合的可靠性,能够真实的反映实验值。分析表中各因素均方以及P 值可得,蛋白回收率的因素影响顺序为:加酶量>复合酶解温度>复合酶解时间。复合酶解温度和加酶量的二次项均极显著(P<0.000 1),复合酶解时间的二次项为显著(P<0.05),观察交互项显著性则说明存在一定的互相影响。
利用软件分析表3 中的数据,得到回归方程:
Y2=43.13+0.47A-0.013B-0.34C+0.32AB+0.18AC-0.044BC-0.86A2-0.81B2-1.59C2
式中系数数值的大小表示对XOD 抑制率的影响大小,而符号表示该因素的影响方向。XOD 抑制率回归模型方差分析见表5。
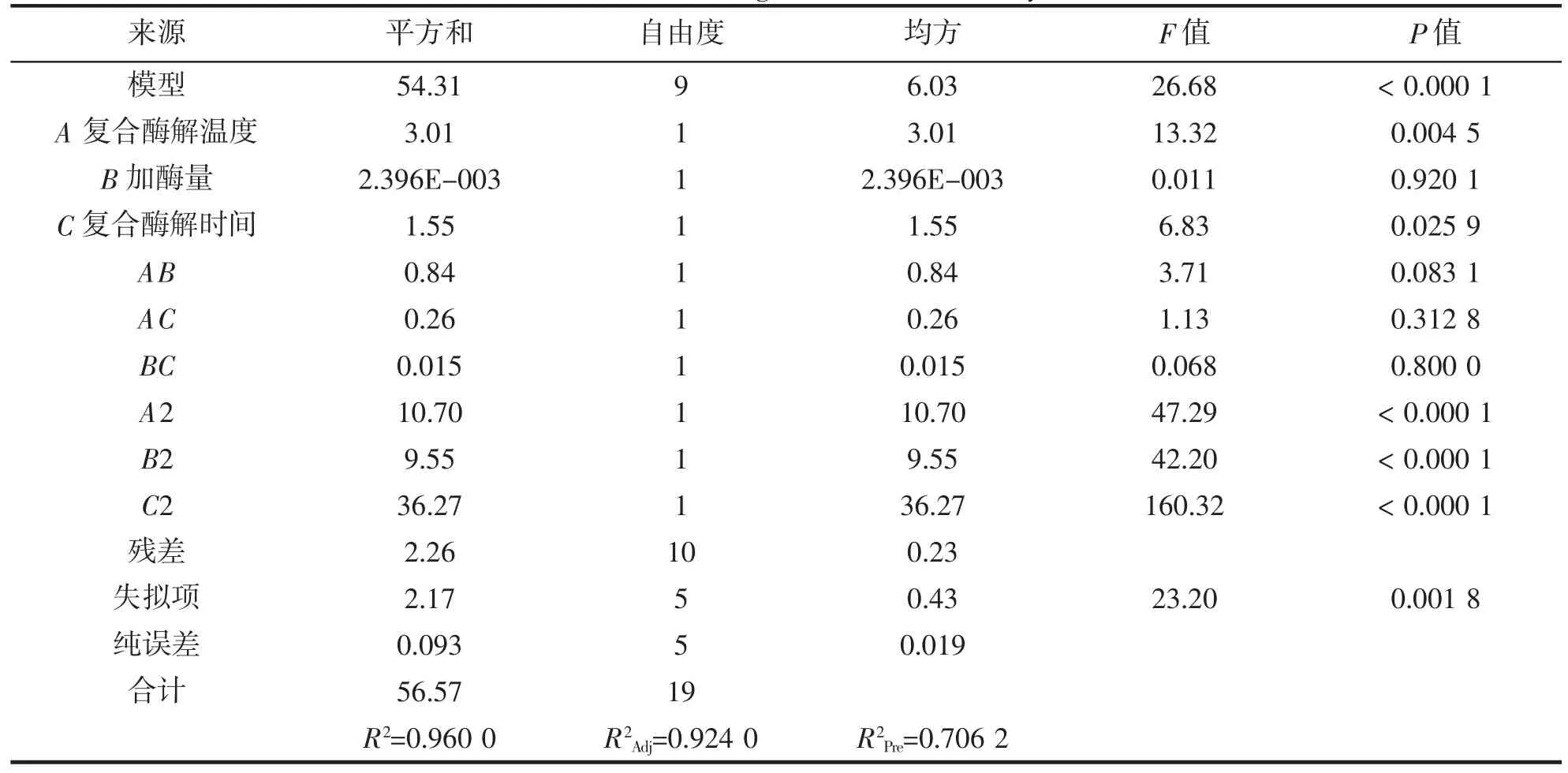
表5 XOD 抑制率回归模型方差分析Tab.5 XOD inhibition rate regression model analysis of variance
分析表5 可知,该模型为极显著模型(P<0.000 1),R2=0.960 0,失拟项为2.17,矫正决定系数R2Adj=0.924 0,变异系数CV=1.16%,说明该模型总体拟合程度高,各因素与响应值之间存在明确的线性关系,具有相当高的准确性,能够很好的结合试验预测分析复合酶解金枪鱼糜的过程中XOD 抑制率的变化。根据表中数据,对XOD 抑制率影响最大的是复合酶解温度,其次是复合酶解时间,影响最小的是加酶量。三个因素的二次项均表现为极显著(P<0.000 1),三个交互项的影响水平均为不显著。
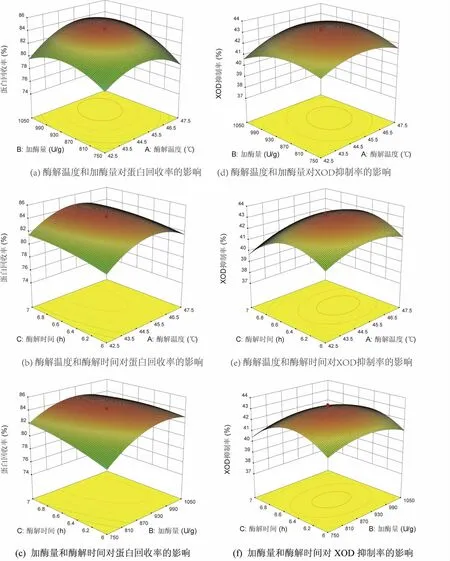
图5 蛋白回收率和XOD 抑制率响应面分析Fig.5 Response surface analysis of protein recovery and XOD inhibition rate
图5 揭示了交互项之间的相互作用对蛋白回收率和XOD 抑制率的影响[22]。根据响应面优化分析可知,该复合酶解工艺的最佳条件为:复合酶解温度45.616 1 ℃,加酶量936.594 U·g-1,复合酶解时间6.504 7 h,此条件下蛋白回收率预测值为84.474 3%,XOD 抑制率预测值为43.162 6%。
2.3.3 响应面最佳条件验证
根据实际可操作性,优化酶解条件为:复合酶解温度45.5 ℃,加酶量935 U·g-1,复合酶解时间6.5 h。在此条件下最终实验测得蛋白回收率为83.46%,与预测值偏差1.2%;XOD 抑制率为43.51%,与预测值偏差0.8%,证明该模型拟合度高,优化作用有效。最终复合酶解后蛋白回收率相比单一蛋白酶酶解最高值提高了36.1%,XOD 抑制率提高了54.4%,证明相比于单酶酶解工艺,复合酶解工艺对提高蛋白回收率和XOD 抑制率非常有效。
2.4 分子量分布
对酶解前后的金枪鱼进行分子量测定,研究其变化,测定结果见图6。
分析图6 可得,金枪鱼在没有经过酶解时大分子(KDa>10)占比达到了37.29%,而经过酶解后只剩3.45%,降低了90.7%,其余肽段的含量经过酶解后均有上升,在<3 KDa 此肽段含量达到了78.55%,其中(1~3)KDa 段含量为42.57%,<1 KDa 肽段含量为35.98%,此时XOD 抑制率水平较高,说明小分子肽很可能具有XOD 抑制活性,目前国内外研究热点也集中在小分子肽,证实小分子肽具有更多样的生物活性[23]。
3 结论
本文以金枪鱼为研究对象,优化了金枪鱼抗痛风活性肽的酶解制备工艺,同时进行了分子量测定。通过实验得到复合酶组合为中性蛋白酶加胰蛋白酶,再通过响应面优化设计得出最佳复合酶解工艺条件为:复合酶解温度45.5 ℃,加酶量935 U·g-1,复合酶解时间6.5 h。在此条件下实验测得蛋白回收率为83.46%,与预测值偏差1.2%,相比单蛋白酶酶解提高36.1%;XOD 抑制率为43.51%,与预测值偏差0.8%,相比单蛋白酶酶解提高54.4%,证明相比于单酶酶解工艺,此复合酶解工艺能够酶解得到更多的抗痛风活性肽。酶解后酶解液的肽主要为小分子肽,在<3 KDa 肽段含量达到78.55%,其中(1~3)KDa 肽段含量为42.57%,<1 KDa 肽段含量为35.98%,大分子肽含量相比于未酶解时降低了90.7%,证明小分子肽具有较高的抗痛风活性。本文为金枪鱼抗痛风活性肽的全面研究提供了一定的理论基础。
本研究对金枪鱼抗痛风活性肽的酶解工艺和XOD 抑制率进行了研究,但是针对抗痛风的机理并未深入探讨。在本研究基础上继续研究抗痛风活性肽,结合食品药品领域的研究,将会带来一定的社会效益及经济效益。

