生殖细胞及胚胎冻存技术发展及展望
(浙江海洋大学海洋科学与技术学院,国家海洋设施养殖工程与技术研究中心,浙江舟山 316022)
生殖是生命活动的基本过程,人类对自身及其他生物的生殖研究历史久远。随着现代生物学研究技术的快速发展,人工授精等一系列生殖操作技术得到了大规模运用,为于人类生殖医疗及养殖产业的发展提供了新的动力。作为人工授精技术的重要组成,多种生殖细胞及胚胎的冻存方法已被开发并获得了成功应用。1953 年,BLAXTER[1]成功实现了太平洋鲱鱼Clupea harengus 的精巢冷冻保存,之后,生殖细胞的低温保存技术得以迅速发展。本文对动物生殖细胞及胚胎冻存技术进行了梳理和总结,以期为相关研究及技术开发提供参考。
目前,有关生殖细胞冷冻保存技术已经获得广泛应用,包括哺乳动物、鱼类以及一些无脊椎动物(包括软体动物[2]、棘皮动物[3]等)。根据冷冻保存的技术差异以及生殖细胞冷冻保存的方式,生殖细胞冻存方法主要分为慢速冷冻和快速冷冻。慢速冷冻也称慢速程序化冷冻,是指将细胞置于冷冻保护剂中,利用程序冷冻仪或不同温差的冰箱实现分阶段降温。该技术的原理首先是利用细胞外溶液中的水分结冰使溶液的浓度升高,细胞内的水分透过细胞膜向外渗出,细胞体积收缩,细胞内液的浓度与渗透压增加,冰点下降;随着温度的下降,上述过程持续进行,到一定的温度时结冰,并在此温度下长期保存。当细胞内液在零下某一温度结冰时,溶液先是凝结成小冰晶,细小的冰晶对细胞损害较少,但小冰晶表面势能大,往往互相结合成大冰晶,造成细胞结构的破坏,该现象易发生在-15 ℃至-60 ℃范围内[4]。由于细胞在冷冻和解冻过程中要经历两次冰晶生成带来的损伤,常导致细胞坏死,是慢速冷冻技术难以避免的缺点。为降低冰晶损伤,通常可在慢速冷冻过程中使用低浓度的保护剂,同时通过精准的程序降温来减少冰晶生成。但是保护剂通常带有细胞毒性,缓慢程序降温对设备要求较高,限制了该技术的推广应用。
快速冷冻法是目前常用的生殖细胞冻存方法,如常用的玻璃化冷冻技术,是指将高浓度的冷冻保护剂在超低温环境下迅速凝固,形成不规则的玻璃化样固体,保存了细胞在液态时正常分子和离子分布,对细胞结构及胞内组分起到保护作用,实现低细胞损伤冷冻保存。目前,玻璃化冻存降温速率被认为应大于1 500 ℃·min-1[5]。玻璃化冷冻技术操作简单,能有效避免胞内冰晶的形成,从而降低细胞因形成冰晶而导致的各种物理及化学损伤。然而,快速冷冻过程中添加的高浓度冷冻保护剂本身具有较大的细胞毒性作用,会造成一定的细胞损伤。由于快速冷冻法操作相对简便,冷冻形成的损伤相对较小,设备要求较为简单,已经成功应用于不同动物的精子、卵子和胚胎保存[6-7];而冷冻速率和冷冻保护剂浓度的优化成为快速冷冻法的研究热点。
1 精子冷冻保存技术
脊椎动物的精子冷冻保存技术研究报道较为常见,冷冻方法也较为成熟。抗冻液的应用是精子冻存技术的关键,抗冻液可以提高精子冷冻保存的成活率,主要包括精子稀释液和冷冻保护剂。精子稀释液主要是由一些盐(NaCl、KCl、NaHCO3)和蒸馏水组成[8],所含的渗透性保护剂可以与水溶剂发生水合反应,增加溶液的粘性,从而在一定程度上抑制冰晶的产生,最终达到保护细胞和抗冻的效果。精子冷冻稀释液要求不能激活精子,主要成分可以分为盐类、糖类、脂类、蛋白质以及其他添加剂等成分,加蒸馏水按不同的比例配制而成[9]。
冷冻保护剂分为渗透性和非渗透性2 种,它们均可降低溶液冰点和电解质浓度,减少冰晶的形成。渗透性的冷冻保护剂一般是小分子物质,主要有二甲基亚砜(dimethyl sulfoxide,DMSO)、甘油(glycerine,GLY)、甲醇(methanol,METH)、乙二醇(ethylene glycol,EG)、丙二醇(propylene glycol,PG)、二甲基甲酰胺(dimethylformamide,DMF)和二甲基乙酰胺(dimethylacetamide,DMA)等,其渗透(平衡)到胞内的时间因冷冻材料和冷冻保护剂种类而不同。渗透性保护剂经常被用来增强膜流动性并使细胞部分脱水,导致凝固点降低,减少细胞内冰晶形成数量和大小。然而,渗透性的冷冻保护剂本身对精子具有毒性作用,具体应用需要对特定保存对象进行技术优化。非渗透性冷冻保护剂也称膜外保护剂,如果糖(Fructose)、蔗糖(Sucrose,SUC)、海藻糖(trehalose,TRE)蜂蜜和一些高分子化合物,如聚乙烯吡咯酮(polyvinylpyrrolidone,PVP)、右旋糖酐(Dextran)、卵黄(Yolk)、白蛋白(Albumin)等,这类物质不能穿过精子细胞膜,其作用是通过维持细胞膜的稳定来保护精子。非渗透性冷冻保护剂能够提高细胞外渗透压,在冷冻过程中使细胞内的水分快速向细胞外渗出,减少细胞内水分,从而减少细胞内冰晶形成,保护细胞免遭因冰晶形成而造成的机械损伤。另外,在冷冻精液复温时,由于非渗透性保护剂在细胞外液形成的高渗浓度,可以有效防止水分快速进入细胞引起的肿胀破坏脊椎动物精子的冷冻保存。
1.1 脊椎动物精子冷冻保存技术
由于鱼类精子个体小,抗冻剂容易进入其内,冷冻保存较易成功。鱼类精子冷冻保存关键步骤在于冷冻保存前的平衡时间和温度、降温速率及复苏条件等,由于这些问题比较杂,各学者之间的看法不尽相同,所采用的方法也不完全一致。以8.3%甲醇作为冷冻保护剂,将斑马鱼Danio rerio 精子用-16 ℃·min-1的速率从4 ℃降到-35 ℃,并采用室温复苏的方法,得到了36%的受精率[10]。改变降温速率和复苏条件,可以提高精子的存活率。用-10 ℃·min-1的速率从5 ℃降到-80 ℃,40 ℃水浴5 s 解冻,得到(33±20)%的存活率[11]。改进斑马鱼精子冻存降温程序和保护剂类型,可以提高其受精率[12]。精子在冷冻过程中除了受到冷休克、冰晶体的形成和渗透压的变化的影响外,精子的生存和运动依赖糖酵解和线粒体氧化磷酸化提供能量,精子代谢会导致精细胞内活性氧自由基(Reactive Oxygen Species,ROS)过量,破坏精子质膜和DNA 的完整性。在实践中,通常在精子稀释液中添加抗氧化剂,防止ROS 对精子产生毒害作用从而降低精子质量。常用的抗氧化剂包括超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、维生素C、维生素E、半胱氨酸(Cystine,Cys)、麦角硫因(Ergosterol,EGT)和其他抗氧化剂。维生素C 具有强还原性,可有效防止ROS 过量造成的对精子的危害。有研究表明在波尔山羊冻精稀释液中添加维生素C,可提高解冻后精子质量和受精率[13-14]。另外,在绒山羊精子稀释液中添加葡萄糖(Glucose,Glu)可以促进冷冻解冻过程中的代谢,提高绒山羊精子冷冻保存效果[15]。通过最小化冷却体积可以实现降低渗透性冷冻保护剂浓度的目标,由于大多数无冷冻保护剂玻璃化中的精子悬浮液体积相对较大,这种技术难以实现。通过评估运动性,细胞质膜完整性和线粒体膜完整性分析玻璃化前后精子的质量,MERINO,et al[16]认为含有1% BSA 加40%精浆的鱼精子的无冷冻保护剂玻璃化是最有希望的。
1.2 无脊椎动物精子冷冻保存技术
慢速冷冻法也广泛应用于其他海洋无脊椎动物精子冻存中。使用二甲基亚砜作为冷冻保护剂,-6 ℃·min的速率降到-80 ℃,再以10~15 ℃·min-1的速率复苏到室温,可以得到13%~33%的海胆Pseudocentrotus depressus 受精率[17];使用同样的方法保存紫海胆Anthocidaris crassispina 精子,得到10%有活力的精子[18]。改变降温速率和复苏方式可以提高受精率,同样使用二甲基亚砜作为冷冻保护剂,保持在液氮上方6 cm处,37 ℃水浴复苏后得到76%有活力的仿刺参Apostichopus japonius 精子[19],5%二甲基亚砜+1 mol·L-1海藻糖;在液氮中保持15 min;25 ℃,30 s 水浴复苏,得到89%有活力的珠母贝精子[20]。选择合适的冷冻保护剂可以提高冻存效率,添加0.5 mol·L-1的海藻糖,浓度为12%的二甲基亚砜作为冷冻保护剂,绿唇贻贝Perna canaliculus 精子解冻后具有高达60%的受精率,而采用6%二甲基亚砜加1%甘氨酸作为保护剂,可以将受精率进一步提高到84%[21]。目前研究报道的部分冷冻保存方案和活力评估数据见表1。
2 卵母细胞冷冻保存技术
卵母细胞冷冻保存技术与精子冻存方法差异较大。哺乳动物卵母细胞的体积比精子的体积大3~4 个数量级,因此大大降低了比表面积,使其对冷却和细胞内冰晶的形成非常敏感。当卵母细胞暴露于高浓度的冷冻保护剂时会因为细胞毒性和渗透而遭受破坏,这种毒性作用的大小与细胞暴露于冷冻保护剂的持续时间、细胞在冷冻保护剂中的平衡温度、温度下降速度以及卵母细胞本身的大小等因素密切相关。因此,成功实现卵母细胞玻璃化和冷冻保存,其关键在于确定使用合适浓度的冷冻保护剂,在毒性和冷冻损伤防御之间取得平衡而达到最大的冷冻保护效果。
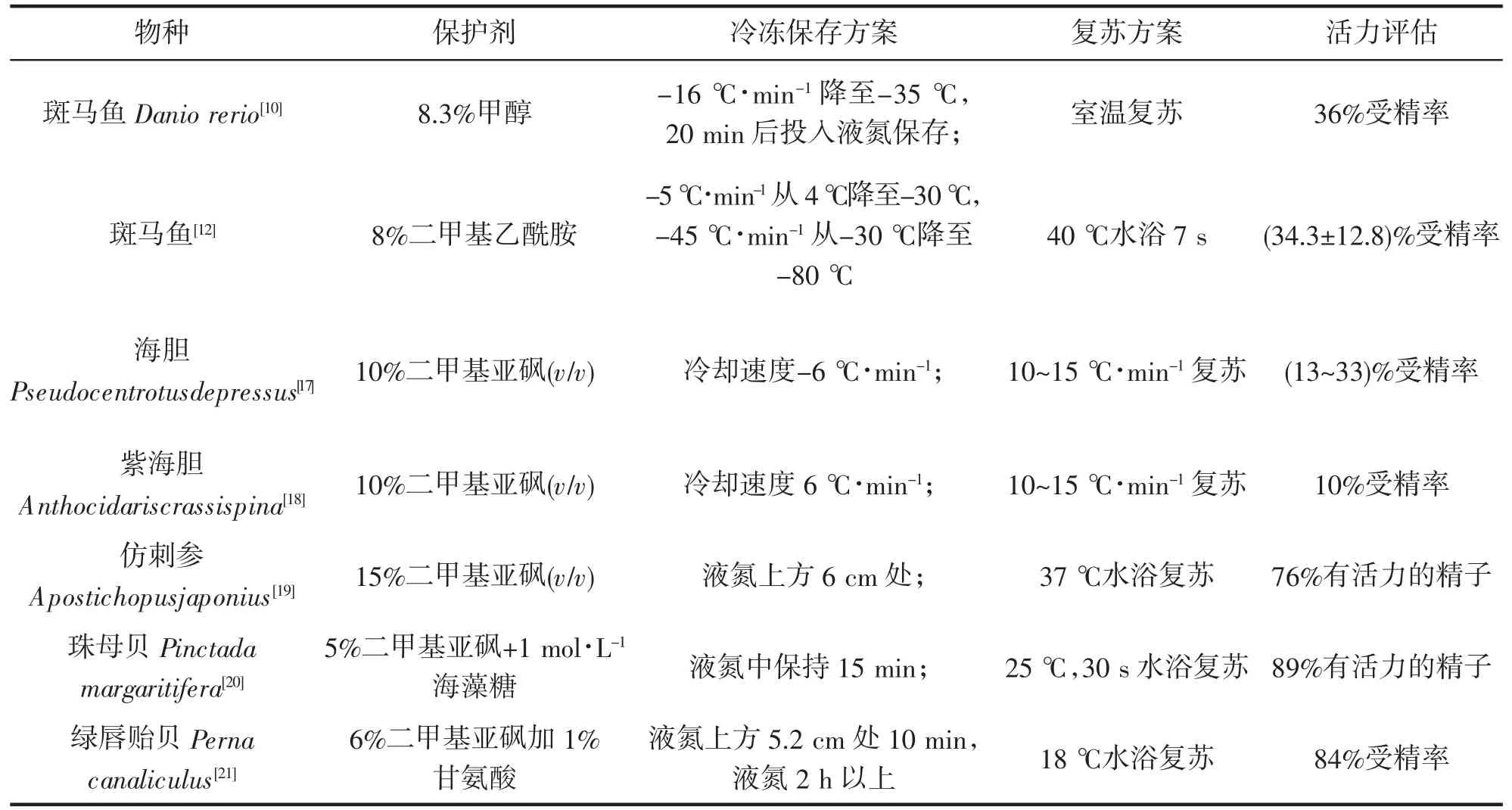
表1 精子冷冻保存方案及活力评估举例Tab.1 Examples in sperm cryopreservation
卵母细胞玻璃化过程和升温过程中,主要受损部位在于其细胞骨架。卵母细胞的细胞骨架主要由微管、微丝和中间纤维等构成,在卵母细胞的成熟、受精及早期胚胎发育中发挥了重要作用[22-23]。研究表明,长时间暴露在冷冻保护剂和低温中可能会导致微管的破坏,引起卵母细胞减数分裂时纺锤体形态的变化[24]。对于脊椎动物卵母细胞中,玻璃化的方法已经被用于多种物种[25-27]。冻存时间对卵母细胞复苏后的存活率有很大影响,冻存时间越长,存活率、受精率和胚胎发育率越低[28]。目前在卵母细胞玻璃化冷冻的相关研究中,常采用梯度平衡法进行预平衡。首先在不同浓度的保护剂中进行梯度平衡,之后再直接将卵母细胞投入液氮中进行保存。梯度平衡法所用的冷冻保护剂通常是只含有单种或少数几种冷冻保护剂联合的渗透性保护剂,且浓度较低,因此对卵细胞的毒性和损伤较小。
2.1 脊椎动物卵母细胞冻存技术
脊椎动物卵母细胞的冻存通常采用两步法进行,即首先通过缓慢降温至一定低温,然后快速降温至-196 °C。该方法具有较好的应用,如在牛卵母细胞冻存中,使用两步冷冻法保存的卵子受精后的怀孕率在50%~60%之间[29]。而比较慢速冷冻法和玻璃化法冻存小鼠卵母细胞,发现两种冷冻方法均会损伤卵巢内各级卵母细胞,慢速冷冻法对卵巢组织的伤害更小一些[30]。
天然氨基酸L-脯氨酸是冷冻保护剂的理想候选物,因其高溶解度,中性pH、高渗透压、高浓度下无毒等特点,而被归类为渗透保护剂和抗氧化剂。有报道称L-脯氨酸可作为小鼠卵母细胞玻璃化冷冻保护剂,保护线粒体功能,提高玻璃化卵母细胞的存活率[31]。此外,单一或复配的亲水性有机溶剂也是玻璃化冷冻保护剂的主要候选物。如ZHOU Chengjie,et al[32]等比较了4 种不同浓度的冷冻保护剂(二甲基亚砜、甘油、乙二醇、丙二醇),发现使用20%乙二醇+20%二甲基亚砜适用于小鼠卵母细胞的冻存,复苏后有65.0%±3.5%的卵母细胞存活;SANTOS,et al[33]比较了乙二醇和丙二醇对未成熟猪卵母细胞玻璃化的影响,结果发现35%丙二醇使玻璃化冻存后卵母细胞存活率更高。然而,丙二醇对卵母细胞有很大毒性,对乙二醇和丙二醇进行复配使用时效果较好,如17.5%乙二醇和17.5%丙二醇的组合产生合理的存活率,对胚胎发育损伤较小。
水生动物卵母细胞冻存有其独特性和技术困难,研究鱼卵细胞内水分分布及提高卵膜通透性、使用合适的玻璃化液浓度和降低玻璃化液毒性,是成功冻存鱼卵细胞的前提。由于鱼类卵母细胞的细胞膜渗透性低,及卵母细胞的高度低温敏感性,大大影响了鱼类卵母细胞玻璃化的研究进展。同时,因为有大量卵黄的存在,影响玻璃化液进入卵细胞,导致鱼卵在平衡液中的时间延长,玻璃化液自身毒性可能造成鱼卵细胞死亡[34]。
不同品种鱼类卵细胞对保护剂的敏感性差异较大。方晨等[35]使用含1.5 mol·L-1甲醇、6.0 mol·L-1乙二醇和0.25 mol·L-1蔗糖的冷冻保护剂,采用两步平衡法进行平衡后冷冻保存斑马鱼卵母细胞,并在37 ℃复苏后采用四步洗涤法去除冷冻保护剂,结果表明可得到(48.89±2.58)%的卵母细胞存活率。而Digmayer[36]发现,采用慢速程序降温(-1 ℃·min-1)策略以及由1.6 mol·L-1甲醇和0.25 mol·L-1蔗糖组成的冷冻保护剂,对大盖巨脂鲤Colossoma macropomum 卵母细胞进行冷冻保存时,复苏后可以观察到具有完整透明带的卵母细胞,但是无法成功受精。
2.2 无脊椎动物卵母细胞冷冻保存技术
由于卵母细胞,特别是在海洋无脊椎动物的卵母细胞对低温存在敏感性,因此常用的冻存方法是程序性降温,使用缓慢的降温速率或者两步降温法,最后将样品存于液氮保存。相关技术研发一般是针对冷冻保护剂的选择和比例优化。在海洋无脊椎生物中,最常用的冷冻保护剂是10%乙二醇。TERVIT,et al[37]使用10%乙二醇作为冷冻保护剂,用两步冷冻法进行冻存后使用28 ℃水浴复苏太平洋牡蛎Crassostrea gigas卵母细胞得到74.5%的受精率,其中30%发育成担轮幼虫;ADAMS,et al[[38]仅改变降温速率,将太平洋牡蛎的担轮幼虫发育率提高到50%。而ADAMS,et al[39]使用与TERVIT 采用的相同冷冻方法和复苏方法,在冷冻保护剂中添加了0.4 mol·L-1的海藻糖后,复苏新西兰绿唇贻贝Perna canaliculus 的担轮幼虫率仅有1%。YANG,et al[40]认为使用一步缓慢降温冷冻法(-1.5 ℃·min-1)配合2 mol·L-1二甲基亚砜作为冷冻保护剂最适宜鲍鱼Haliotis diversicolor 卵母细胞的低温保存,并得到48.8%的卵母细胞存活率和24%的孵化率。目前研究报道的部分卵母细胞冷冻保存方案和活力评估数据见表2。
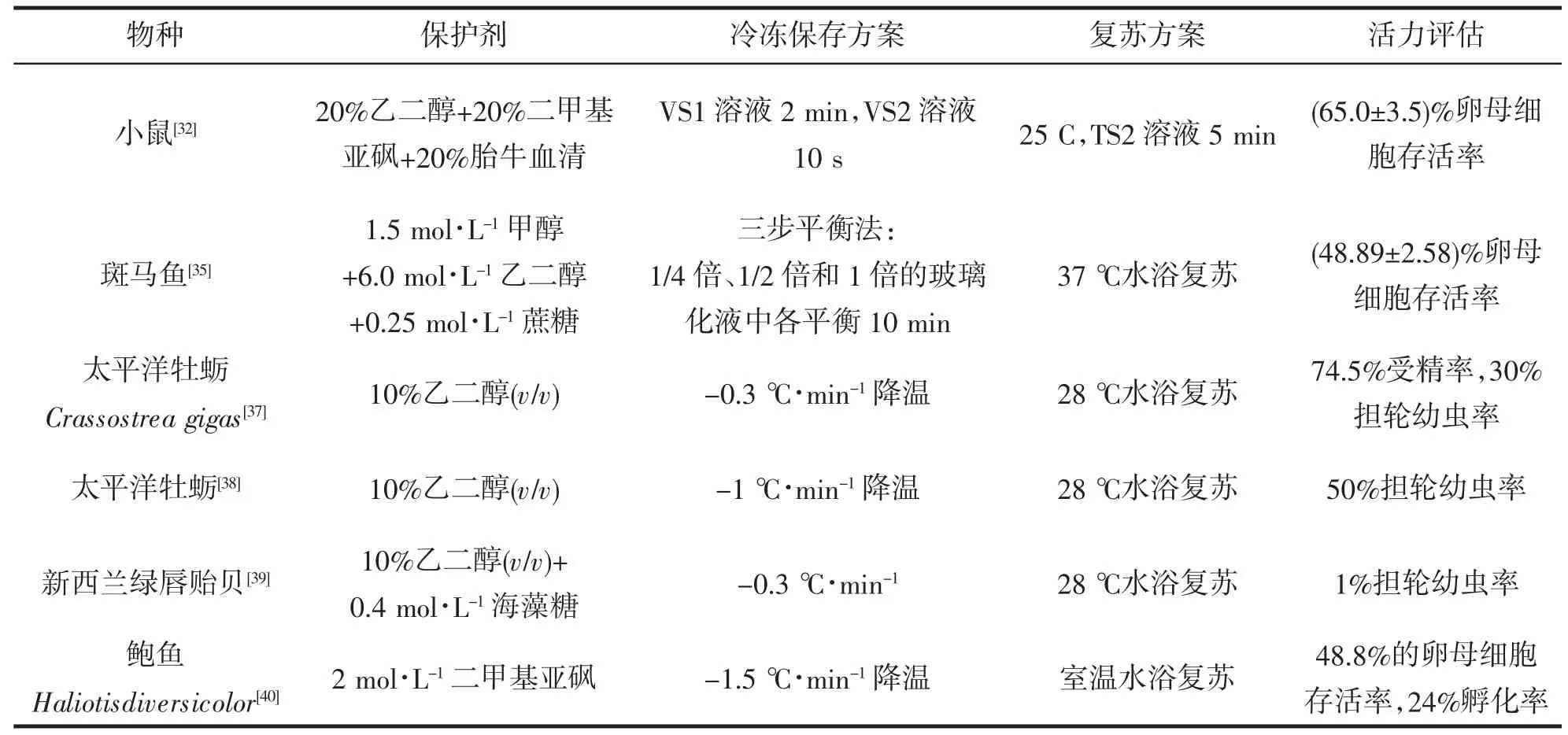
表2 卵母细胞冷冻保存方案及活力评估举例Tab.2 Examples in oocyte cryopreservation
3 胚胎冷冻保存技术
胚胎冷冻是继动物精液冷冻保存后研究成功的又一项细胞冷冻保存技术,从保护的角度考虑,胚胎冷冻具有保留父母双方遗传信息的优点。到目前为止,已有数十种动物的胚胎冷冻保存获得成功,但物种之间的差异使得单一低温保存技术的推广应用变得困难重重。这种差异包括不同物种对冷冻保护剂的敏感性不同、最佳胚胎阶段不同以及梯度降温程序不同等。另外,包裹着胚胎的透明带可以作为天然屏障,阻碍冷冻保护剂在胚胎中自由流动,因此,要实现胚胎冷冻保存的大规模成功,将面临更多的挑战。一般认为,影响冷冻胚胎复苏后活力的主要因素是胚胎的脂类含量,但是,胚胎冷冻和复苏的速度、胚胎的大小和发育程度、胚胎的渗透特性以及冷冻保护剂的渗透特性和毒性也在很大程度上影响了胚胎的冷冻保存的效果。
3.1 脊椎动物胚胎冷冻保存技术
目前研究认为,不同冷冻保护剂对胚胎冻存影响较大,LIU,et al[41]等用丙二醇、乙二醇和甘油作为冷冻保护剂,并分别评价了慢速冷冻和玻璃化冷冻法对小鼠8 细胞胚胎冻存的影响,结果表明丙二醇更适合8 细胞慢速冷冻,而乙二醇更适合于玻璃化冷冻。不同发育阶段的胚胎对冷冻保护剂的耐受性也不相同,已有研究证明,随着胚胎的发育,大鼠胚胎细胞对冷冻保护剂的耐受性也越来越高,而4 细胞阶段和8 细胞阶段的小鼠桑葚胚更适合玻璃化冻存[42]。OHAOSHI,et al[43]评价了四种冷冻保护剂(聚乙二醇、牛血清白蛋白、聚乙烯吡咯烷酮和水溶性聚蔗糖),发现使用两步法将胚胎暴露于保护剂中,并使用添加聚乙二醇的冷冻保护剂适用于牛胚胎的冻存,有助于提高体外存活率。TIAN,et al[44]比较2 种冻存液(PMG3T、PMG3S)对石斑鱼Epinephelus moara 胚胎的影响,发现两种冻存液均适用于石斑鱼胚胎冻存,使用40% PMG3S 复苏的胚胎存活率更高(63.36%)。
3.2 无脊椎动物胚胎冷冻保存技术
LI Kang,et al[45]评估了萤火虫Coleoptera:Lampyridae 胚胎玻璃化冻存的三种平衡过程,认为通过三步平衡法并使用添加0.5 mol·L-1海藻糖的冷冻保护剂可以得到更高的胚胎存活率(71.8±2.7)%。GUIGNOT,et al[46]研究了西方蜜蜂Apis mellifera 胚胎的冷冻保存方法,比较了低温保存前胚胎制备的三个不同条件,并收集了冬季和春季的蜜蜂胚胎,结果显示超声波导入法处理胚胎细胞可以使孵化率达到25%,并认为季节对胚胎冷冻保存起到一定影响作用。在海洋无脊椎动物胚胎冻存研究中,确定冷冻保护剂的组合方式同样是至关重要的。PAREDES,et al[47]对海胆Paracentrotus lividus 胚胎的低温保存研究首次寻找到适合冷冻海胆卵细胞和胚胎的冷冻保护剂组合,并确定了可以得到更高孵化率的慢速冷冻速率。他们认为最有效的冷冻保护剂组合是1.5 mol·L-1二甲基亚砜加0.04 mol·L-1海藻糖,通过4 ℃初始保持2 min,然后以-1 ℃·min-1冷却至-12 ℃,此时加入胚胎,保持2 min,再以-1 ℃·min-1至-80 ℃下进行第二次冷却,最后保持2 min 后,将冷冻管转移到液氮中储存,获得了较为理想的冻存效果。PAREDES,et al[48]还认为,配制海胆胚胎冷冻保护剂需要区别于其他海洋无脊椎动物,不应该使用超纯水作为溶剂,使用超纯水的实验组解冻后的胚胎孵化率为零。目前研究报道的部分胚胎冷冻保存方案和活力评估数据见表3。

表3 胚胎冷冻保存方案及活力评估举例Tab.3 Examples in embryo cryopreservation
4 生殖细胞及胚胎冷冻保存的意义
(1)遗传育种研究:冷冻精子可以为不同繁殖期或地理间隔的种系交配提供条件,扩大杂交组合的范围。可以克服杂交育种不能自然交配的困难,为遗传育种研究长期不间断地提供精子材料,在性别控制以及以精子作载体生产转基因物种等方面具有应用价值。
(2)养殖:利用生殖细胞的冷冻技术,可以长期保存野外采集的配子,为野生种和养殖种人工授精提供条件,避免养殖群体近交交配所造成的性状衰退,达到提纯复壮、提高养殖产量的目的。此外,精子冷冻在克服人工繁殖中雌雄亲体成熟不同步、扩大苗种生产等方面也很重要。
(3)种质资源保护:通过生殖细胞冷冻保存技术,将一些名贵、优良、濒危种质的生殖细胞或胚胎,长期、有效地保存起来,即建立种质遗传库,用以人工授精所需,可将这些基因资源保存下来,为种质资源保护开辟了一条新的途径。
生殖细胞的低温保存具有巨大的科学研发潜力和生产应用价值。目前关于精子冻存的研究已经相对成熟,而对于卵母细胞和胚胎细胞的冷冻保存技术仍需要进一步优化。由于现阶段仍缺乏生殖细胞冷冻保存的标准化方法,因此对于从冷冻保存试剂的搭配、平衡液的选择,到慢速冻存和快速冻存等具体冻存条件等方面的探索,将有助于进一步了解和探索生殖细胞冻存的关键科学问题和技术要点,为各物种的活体生理学搭建平台,也为种质繁育和保存提供一定的理论及实践参考。

