电位滴定法测定苯乙烯中的总醛含量
凡 瑞 红
(中国石化集团资产经营管理有限公司巴陵石化分公司分析检验中心,湖南 岳阳 414014)
苯乙烯是一种重要的有机化工原料,主要用于生产树脂、塑料和合成橡胶,在国民经济中占有重要地位。工业用苯乙烯作为石油化工的基础产品,其醛酮类化合物的存在会对苯乙烯下游工艺产生影响,它不仅加快苯乙烯单体对金属的腐蚀,降低苯乙烯聚合物的相对分子质量,还能和催化剂作用生成络合物,影响苯乙烯聚合反应[1]。因此,对其指标必须加以严格控制。
原测定苯乙烯中总醛含量采用GB/T 12688.5—2011《工业用苯乙烯试验方法 第5部分:总醛含量的测定 滴定法》[2],该方法使用手动滴定法,滴定终点会由于个人差异造成一定的误差,且测定过程中滴定溶液是未封闭状态,苯乙烯试样及使用的有机溶剂有一定的挥发性和刺激性,给分析工作人员操作时带来很大不便。因此,现有方法标准GB/T 12688.5—2019[3]代替了GB/T 12688.5—2011,该标准增加了电位滴定法测定苯乙烯中总醛含量。作者参照GB/T 12688.5—2019,通过实验优化了电位滴定法测定苯乙烯中总醛含量的操作条件,结果表明,该分析方法的准确度较高,且测定结果的相对标准偏差小于0.5%,分析速度明显优于手动滴定法,有利于苯乙烯产品质量监控。
1 实验
1.1 试剂及试样
无水甲醇、氢氧化钾:分析纯,天津致远化学试剂有限公司产;盐酸羟胺:分析纯,南京化学试剂有限公司产;苯甲醛:色谱纯,成都博瑞特化学技术有限公司产;酚酞指示液:天津市科密欧化学试剂有限公司提供;邻苯二甲酸氢钾:基准物,中国医药集团上海化学试剂公司提供;苯乙烯:1#,2#,3#,4#,中国石化巴陵石化公司炼油部生产。
1.2 主要仪器
T-50全自动电位滴定仪:带10 mL定量管,瑞士梅特勒-托利多集团制。
1.3 原理
将盐酸羟胺甲醇溶液加到苯乙烯试样中,试样中的活泼醛与盐酸羟胺发生如下反应,生成的盐酸的量和试样中醛类的量相当。
RCHO+NH2OH·HCl→RCHNOH+H2O+HCl
(1)
用氢氧化钾-甲醇标准滴定溶液滴定反应生成的盐酸,测得苯乙烯中总醛含量。总醛含量以苯甲醛形式进行计算和报告。
1.4 实验方法
1.4.1 溶液的配制和标准溶液的标定
20 g/L盐酸羟胺-甲醇溶液的配制:将20 g盐酸羟胺溶于1 L甲醇中,按GB/T 12688.5—2019中的5.1.6进行处理。
0.02 mol/L氢氧化钾-甲醇标准溶液的配制和标定[3]:称取6.6 g氢氧化钾溶于1 L甲醇中。将基准试剂邻苯二甲酸氢钾置于105~110 ℃烘箱中干燥至恒重。称取0.6 g邻苯二甲酸氢钾,准确至0.000 1 g,溶于50 mL无二氧化碳的水中,加2滴酚酞指示液,用配制的氢氧化钾-甲醇标准溶液滴定至溶液呈粉红色,同时做空白实验,计算出氢氧化钾-甲醇标准溶液的浓度(C)。使用时将此溶液稀释5倍。
C=(m×1 000)/((V3-V4)×204.22)
(2)
式中:m为邻苯二甲酸氢钾的质量;V3为标定时消耗的氢氧化钾-甲醇标准溶液的体积;V4为空白实验时消耗的氢氧化钾-甲醇标准溶液的体积;204.22为邻苯二甲酸氢钾的摩尔质量。
0.020 0 mol/L苯甲醛-甲醇标准溶液的配制: 称取2.122 4 g色谱纯的苯甲醛,用甲醇稀释定容至1 L容量瓶内。
1.4.2 试样的测定
(1)用移液管吸取一定体积的苯乙烯试样,加入滴定烧杯中,再依次加入25 mL甲醇、0.2 mL水、25 mL盐酸羟胺-甲醇溶液,在搅拌速率为30%,搅拌0.5 h的条件下,用0.02 mol/L氢氧化钾-甲醇标准溶液滴定,直到出现第一个等当点,记录消耗的氢氧化钾-甲醇标准溶液体积(V5)。
(2)用25 mL甲醇溶液做空白实验,记录消耗的氢氧化钾-甲醇标准溶液体积(V6)。
(3)再用移液管吸取一定体积的苯乙烯试样,加入滴定烧杯中,再依次加入25 mL甲醇、0.2 mL水,不搅拌直接滴定,以测定苯乙烯中的酸,记录消耗的氢氧化钾-甲醇标准溶液体积(V7)。
1.4.3 结果计算
试样中的总醛(以苯甲醛计)含量(ω)按下式(3)计算:
(3)
式中:V8为苯乙烯试样的体积;ρ为苯乙烯试样的密度;106.12为苯甲醛的摩尔质量。
2 结果与讨论
2.1 试剂及溶液的保存时间的确定
实验中所配制并使用的溶液主要有:0.02 mol/L的氢氧化钾-甲醇标准滴定溶液、0.020 0 mol/L苯甲醛-甲醇标准溶液、中和酸之后的盐酸羟胺-甲醇溶液。这3种溶液中的稀释溶剂是甲醇,有较大的挥发性。在试样测定过程中,甲醇会挥发,尤其是在高温天气下挥发性极其明显,会造成氢氧化钾-甲醇标准滴定溶液浓度变高。空气中二氧化碳的入侵也会存在一定的干扰因素。这些因素都会影响测定结果的准确性。因此在进行此实验时,必须控制此3种配制溶液的保存时间,通过查阅文献[4]及实验数据验证,此实验中所用到的氢氧化钾-甲醇标准溶液和中和酸之后的盐酸羟胺-甲醇溶液有效期要求在10 d左右,苯甲醛-甲醇溶液一般为现配现用。
2.2 搅拌时间的确定
移取25 mL苯乙烯试样于滴定烧杯中,再依次加入25 mL甲醇、0.2 mL水、25 mL盐酸羟胺-甲醇溶液,在搅拌速率为30%时,调整不同的搅拌时间,使苯乙烯试样中的活泼醛与盐酸羟胺充分反应,然后用氢氧化钾-甲醇标准滴定溶液滴定,其V5与搅拌时间的关系见图1。
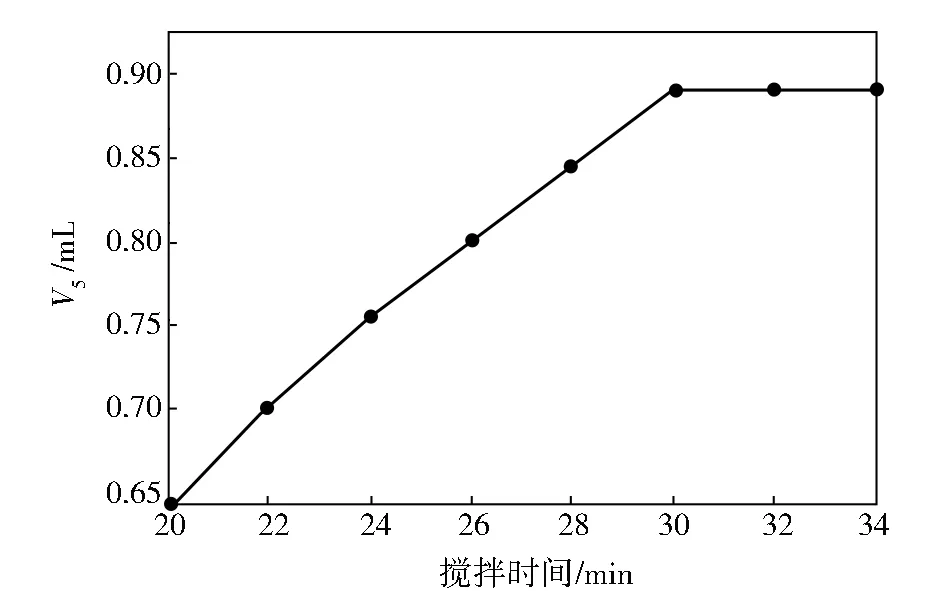
图1 搅拌时间对滴定结果的影响
由图1可知:当搅拌时间低于30 min时,V5不断增加,表明该试剂在30 min内一直在发生化学反应生成盐酸;当反应时间超过30 min时,每次所耗V5保持稳定,表明试样中的活波醛与盐酸羟胺反应完全,全部转化成等量的盐酸,因此,在实验过程中,苯乙烯试样和其他试剂加入滴定烧杯后,必须搅拌至少30 min,以使其充分反应。
2.3 搅拌速率的影响
移取25 mL苯乙烯试样于滴定烧杯中,依次加入25 mL甲醇、0.2 mL水、25 mL盐酸羟胺-甲醇溶液,搅拌0.5 h,用0.02 mol/L氢氧化钾-甲醇标准滴定溶液滴定,调整搅拌速率,测试所得的苯乙烯中的ω,结果见表1。从表1可知:搅拌速率为25%和35%时,所测苯乙烯试样的ω结果相差较大,即平行性不好;而搅拌速率为30%时,所测ω的结果比较平行。这是因为搅拌速率慢时,滴定管内不易产生气泡,但滴定烧杯中的溶液会因为搅拌不匀造成反应不充分;搅拌速率快时,滴定烧杯中的溶液会溅至杯壁上造成试样损失从而影响测定结果。因此,本实验选择搅拌速率为30%,此时滴定烧杯内的溶液有明显的旋转且不产生旋涡,且测定结果平行性好。

表1 不同搅拌速率下ω的测定结果
2.4 滴定曲线与终点电位(Eep)的确定[5]
移取0.020 0 mol/L苯甲醛-甲醇标准溶液5 mL于烧杯中,再依次加入25 mL甲醇、0.2 mL水、25 mL盐酸羟胺-甲醇溶液,搅拌速率为30%,搅拌0.5 h,使用电位滴定仪进行测定,记录实验溶液的电位(E)和V5,且以V5为横坐标,E为纵坐标,绘制E-V5滴定曲线,结果如图2a所示。
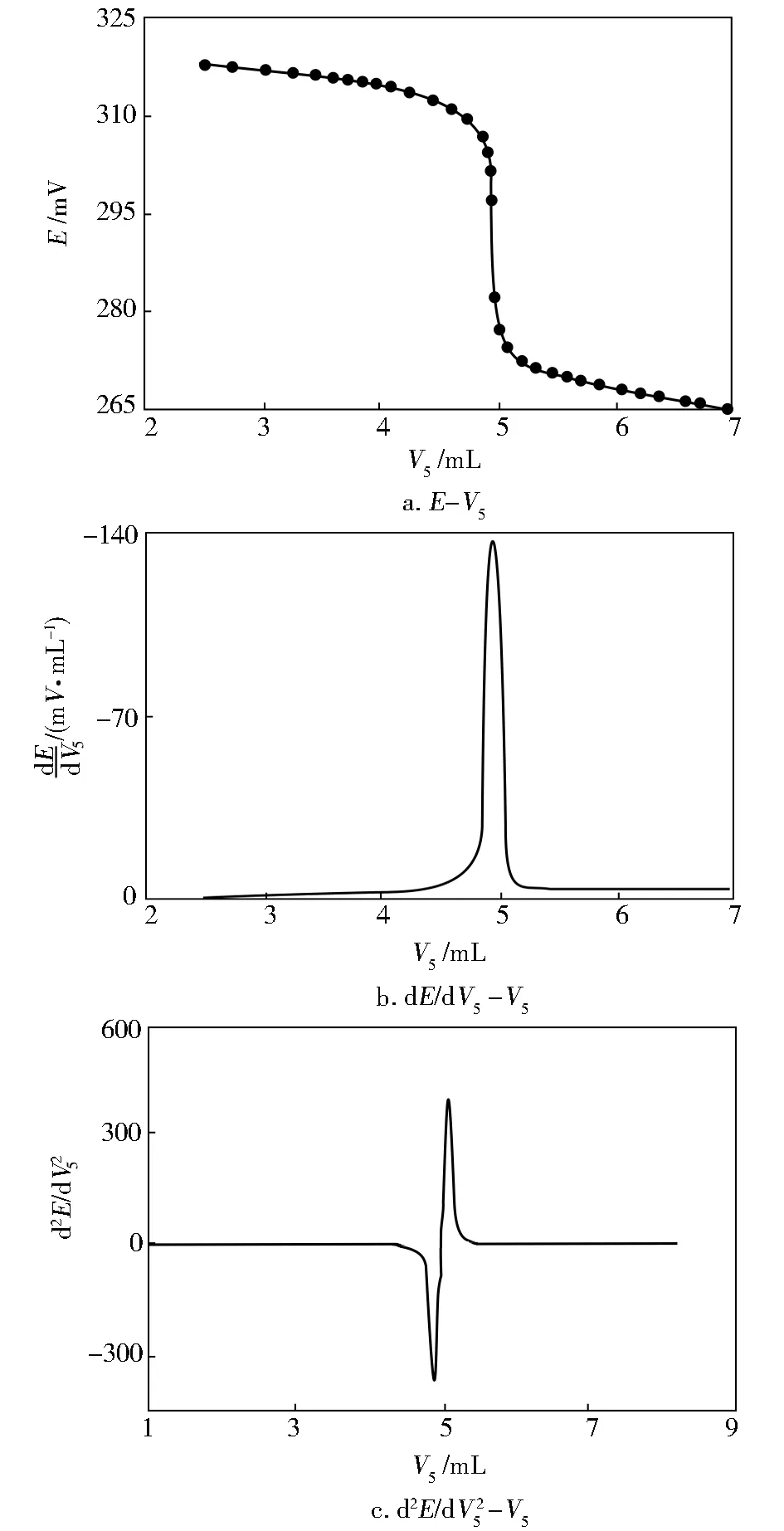
图2 电位滴定曲线

2.5 方法的准确度
称取一定量的苯乙烯试样于滴定烧杯中,按1.4.2中的操作步骤进行试样的ω测定,然后加入一定量的色谱纯苯甲醛,进行加标回收实验,测量结果见表2。

表2 加标回收率实验结果
由表2可以看出,苯乙烯试样中的ω测定的加标回收率为97.14%~103.33%,说明使用全自动电位滴定仪测定苯乙烯试样中的ω准确度较高。
2.6 方法的精密度
对4批苯乙烯试样分别平行测定6次,其ω的测定结果列于表3。由表3可看出,ω测定结果的相对标准偏差(RSD)为0.000~0.477%,表明该方法的精密度,重复性好。
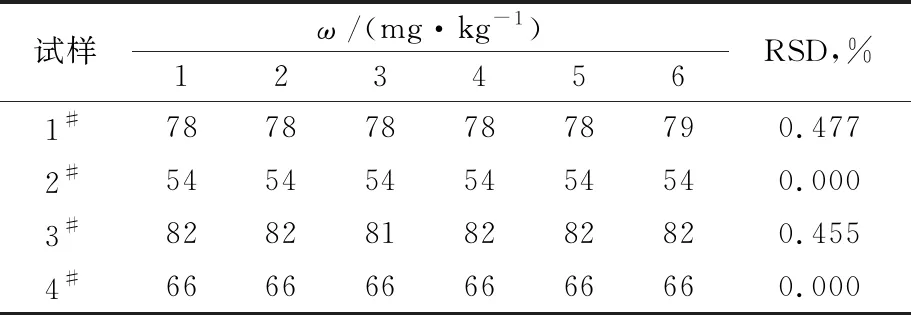
表3 精密度实验结果
3 结论
a. 建立了电位滴定法测定苯乙烯中的ω,在确保分析试剂准确有效的前提下,滴定过程中滴定杯中的溶液搅拌时间为30 min,搅拌速率为30%,Eep为295 mV时,使用全自动电位滴定仪测定苯乙烯试样中的ω,其加标回收率为97.14%~103.33%,RSD为0.000~0.477%。
b. 该方法在测定过程中滴定溶液盛装在滴定杯中,与滴定架完全密封结合,减少了试样及有机试剂的挥发。
c. 滴定终点的判断是依据试样在第一个等当点附近的电位突跃,仪器进行自动检测,较之手动滴定通过对颜色变化进行终点判断,产生的误差明显小一些,因此电位滴定法测定结果更准确。
d. 电位滴定法测定苯乙烯中的ω,具有分析速度快、精密度高、操作简便等优点。

