miR-299-5p靶向RRS1调控胃癌细胞增殖、凋亡的分子机制
郭令飞 罗德红 葛华 王灿
(遵义市第一人民医院 1胃肠外科,贵州 遵义 563000;2肿瘤科)
从分子水平探究胃癌发生进展过程相关的作用靶点对提高治疗效果及改善患者预后均具有重要临床意义〔1〕。研究显示微小RNA(miRNA)可参与肿瘤细胞增殖、分化及凋亡等生物学过程〔2〕。miRNA-299-5p在甲状腺癌、结直肠癌等多种恶性肿瘤中呈低表达,上调miRNA-299-5p表达后可抑制肿瘤细胞迁移及侵袭〔3,4〕。通过靶基因预测软件预测核糖体合成调控因子(RRS)1是miRNA-299-5p的靶基因,RRS1广泛分布于真核细胞且属于一种细胞核蛋白,同时可促进机体内蛋白质分泌及核糖体合成等生理过程〔5〕。相关研究报道,敲低RRS1基因后,核糖体蛋白RPL11释放量增加且与E3泛素连接酶(MDM)2结合进而促进p53蛋白合成最终促使肿瘤细胞凋亡〔6〕。但miRNA-299-5p与RRS1在胃癌中作用的研究相对较少,本研究拟分析miRNA-299-5p对胃癌细胞增殖及凋亡的影响及其可能作用机制,并证实miRNA-299-5p与RRS1的靶向关系。
1 材料与方法
1.1材料与试剂 胃癌细胞株BGC-823、MKN45、MGC803与正常胃上皮细胞株GES-1均购自中国科学院上海细胞库。LipofectamineTM2000购自美国Invitrogen公司;miR-299-5p mimic及其阴性转染质粒均购自广州锐博生物技术有限公司;RRS1过表达质粒(pcDNA-RRS1)、对照质粒(pcDNA)、野生型及突变型RRS1基因3′UTR荧光素酶表达载体均购自上海吉玛制药技术有限公司;RRS1 siRNA(si-WWOX)与阴性对照siRNA(si-NC)均购自美国Santa Cruz公司;miR-299-5p抑制剂(anti-miR-299-5p)与anti-miR-NC均购自上海宾智生物科技有限公司;胎牛血清、RPMI1640培养基均购自美国Gibco公司;RRS1抗体及辣根过氧化物酶(HRP)标记的IgG二抗均购自美国CST公司;四甲基偶氮唑蓝(MTT)细胞增殖分析试剂盒购自美国Sigma公司;膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)细胞凋亡试剂盒购自北京博尔迈生物技术有限公司;二喹啉甲酸(BCA)试剂盒购自碧云天生物技术研究所;SYBR Green荧光染料试剂盒购自大连宝生物工程有限公司。
1.2细胞培养、转染及分组 人胃癌细胞株BGC-823、MKN45、MGC803与正常胃上皮细胞株GES-1均采用RPMI1640培养基(含10%胎牛血清)培养,放入恒温培养箱,每隔2 d更换培养基,培养3~5 d后进行传代培养。收集细胞,胰酶消化后接种至6孔细胞培养板,待细胞生长融合至50%~60%时更换不含胎牛血清RPMI1640培养基,继续培养12 h后进行转染。实验分为阴性对照组(miR-NC)与miR-299-5p组,其中miR-NC组将miR-NC质粒转染至BGC-823细胞;miR-299-5p组将miR-299-5p mimic转染至BGC-823细胞,转染后6 h更换为正常RPMI1640培养基,继续培养24、48、72 h,收集对数生长期细胞进行后续实验。将miR-NC质粒与si-RRS1转染至BGC-823细胞分别作为miR-NC组、si-RRS1组,转染及处理方法同上。为了证实miR-299-5p是通过抑制RRS1表达调控BGC-823细胞增殖及凋亡,将miR-299-5p mimic与pcDNA-RRS1共同转染至BGC-823细胞,检测RRS1是否可逆转miR-299-5p抑制细胞增殖及促进凋亡的作用,后续实验将分为miR-299-5p+pcDNA组、miR-299-5p+pcDNA-RRS1组,转染及处理方法同上。
1.3qRT-PCR检测细胞中miR-299-5p及RRS1 mRNA表达 根据Trizol试剂说明书提取各组BGC-823细胞总RNA,采用逆转录试剂盒将RNA合成cDNA,以cDNA为模板并参照SYBR Green荧光染料试剂盒进行qRT-PCR,循环反应40次,循环条件为:95℃ 30 s,60℃ 30 s,72℃ 30 s。miR-299-5p以U6为内参基因,RRS1以GAPDH为内参基因,收集并分析数据Ct值,采用2-ΔΔCt计算miR-299-5p、RRS1 mRNA相对表达量。
1.4Western印迹检测细胞中RRS1蛋白表达水平 收集各组BGC-823细胞,置于冰上加入RIPA蛋白裂解液提取细胞总蛋白,BCA定量,各组蛋白(样品量60 μg)均进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将已分离蛋白转移至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶封闭,90 min后加入RRS1(1∶500)蛋白一抗,Tis-HCI缓冲液(TBST)清洗3次,5 min/次,加入二抗(1∶1 000),室温孵育2 h,TBST冲洗3次,10 min/次,增强型化学发光试剂(ECL)显影,置于凝胶成像系统观察各条带并应用Image J软件分析条带灰度值。每组实验重复3次。
1.5MTT检测细胞增殖活力 分别收集miR-NC组、miR-299-5p组、miR-299-5p+pcDNA组、miR-299-5p+pcDNA-RRS1组、si-NC组、si-RRS1组对数生长期BGC-823细胞,胰酶消化后接种至96孔细胞培养板,细胞密度为5×103个/孔,于培养24、48、72 h时分别加入10 μl/孔MTT试剂,继续培养4 h,分别加入150 μl/孔二甲基亚砜(DMSO),置于恒温培养箱继续培养2 h,置于酶联免疫检测仪检测各孔在490 nm波长处光密度(OD)值即为细胞增殖活力,每组均设置3次生物学重复。
1.6流式细胞术检测细胞凋亡 收集转染48 h后各组BGC-823细胞,采用预冷磷酸盐缓冲液(PBS)冲洗,加入结合缓冲液1 ml冲洗1次,放入离心机离心后弃上清,分别在各组细胞中加入结合缓冲液200 μl,混匀,加入5 μl碘化丙锭(PI)与5 μl Annexin V-FITC,室温孵育20 min,分别加入结合缓冲液400 μl,置于流式细胞仪检测各组BGC-823细胞凋亡率。
1.7荧光素酶报告基因检测miR-299-5p靶基因 通过靶基因预测数据库预测RRS1是miR-299-5p的靶基因,构建野生型与突变型基因靶点RRS1 3′UTR-荧光素酶表达载体(WT-3′URT、MUT-3′UTR),分别取对数生长期BGC-823细胞接种至24孔细胞培养板,细胞密度调整为5×104个细胞/孔,细胞融合至60%左右时分别将空载体、WT-3′UTR、 MUT-3′UTR转染至BGC-823细胞,同步转染miR-299-5p mimic或miR-NC,统计荧光素酶与Renilla活性比值,严格按照荧光素酶报告基因检测试剂盒说明书进行操作。
1.8统计学处理 采用SPSS21.0统计软件行t检验、单因素方差分析。
2 结 果
2.1miR-299-5p和RRS1在胃癌BGC-823、MKN45、MGC803细胞和正常胃上皮细胞中的表达 qRT-PCR结果显示,相较于正常胃上皮细胞GES-1,胃癌BGC-823、MKN45、MGC803细胞中miR-299-5p表达水平均显著降低(P<0.05),RRS1 mRNA表达显著升高(P<0.05)。Western印迹检测结果显示,BGC-823、MKN45、MGC803细胞中RRS1蛋白表达水平显著高于GES-1细胞(P<0.05),见图1,表1。BGC-823细胞中miR-299-5p表达水平最低,因此后续研究中将采用BGC-823细胞为主要研究细胞。
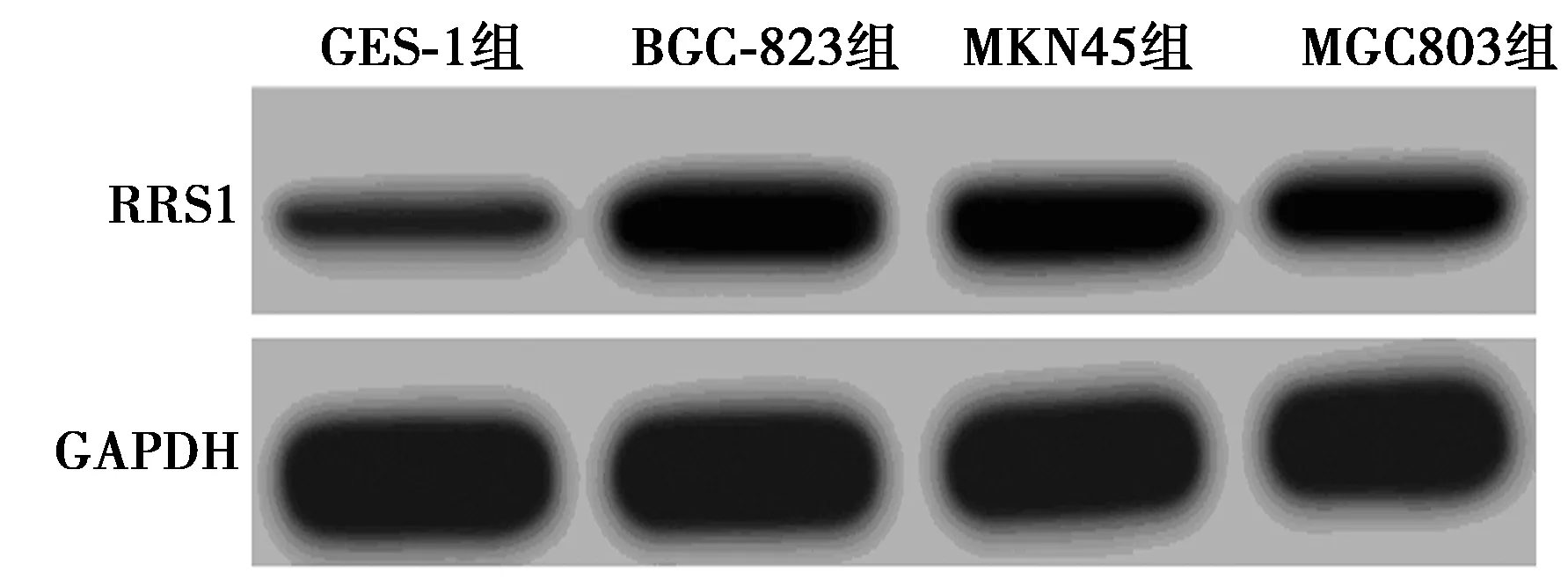
图1 RRS1蛋白表达
表1 miR-299-5p和RRS1在胃癌BGC-823、MKN45、MGC803细胞和正常胃上皮细胞GES-1中的表达
2.2miR-299-5p过表达对胃癌BGC-823细胞增殖的影响 qRT-PCR检测结果显示,相较于miR-NC组,miR-299-5p组BGC-823细胞miR-299-5p表达水平显著增高(P<0.05)。MTT法检测结果显示,转染miR-299-5p mimic后,在48 h与72 h miR-299-5p组BGC-823细胞增殖活力显著低于miR-NC组(P<0.05),见表2。
表2 miR-299-5p过表达对胃癌BGC-823细胞增殖的影响
2.3miR-299-5p过表达对胃癌BGC-823细胞凋亡的影响 流式细胞术检测结果显示,转染miR-299-5p mimic的miR-299-5p组BGC-823细胞凋亡率〔(25.69±2.33)%〕显著高于miR-NC组〔(8.13±0.82)%;t=12.313,P=0.000〕,见图2。
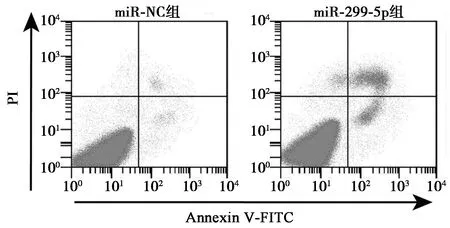
图2 细胞凋亡流式图
2.4抑制RRS1表达对胃癌BGC-823细胞增殖和凋亡的影响 Western印迹检测结果显示,转染si-RRS1后胃癌BGC-823细胞中RRS1蛋白表达水平显著低于si-NC组(P<0.05),见图3。MTT与流式细胞术检测结果显示,与si-NC组相比,si-RRS1组BGC-823细胞增殖活力在48、72 h显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),见表3。

图3 转染si-RRS1后胃癌BGC-823细胞中RRS1蛋白表达
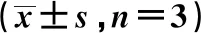
表3 抑制RRS1表达对胃癌BGC-823细胞增殖和凋亡的影响
2.5miR-299-5p靶向调控RRS1的表达 荧光素酶报告基因检测BGC-823细胞RRS1基因miR-299-5p定位序列结果显示,miR-299-5p在RRS1基因3′UTR具有相应结合位点,见图4。转染WT-RRS1后,再转染miR-299-5p mimic BGC-823细胞的荧光素酶活性(0.42±0.04)较再转染miR-NC组(1.01±0.09)显著降低(t=10.376,P=0.001);转染MUT-RRS1后,再转染miR-299-5p mimic BGC-823细胞的荧光素酶活性(1.03±0.09)与miR-NC组(1.04±0.08)相比差异无统计学意义(t=0.144,P=0.893)。进一步采用Western印迹验证miR-299-5p与RRS1基因的作用关系,结果显示转染miR-299-5p mimic后BGC-823细胞中RRS1蛋白表达水平(0.21±0.03)相较于miR-NC组(0.72±0.07)显著降低(P<0.05);转染miR-299-5p抑制剂(anti-miR-299-5p)后BGC-823细胞中RRS1蛋白表达水平(1.05±0.09)显著高于anti-miR-NC组(0.68±0.06,P<0.05),见图5。
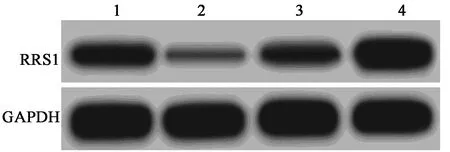
1~4:miR-NC组,miR-299-5p组,anti-miR-NC组,anti-miR-299-5p组图5 各组RRS1蛋白表达
2.6RRS1过表达逆转了miR-299-5p过表达对胃癌BGC-823细胞增殖和凋亡的作用 共转染miR-299-5p mimic与RRS1过表达质粒pcDNA-RRS1的miR-299-5p+pcDNA-RRS1组BGC-823细胞中RRS1蛋白表达水平较miR-299-5p+pcDNA组显著升高(P<0.05),见图6。miR-299-5p+pcDNA-RRS1组BGC-823细胞增殖活力在48、72 h较miR-299-5p+pcDNA组显著升高(P<0.05);而miR-299-5p+pcD-NA-RRS1组BGC-823细胞凋亡率显著降低(P<0.05),见表4。

1~4:miR-NC组,miR-299-5p组,miR-299-5p+pcDNA组,miR-299-5p+pcDNA-RRS1组图6 共转染miR-299-5p mimic后RRS1蛋白表达
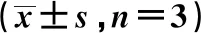
表4 RRS1过表达逆转了miR-299-5p过表达对胃癌BGC-823细胞增殖和凋亡的作用
3 讨 论
胃癌发生过程涉及多种信号通路,挖掘胃癌表观遗传学变化成为探究发病机制的主要手段,编码基因或非编码基因异常变化均可促进胃癌发生发展〔7〕。miRNA作为内源性非编码RNA,其可通过调控下游靶基因表达进而促进或抑制胃癌发生及发展〔8〕。miR-299-5p在头颈部鳞状细胞癌、胃腺癌、前列腺癌等多种恶性肿瘤中均呈低表达,并可作为评估癌症进展及患者预后的重要分子标志物〔9~11〕。本研究结果说明miR-299-5p可能参与胃癌发生过程,提示miR-299-5p可能发挥抑癌基因作用。另有研究表明,miR-299-5p在肝细胞癌、胶质母细胞瘤中呈高表达,敲低miR-299-5p可有效抑制肝细胞癌及胶质母细胞瘤进展〔12,13〕。分析原因可能为不同肿瘤细胞或组织中miR-299-5p表达变化不同,这可能与肿瘤种类及恶性程度有关。本研究结果说明miR-299-5p过表达可有效抑制细胞增殖活力并提高细胞凋亡水平,提示miR-299-5p表达水平降低可能导致胃癌发生。
甲状腺癌细胞中RRS1表达水平升高,采用RNA干扰技术沉默RRS1基因后甲状腺癌细胞增殖率明显降低〔14〕。乳腺癌细胞中RRS1呈高表达并可促进癌细胞增殖、迁移及侵袭〔15〕。与上述报道相似,本研究结果提示RRS1可能参与胃癌发生过程。沉默RRS1表达可能通过激活p53信号通路进而引起癌细胞周期阻滞并促使细胞凋亡〔16,17〕。通过慢病毒介导的RNAi敲低RRS1可抑制乳腺癌细胞、肝细胞癌细胞增殖并促进细胞凋亡〔18,19〕。本研究进一步采用RNA干扰技术降低RRS1表达,并分析其对胃癌BGC-823细胞增殖及凋亡的影响,结果显示抑制RRS1表达后BGC-823细胞增殖活力明显降低,细胞凋亡率显著升高,与相关文献报道相似〔20〕。说明抑制RRS1表达与miR-299-5p过表达对GES-1细胞增殖及凋亡的作用相同,miR-299-5p与RRS1可能存在负向调控作用。提示RRS1表达水平升高可通过促进胃癌细胞增殖、抑制其凋亡进而促进胃癌发生及发展。本研究结果显示RRS1是miR-299-5p的靶基因,经Western印迹进一步验证miR-299-5p可直接调控靶基因RRS1表达。进一步验证miR-299-5p是否直接靶向RRS1发挥作用,结果发现miR-299-5p+pcDNA-RRS1组细胞增殖活力明显高于miR-299-5p+pcDNA组,细胞凋亡率显著降低,分析其可能作用机制为miR-299-5p表达水平升高可降低靶基因RRS1表达进而激活p53介导的信号通路导致胃癌细胞凋亡。提示miR-299-5p直接靶向调控RRS1表达进而抑制胃癌细胞增殖抑制并促进凋亡。
——一道江苏高考题的奥秘解读和拓展

