老年肺腺癌患者肿瘤经气道播散的CT特征
吴越 范力文 谭明瑜 马伟玲 牛玉旭 武韫 高文
(复旦大学附属华东医院 1胸外科,上海 200040;2影像科)
肺癌是当今世界上发病率和死亡率最高的癌症之一〔1~3〕。与其他癌症相比,除了传统的血行转移、淋巴转移、直接侵犯外,肺癌有其特殊的新侵袭方式——气道播散(STAS),常见于肺腺癌中,而腺癌是目前肺癌中最多见的病理学亚型〔3~5〕。STAS作为肺腺癌侵袭的新模式〔6~9〕,多项研究发现STAS与肺癌患者肿瘤复发或不良预后密切相关〔10~13〕。Kadota等〔6〕发现行肺叶切除术的STAS阳性患者比采用其他术式的STAS阳性患者预后明显改善。但目前为止尚不能通过冰冻切片来确定STAS的存在,仅能通过术后病理诊断确诊。如果能够通过术前影像学检查预测甚至明确STAS的存在,可辅助临床诊疗,选择最佳治疗方案和手术方案,从而改善STAS阳性肺癌患者的预后。然而目前关于STAS影像学的研究较少,且尚无关于老年肺腺癌STAS影像学的相关研究,故缺乏足够证据指导临床实践。本研究探讨老年肺腺癌患者STAS阳性的计算机断层显像(CT)特征。
1 材料与方法
1.1病理资料 回顾性分析复旦大学附属华东医院2018年10月至2019年1月经手术病理证实的老年肺腺癌患者130例。80例接受手术治疗的老年肺腺癌患者男44例(55%),女36例(45%),年龄60~75〔平均(64.65±3.79)〕岁,吸烟者60例(75%)。此研究经过医院伦理委员会批准,由于是回顾性研究,无须取得患者知情同意。STAS阴性89例(11例无影像学资料);STAS阳性41例(1例无影像学资料)。将41例STAS阳性患者中有影像学资料的40例全部入选STAS阳性组,另外从78例STAS阴性且有影像学资料的患者中用随机数法选取40例纳入STAS阴性组。SATS阳性组纳入标准:①手术病理证实为原发性肺腺癌的Ⅰ~Ⅲ期患者(根据第8版TNM分期〔14〕)且年龄≥60岁;②手术病理石蜡切片诊断为STAS阳性;③既往无肺部手术史,无放化疗史;④有相关影像学资料。SATS阴性组符合以下入选标准:①手术病理证实为原发性肺腺癌的Ⅰ~Ⅲ期患者(根据第8版TNM分期〔14〕)且年龄≥60岁;②手术病理石蜡切片诊断为STAS阴性;③既往无肺部手术史,无放化疗史;④有相关影像学资料。STAS阴性组平均年龄(64.90±4.22)岁,男24例,女16例,吸烟者33例;STAS阳性组平均年龄(64.40±3.33)岁,男20例,女20例,吸烟者27例。两组年龄、性别及吸烟史比较,差异均无统计学意义(P=0.558,0.369,0.121),有可比性。
1.2CT检查 采用GE公司Discovery CT750 HD螺旋CT机进行扫描。患者取仰卧位,吸气后屏气,扫描范围从肺尖至肺底。CT扫描参数为:管电压120 kVp,管电流200 mA,采集层厚1.25 mm,重建层厚1.25 mm,间隔0.625 mm。双窗显示,肺窗窗宽1 500 HU,窗位-600 HU;纵隔窗窗宽400 HU,窗位40 HU。增强扫描在注射造影剂后70 s进行。CT读片由两位放射科医师独立进行,经讨论后做出报告。中央型定义为肿瘤病灶全部位于肺冠状位内三分之二区域内,周围型定义为病灶部分或全部位于肺冠状位外三分之一区域。
1.3病理学诊断 所有肿瘤标本经由两位高年资病理科医师进行读片,病理诊断遵循WHO肺部肿瘤分型〔8〕。手术切除肿瘤标本固定在10%甲醛溶液中,然后用石蜡包埋并制作成厚度为5 μm的石蜡切片,经苏木素-伊红(HE)染色后由病理医师观察得出病理结果。STAS的检测定义为肿瘤细胞出现在远离主病灶的正常肺泡腔中,并以微细胞簇、小癌巢或单个细胞的形式出现。播散出的肿瘤细胞必须与主病灶无直接连接。为了避免将肿瘤切割过程中人为分离的细胞误认定为STAS,每个病例在显微镜下至少观察3张切片,并且确保每张切片中的边界都是有效的。如果肿瘤细胞特异性地从主病灶中分离出来,并距离主病灶超过3个肺泡间隔则被认定为STAS。STAS病理切片见图1。

图1 STAS阳性肺腺癌病理切片
1.4图像分析 将CT影像数据传至PACS后处理工作站,由两位放射科医师分别提取病灶特征,最后进行整合。首先分析STAS本身能否在CT有直接表现,若无则选取以下指标进行分析:肿瘤最大径、结节类型(磨玻璃结节、部分实性结节、实性结节)、血管集束征、空气支气管征、支气管节段、胸膜凹陷征、毛刺、分叶、空洞、钙化、病灶位置(中央型、周围型)、病灶形状(类圆形、不规则)等。STAS影像见图2。
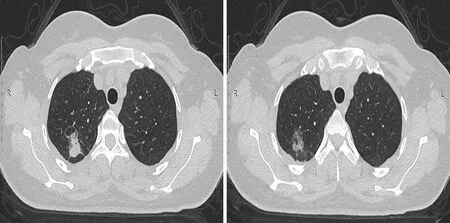
图2 STAS阳性肺腺癌CT影像
1.5统计学分析 采用SPSS22.0软件进行χ2检验、Fisher确切检验、t检验、U检验、单因素和多因素Logistic回归分析。
2 结 果
2.1两组CT特征及STAS比较 STAS阳性组肿瘤最大径显著大于STAS阴性组(P=0.036)。STAS阳性组病灶密度明显高于阴性组(P<0.001)。STAS阳性组以实性结节为主,其余为部分实性结节。此外,两组空气支气管征、胸膜凹陷征、分叶、毛刺等CT特征比较差异有统计学意义(均P<0.001),与STAS相关。两组血管集束征、病灶位置、支气管节段征、空洞、病灶形态等CT特征比较差异无统计学意义(P>0.10)。见表1。
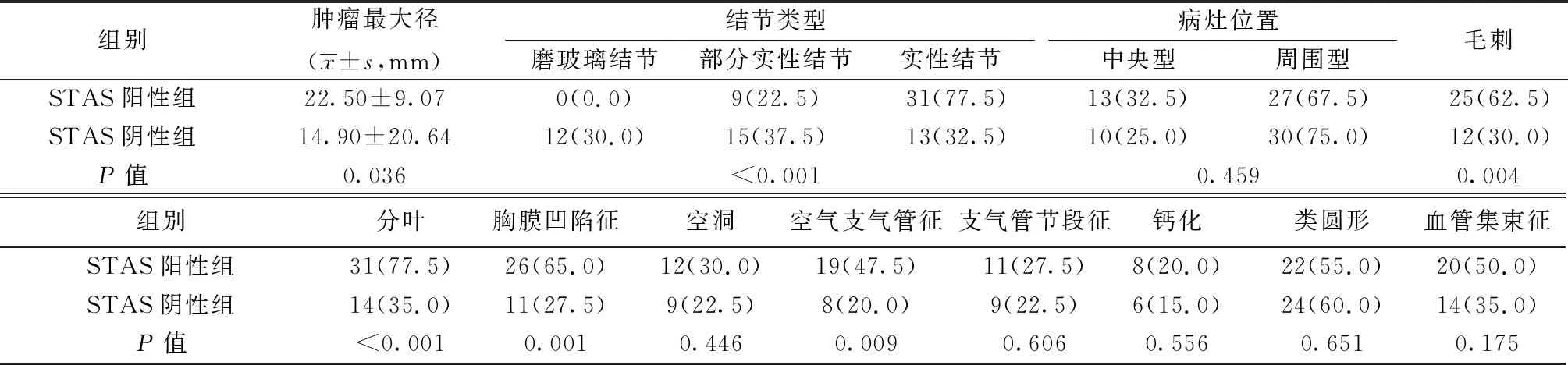
表1 STAS状态与肺腺癌患者CT特征关系的单因素分析〔n(%),n=40〕
2.2CT影像特征与老年性肺腺癌STAS的关系 肿瘤最大径、结节类型、空气支气管征、胸膜凹陷征是老年性肺腺癌STAS的独立预测因子。见表2。
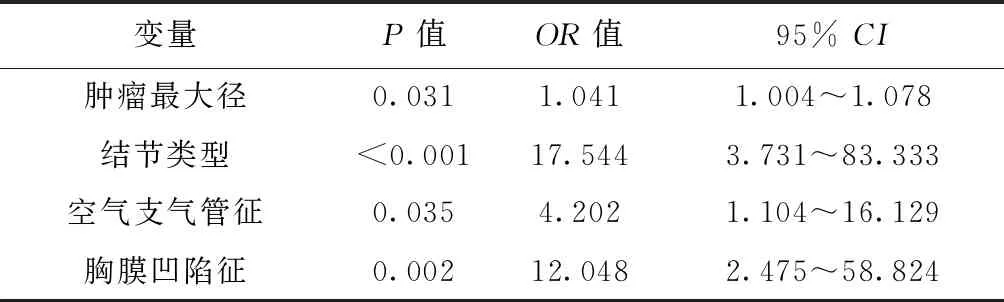
表2 用于预测STAS阳性的CT特征的多因素Logistic分析
3 讨 论
本研究结果提示结节实性成分比例较高的病例更倾向于出现STAS现象,而纯磨玻璃结节则几乎不会发生STAS现象。实性结节较部分实性结节、部分实性结节较磨玻璃结节,STAS阳性的风险升高17.544倍。这一研究结果与其他学者的研究一致〔15〕。此外,肿瘤最大径每增加1 mm,STAS阳性的风险增加4.1%;空气支气管征阳性病例STAS阳性的风险是空气支气管征阴性病例的4.202倍;胸膜凹陷征阳性病例STAS阳性的风险是胸膜凹陷征阴性病例的12.048倍。综上,这些CT影像特征对于术前预测老年性肺腺癌STAS的阳性与否有重要意义。
STAS作为肺腺癌的新侵袭模式〔8〕,其预后往往不佳。Warth等〔7〕发现STAS与肺癌患者总体生存率和无病生存率显著降低有关。Shiono等〔10〕也证实STAS与肺癌预后不良和疾病复发密切相关,即使在Ⅰ期肺腺癌中也是如此。STAS肺癌患者的预后还与选择的手术方式有关,研究显示肺叶切除比亚肺叶切除对STAS阳性的T1期肺癌患者获益更佳〔16,17〕。在一项包含411例Ⅰ期肺腺癌患者的大型队列研究中发现STAS是局部切除术后复发的重要危险因素〔6〕。另一项研究表明,STAS阳性和手术切缘距肿瘤边缘小于1 cm是局部切除后早期肺癌局部复发的重要危险因素。在该研究中手术切缘距肿瘤边缘大于2 cm的病例均未发生局部复发〔18〕。上述结果说明对于STAS阳性的肿瘤来说,术中需要相对较宽的手术切缘,即使在小肿瘤中也应谨慎选择局部切除。所以术前预测甚至诊断出STAS将对手术方案的选择和改善患者预后有着重要意义。对于局部定向治疗如立体定向体部放射治疗和经皮图像引导消融等技术,在治疗前如果能够预测STAS,则可以选择扩大治疗区域的范围,取得更好的疗效,降低局部复发的概率〔19,20〕。目前我们仅能通过术后病理诊断STAS,还不能通过冰冻切片来确定STAS的存在。故术前通过影像学特征判断STAS的存在则显得更加具有临床意义。

