超声造影联合经皮射频消融在肝癌破裂出血治疗中的应用
李锐 陈卉品 王菲 周晓峰 林艳端
(厦门大学附属中山医院超声科,福建 厦门 361004)
肝癌破裂出血是肝癌少见而致命性的并发症,具有起病急、进展快、容易发生腹腔种植转移等特点,如治疗不及时病死率极高〔1〕,以往对肝癌破裂出血的治疗方式主要集中在保守和手术治疗两方面,随着介入技术的不断发展,射频消融治疗〔2,3〕成为继手术切除、肝动脉栓塞治疗的第三种肝癌治疗主要手段,已有学者将肝癌破裂出血列为射频消融的适应证之一,而超声造影的使用可以更准确直观地显示出血部位及提供出血周围区域的微循环信息,同时能实现射频消融的实时引导,对射频消融的止血治疗过程更是起到显著的促进作用,而目前关于射频消融特别是联合超声造影的射频消融对肝癌破裂止血治疗方面病例的报道尚少,因此本文旨在探讨超声造影联合经皮射频消融在急性肝癌破裂出血治疗中的应用价值。
1 资料与方法
1.1研究对象 回顾分析2013年9月至2019年3月在厦门大学附属中山医院经超声造影引导下急诊行经皮射频消融止血治疗的31个肝癌破裂出血病灶(均病理证实为肝恶性肿瘤),其中男21例,女10例,年龄47~81岁,平均(68.7±7.6)岁,6例为肝肿瘤经皮穿刺活检过程中出血,结节最大4.8 cm×3.2 cm×4.1 cm,最小3.9 cm×2.6 cm×3.1 cm; 25例为肝癌自发破裂出血,结节最大11.2 cm×8.9 cm×8.6 cm,最小3.8 cm×2.9 cm×3.2 cm;自发破裂出血病人以突发上腹疼痛,腹胀、头晕、心慌为主诉门诊就诊。
1.2仪器与材料 使用西门子Sequoia 512彩色多普勒超声诊断仪,配备4C1和4V1探头,频率3.0~4.5 MHz 。巴德穿刺活检枪,18 G一次性活检针。超声造影剂使用六氟化硫微泡(Sonovue,国药准字J20130045),微泡直径平均2.5 μm,pH4.5~7.5,使用生理盐水5 ml稀释震荡。使用RITA射频消融仪,针具采用单极针。
1.3治疗方法 6例经皮穿刺活检前检查血常规、凝血功能正常,彩超检查无腹盆腔积液,穿刺后肝周见积液征象(图1),彩色多普勒观察穿刺针道均有迎向探头的红色线样血流信号经肝包膜外溢(图2),使用频谱多普勒观察穿刺针道异常红色血流,最高流速1.26 m/s,最低流速0.41 m/s,立即行血压及心电监护,并急检血常规,同时询问无药物过敏史后外周静脉注入Sonovue超声造影剂2.5 ml行超声造影检查,超声造影提示肝前积液衬托下肝右叶穿刺针道见线样“喷泉样”高回声自肝内向肝外持续外溢,超声造影提示穿刺针道有活动性出血。明确诊断后给予药物止血或肝动脉栓塞术止血治疗,均未达到止血目的,立即急诊行超声造影引导下经皮射频消融止血治疗,治疗前排除射频消融禁忌证并明确电流区域无金属物及血管支架,选用RITA射频消融仪14 G单电极针沿造影剂外溢区域布入射频针,选择针道消融方式,温度达到70℃退针1 cm,逐步退针进行消融止血。术后超声造影即刻评价止血效果,观察肝周有无造影剂外溢现象,证明无活动性出血,射频消融后半小时常规超声观察肝周及腹腔积液量有无增加迹象。
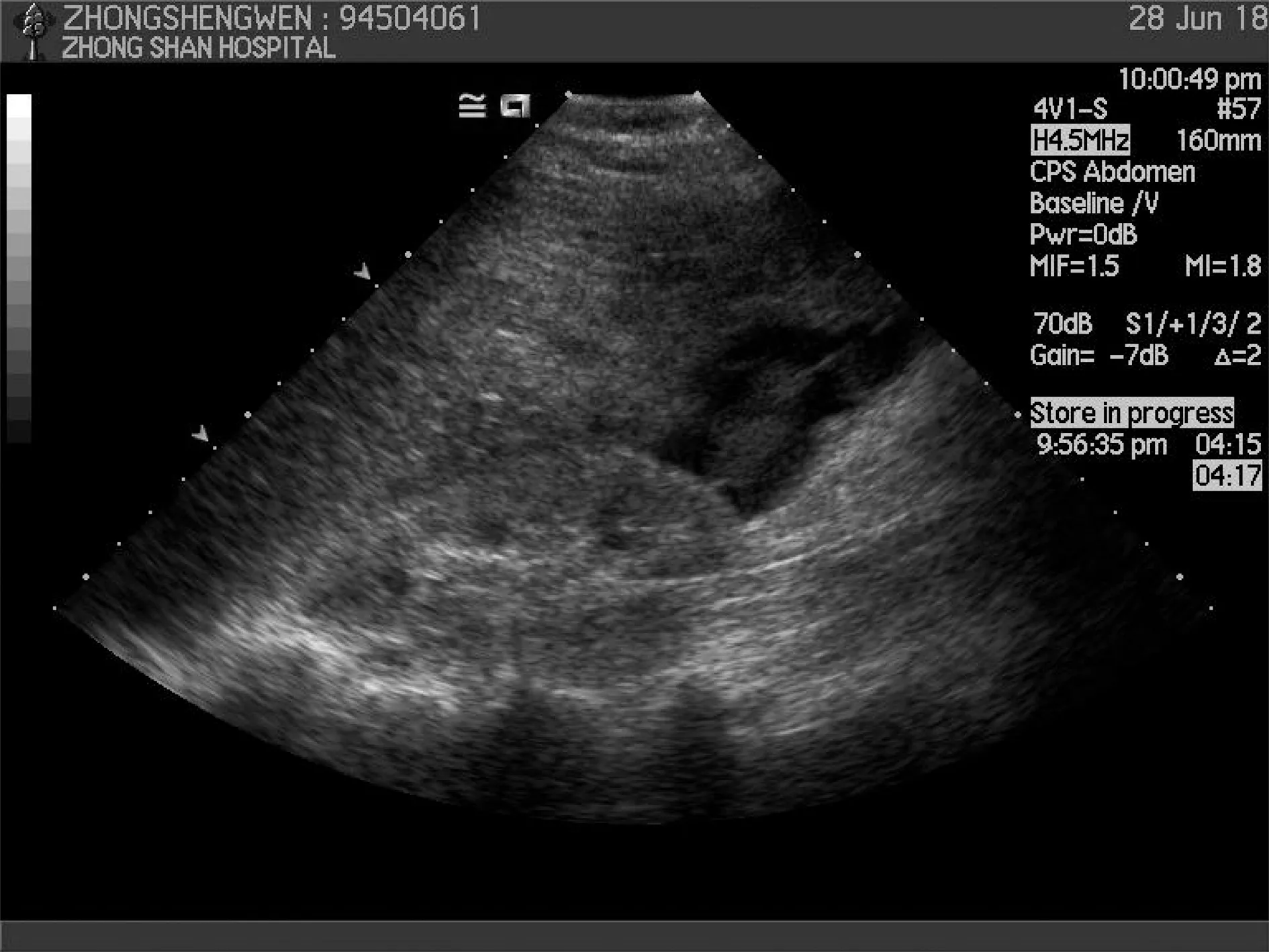
图1 肝穿刺活检后腹腔出血

图2 彩色多普勒观察穿刺针道迎向探头的红色血流信号经肝包膜外溢
25例肝癌自发破裂出血患者,临床均以突发上腹疼痛,腹胀、头晕、心慌主诉门诊就诊,急诊腹部超声提示肝内单发或多发占位,腹腔不同程度游离积液,立即行超声造影检查(方法同上诉病例),超声造影检出25个肝癌破裂出血病灶,可见形态各异的高回声气泡自肝内向肝外持续或断续外溢,诊断肝癌自发性破裂出血,同样经保守治疗或肝动脉栓塞治疗未见效,在超声造影确定出血部位后,立即急诊行超声引导下经皮射频消融止血治疗(如图3),术后超声造影即刻评价止血效果。

图3 沿肝出血部位布针射频消融止血
2 结 果
31例患者术前均病理证实为肝脏恶性肿瘤,其中原发性肝细胞癌29例(占肝癌出血病例的93%),肝转移癌患者2例(占7%),肿瘤多数体积较大(肿瘤长径≥4 cm占87%),位置大部分紧邻肝包膜或突出肝表面<0.5 cm,且多合并有乙型病毒性肝炎病史(占80%)或肝硬化(占88%),见表1。
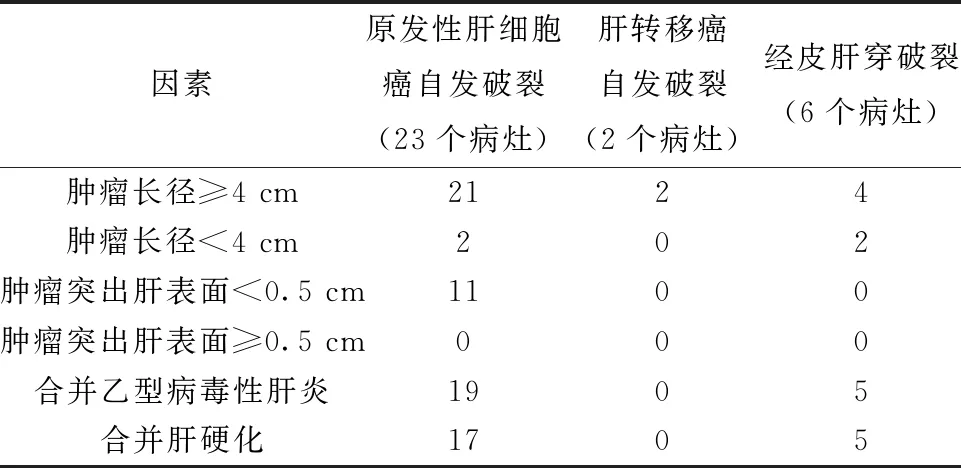
表1 不同病因及病史的肝癌破裂出血经射频消融止血治疗病例分析
6例穿刺活检中出血的病例术前通过彩色多普勒均可见沿穿刺针道观察到有迎向探头的红色线样血流信号至肝包膜,同时通过频谱多普勒测量穿刺针道异常红色血流束,其中最高流速1.26 m/s,最低流速0.41 m/s,最后予以超声造影,可见出血速度快的出血点处造影剂气泡聚集速度快且量大,呈“喷射状”,而出血速度较慢的出血点处造影剂气泡呈断续“细线样”外溢。25例肝癌自发破裂出血术前常规彩超提示肿瘤较前检查增大,内部回声不均匀,通过超声造影可见高回声造影剂气泡自肝内向肝外溢出,而造影剂气泡溢出的形态及方式较不规则(可能原因是肿瘤自发破裂出血不同于穿刺针道出血易见,形态多不规则,多呈密集筛孔状)。
31个出血病灶均于术前经超声造影明确出血部位,术中经超声造影引导下经皮射频消融止血治疗,过程顺利,并于术后超声造影即刻评价止血效果,31个病灶均有效止血,超声造影显示原来的出血点无造影剂气泡外溢(如图4),且于射频消融治疗后观察30 min内未见明显的并发症。
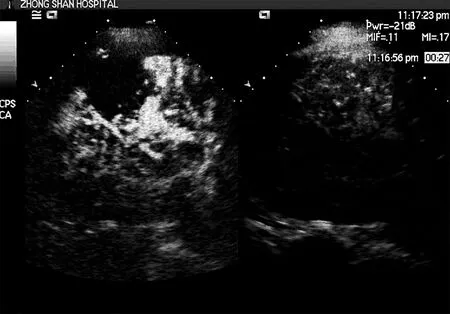
图4 超声造影显示原来的出血部位无造影剂溢出
3 讨 论
肝癌破裂出血是肝癌严重的并发症,在西方国家较为罕见,发病率<3%,但在东方国家发病率却高达12%~14%,且再出血率高达43%〔4〕,肝癌破裂出血还容易导致腹腔内肿瘤的广泛转移,预后不佳,死亡率高达50%,占肝细胞癌死因的10%~15%〔5〕。目前发生肝癌破裂出血主要包括两方面,即肝癌的自发性破裂出血和诊断性穿刺活检出血,其中自发性破裂出血的常见原因一般包括:①肿瘤较大、生长过快;②肿瘤包膜较薄且靠近肝边缘,无正常肝组织保护;③肿瘤侵犯血管;④有乙型病毒性肝炎病史,肿瘤血管易受免疫性破坏,炎症反应易损坏血管壁,肝癌病人的乙型肝炎病毒抗原抗体复合物无法有效清除,小动脉壁胶原纤维稀疏、易断裂;⑤存在肝硬化、门静脉高压等〔6〕,分析本研究中的31个出血病灶的特点,均与文献中常见的出血原因相符,原发性肝细胞癌患者较肝转移癌患者更容易合并有乙型病毒性肝炎病史或肝硬化,使得新生的肿瘤血管壁更容易受免疫性或炎症性的破坏而破裂出血。
近年来随着介入技术的广泛应用,穿刺活检引起的出血也日渐增多,无论是肝癌自发性破裂出血还是穿刺活检引起的出血,快速及时诊断是首要问题,常规超声诊断肝癌破裂出血具有一定的局限性,敏感度较低,而超声造影的使用〔7,8〕,通过造影剂气泡可实时监测到自肝内向肝外持续外溢的高回声征象,提高了对肝肿瘤破裂出血诊断的准确率,且在术前即可明确出血部位,可以精准、合理引导消融止血布针点。目前国内应用较多的超声造影剂为六氟化硫微泡,它的行为与红细胞相似,可到达组织脏器内,反映组织脏器的微循环血流灌注状态。宋宏萍〔9〕提示出血所致的造影剂溢出形态各异,可呈“扇形”、“柱状”或“串珠状”,这种形态各异可能与损伤区空间形态、损伤口大小及血管压力等因素有关〔5〕,本文所及肝肿瘤穿刺活检后活动性出血超声造影显示形态均为“细线样”外溢,自发破裂出血形态各异。因此利用超声造影来诊断肝癌破裂活动性出血的优势在于可实时动态了解出血部位,准确评估出血量,且床边即可操作,具有简便、安全、重复性强等特点。
尽管超声造影的使用大大地提高了超声对肝癌破裂出血诊断的准确性,但由于造影剂在肝脏较深部位显影效果的受限,因此对于肝脏深部肿瘤向肝后方破裂出血的诊断仍然存在局限性,总结其原因可能有:①与肝脏背景有关,原发性肝癌多伴有肝硬化。②超声造影剂本身增加了声衰减,影响深部组织灰阶信号、多普勒信号及血流信号的显示。
既往对肝癌破裂出血的治疗方式主要集中在保守和手术治疗两方面,近年来随着介入技术的不断发展,特别是射频消融技术在肝癌治疗方面取得的成果,使得射频消融术作为肝癌破裂出血治疗的一种新方法而被关注,此技术可使出血部位发生汽化、脱水、热效应使肿瘤出血血管及周围组织产生凝固,形成凝固坏死区,使活动性出血点得到控制。止血的同时对较大肿瘤还有减少癌细胞活性的治疗作用。在肝癌射频消融治疗中,针对肿瘤荷瘤血管的消融治疗是关键,肿瘤荷瘤血管的内径一般较为细小,RFA通过阻断荷瘤血管对肿瘤供血达到治疗效果,不管是肝癌自发性破裂出血,还是肿瘤穿刺活检引起的出血,多半是细小血管的破裂或者损伤所致,利用射频消融可以达到阻断细小出血血管的作用,实现止血目的,同时还可对多个出血灶行多次消融止血,本组RFA止血治疗后无并发症发生,因此经皮射频消融治疗肝肿瘤的活动性出血疾病具有简便、快速、有效、微创、可重复性的优点〔10~14〕。
超声造影与经皮射频消融技术的联合,既提高了术前对出血诊断的准确率,术中实现对出血部位的实时引导,术后还可即刻评价止血效果,两种方法相辅相成,有望成为肝癌破裂出血的又一有效、快速、微创、可重复性的止血方法。

