鸡豆黄素A对MPP+诱导PC12细胞凋亡的保护作用
俞益桂,薛海霞,韩俊辉,尹艳艳
帕金森病(parkinson's disease,PD)是世界第二大神经退行性疾病,临床症状主要包括静态震颤、运动迟缓和僵硬肌肉,其病理学特征为黑质(substantia nigra, SN)多巴胺(dopamine,DA)能神经元的凋亡和丧失[1-2]。研究[3]表明在PD疾病中,长期或严重的氧化应激可以诱导DA能神经元受到损伤甚至凋亡。相关研究[4]发现在细胞凋亡中活性氧(reactive oxygen species,ROS)-NO通路起到了至关重要作用,说明凋亡的启动与ROS是密不可分的。含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase, Caspase)家族的激活一般被认为是细胞凋亡的重要一环,Caspase-9被凋亡相关因子诱导形成凋亡小体,而凋亡小体随即激活凋亡执行者Caspase-3,而Caspase-3在很多凋亡信号的传导过程中发挥重要作用[5]。鸡豆黄素A(biochanin A,Bioch A)是从鹰嘴豆等豆科植物中提取分离的异黄酮类有机化合物,是一种天然的植物雌激素,该课题组前期实验表明Bioch A对DA能神经元发挥保护作用与其对小胶质细胞活化,炎症相关因子分泌和氧化应激等的抑制有关[6-7]。然而,Bioch A能否直接保护神经元尚待进一步研究。该文通过1-甲基-4-苯基吡啶离子 (1-methyl-4-phenylpyridinium, MPP+)损伤PC12细胞来建立体外模型,研究Bioch A能否通过抗氧化作用而发挥神经元保护作用。
1 材料与方法
1.1 材料
1.1.1细胞株 从中国医学科学院协和医科大学基础细胞中心细胞室获得大鼠肾上腺髓质嗜铬瘤细胞(pheochromocytoma cell, PC12)株。
1.1.2药品与试剂 FBS和高糖DMEM完全培养基购自美国Gibco公司;MTT、Bioch A、PI、雌二醇(Estrodiol)和DMSO购自美国Sigma-Aldrich公司;青-链霉素混合溶液、胰蛋白酶(Trypsin)、ROS检测试剂盒(DCFH-DA荧光探针法)、RIPA裂解液(弱)、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;PVDF膜购自美国Milliproe公司;超高敏的化学发光底物(Super Signal West Femto Kit)购自美国Thermo公司;HRP标记山羊抗兔IgG(1 ∶10 000)和HRP标记山羊抗鼠IgG(1 ∶10 000)、PBS和鼠抗β-actin抗体(1 ∶1 000)购自北京中杉金桥生物技术有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海市贝博公司;一抗兔抗Caspase-3(1 ∶1 000)和兔抗Caspase-9(1 ∶1 000)均购自美国Bioworld公司。
1.1.3主要仪器 倒置显微镜CHL2FM3型购自日本OLYMPUS公司;全波长酶标仪SpectraMax190型购自美国Molecular Device公司;恒温培养箱HealForce100型购自香港力康生物科技控股有限公司;bioshine ChemiQ4600 mini化学发光成像系统购自上海市欧翔科学仪器有限公司;自动细胞计数分析仪IC 1000-Countstar购自睿钰(上海)生物科技有限公司;流式细胞仪BD FACSVerse购自美国Becton Dickinson公司;TGL-16H型高速离心机购自黑马(珠海)医学仪器有限公司。
1.2 方法
1.2.1PC12细胞的培养 将购回的PC12细胞,接种在含有10% FBS和1% 青-链霉素混合溶液双抗的DMEM高糖培养基中于恒温培养箱(5% CO2,37 ℃)进行培养。细胞每隔1 d更换1次培养液,2~3 d传代1次。当细胞生长至对数生长期时,用胰酶消化细胞并进行传代。
1.2.2MPP+和Bioch A剂量的筛选 为了检测MPP+和Bioch A的浓度对PC12细胞活力的影响。实验将PC12细胞分为7组。分别为MPP+(0、0.125、0.25、0.5、1、2、4 μmol/L)与Bioch A(0、0.625、1.25、2.5、5、10、20 μmol/L)组,每组加相对应的药物孵育36 h。36 h后,每组加MTT 20 μl(5 mg/ml),培育4 h。4 h后,弃去孔中培养液。每孔再加DMSO 200 μl,振荡10 min以便结晶物完全溶解。用酶标仪在490 nm波长处测量各孔的吸光度值。
1.2.3实验分组 本实验PC12细胞被分为6组。Control组:未加任何药物孵育36 h;MPP+组:加入1 μmol/L的MPP+孵育36 h;MPP++Bioch A(1.25、2.5、5 μmol/L)组:选用Bioch A(1.25、2.5、5 μmol/L)预处理细胞2 h后再加入1 μmol/L的MPP+共同孵育36 h;E2组:E2(0.1 μmol/L)预处理细胞2 h后再加入1 μmol/L的MPP+共同孵育36 h。
1.2.4ROS检测 使用DCFH-DA探针法检测Bioch A对MPP+刺激的PC12细胞的ROS表达的影响。加药处理2 h后,Control组除外,剩余各组加入MPP+(1 μmol/L)培养36 h。36 h后进行 DCFH-DA孵育,孵育完成后,在显微镜下观察并拍照,利用Image-Pro Plus 6.0软件分析各组平均荧光强度。
1.2.5流式细胞仪测定细胞凋亡 用Annexin V-FITC/PI 凋亡检测试剂盒双染细胞来检测Bioch A对MPP+刺激的PC12细胞凋亡的影响。使用胰蛋白酶消化细胞,1 000 r/min,离心5 min,弃上清液, PBS洗2次。加Binding Buffer 400 μl反复吹打使细胞混和均匀,细胞浓度高于1×105个/ml为宜,然后继续加入 Annexin V-FITC 5 μl,摇匀,在避光条件下2~8 ℃放置15 min,后加入 PI 10 μl,摇匀,在避光2~8 ℃下静置5 min,最后用流式细胞仪和显微镜检测。
1.2.6Western blot 在培养好的细胞中加入含有蛋白酶抑制剂的细胞裂解液提取蛋白。BCA试剂盒定量后各组取适量样品按样品和蛋白上样缓冲液4 ∶1比例进行变性。将变性后蛋白加入进行SDS-PAGE凝胶电泳,转膜,后用脱脂奶粉和TBST溶液配制成浓度为5%的封闭液室温下封闭1 h,封闭好的膜用TBST洗3次,后将膜置于相应的一抗中4 ℃过夜。次日,TBST洗3次后,室温孵二抗1 h,然后再用 TBST洗3次,再按1 ∶1比例配制ECL发光液,将膜放在显影仪中曝光,保存。用Image J软件对蛋白条带的灰度值进行分析。
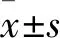
2 结果
2.1 MPP+和Bioch A剂量的筛选采用MTT法检测细胞活力为后续实验筛出合适的MPP+和Bioch A剂量。从表1结果可以看出,MPP+剂量和细胞活力呈负相关,剂量增加活力下降,差异有统计学意义(P<0.05或P<0.01)。大多情况下,在MPP+刺激细胞凋亡模型中,细胞活力选择在50%~60%比较适宜,因此选取MPP+(1 μmol/L)来刺激PC12细胞凋亡。 从表2结果可以看出,PC12细胞中加入Bioch A(0.625、1.25、2.5、5、10、20 μmol/L)36 h 后,Bioch A(0.625、1.25、2.5、5 μmol/L)组与Control组比较,细胞活力无明显变化,因此选取3个浓度梯度的Bioch A(1.25、2.5、5 μmol/L)进行后续实验。
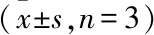
表1 MPP+对PC12细胞活力的影响
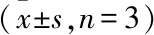
表2 Bioch A对PC12细胞活力的影响
2.2 Bioch A对MPP+诱导的PC12细胞ROS表达的影响使用DCFH-DA荧光探针,来检测MPP+刺激的PC12细胞ROS的荧光强度,用统计学手段分析各组ROS的表达情况。从图1所示结果可以看出,MPP+模型组相较于Control组,ROS荧光强度增加;Bioch A(2.5、5 μmol/L)组以及 E2 组与 MPP+

图1 Bioch A对MPP+诱导的PC12细胞ROS表达的影响
组比较,ROS表达量均有所减少,差异有统计学意义(P<0.05)。以上结果表明,Bioch A可以对MPP+刺激的PC12细胞内ROS的表达增加有一定的抑制作用。
2.3 Bioch A对MPP+诱导的PC12细胞凋亡的影响采用Annexin V-FITC/PI 双染法和流式细胞仪来检测Bioch A对MPP+诱导的PC12细胞凋亡的影响。从如图2所示结果可以看出,MPP+处理36 h后,MPP+组相较Control组,细胞凋亡率达到(44.43±4.95)%(P<0.01);Bioch A(2.5、5 μmol/L)预处理组与MPP+组比较,细胞凋亡百分率降至(31.57±2.25)%和(27.53±1.75)%(P<0.05,P<0.01);E2预处理组与MPP+组比较,细胞凋亡百分率降至(19.63±1.95)%(P<0.01)。
2.4 Bioch A对MPP+诱导的PC12细胞cleaved Caspase-3和cleaved Caspase-9蛋白表达的影响采用Western blot法来检测MPP+诱导的PC12细胞中cleaved Caspase-3和cleaved Caspase-9蛋白的表达情况,结果如图3所示,MPP+组相较于Control组, cleaved Caspase-3和cleaved Caspase-9蛋白的表达增多,差异有统计学意义(P<0.01);Bioch A(2.5、5 μmol/L)组以及E2组与MPP+组比较,cleaved Caspase-3和cleaved Caspase-9蛋白水平均有所降低(P<0.01,P<0.05)。结果表明,Bioch A对MPP+诱导的PC12细胞的cleaved Caspase-3和cleaved Caspase-9蛋白水平增加有一定的抑制作用。
3 讨论
中枢退行性疾病与神经元功能的丧失有一定关联,PD患者的黑质致密部80%的DA能神经元丧失了正常的功能。近年来,外源性的神经毒素诱导形成的PD细胞模型已成为PD发病机制重要的研究手段[8]。来源于大鼠肾上腺髓质嗜铬细胞瘤的PC12细胞株,具有神经细胞的特性, 且可稳定传代。MPP+是一种神经毒素, 能够引起神经细胞的氧化应激,因此可作为诱导剂为PD的发病机制研究制备细胞模型[9]。MPP+可以直接被DA转运蛋白有选择性的转运至DA能神经元,使神经元线粒体功能出现障碍,进而导致细胞凋亡的出现[10]。本实验采用MPP+刺激PC12细胞凋亡建立体外PD模型,观察 Bioch A 对MPP+刺激的PC12细胞凋亡的作用。不同浓度MPP+处理细胞,结果显示1 μmol/L MPP+处理细胞能引起大约50%细胞凋亡,因此本实验选用1 μmol/L MPP+用于后续造模。
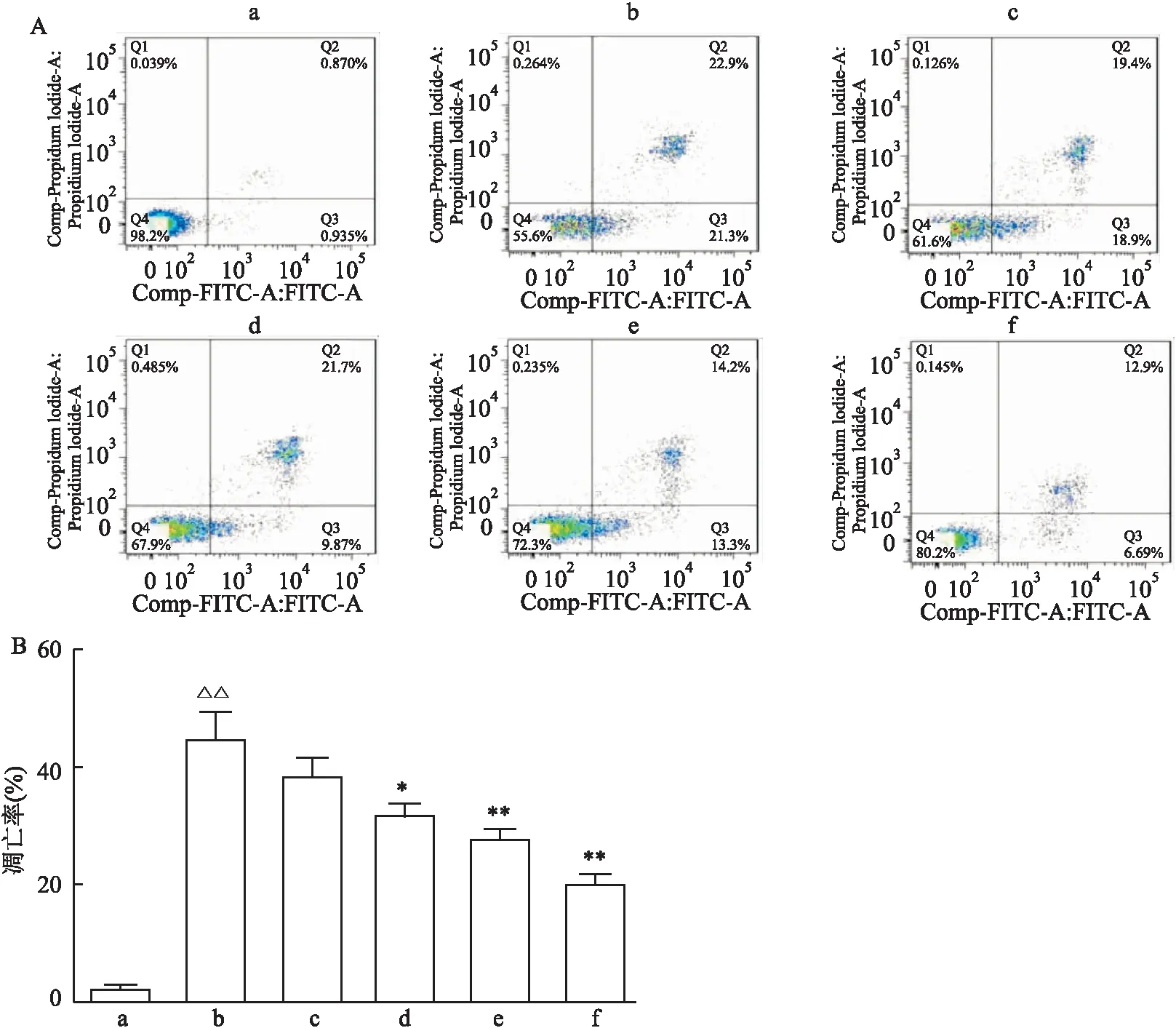
图2 细胞流式检测Bioch A对MPP+诱导的PC12细胞凋亡的影响
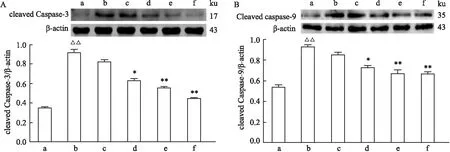
图3 Western Blot检测cleaved Caspase-3和cleaved Caspase-9蛋白的表达
氧化应激与许多人类变性疾病有关, 如癌症、动脉粥样硬化以及神经退行性病变等,近年的研究[11]表明氧化应激与PD的发生发展密不可分。ROS增加是氧化应激的主要标志,在正常的机体或细胞内,ROS 总是与内在的抗氧化系统处于动态平衡中。当受到外界刺激时,平衡被破坏,从而产生氧化应激[12]。在本实验中,Bioch A预处理能够有效抑制MPP+组中的ROS的升高。此结果提示Bioch A可以减轻PC12细胞中MPP+诱导的氧化应激。此外,由于ROS作为凋亡启动的一个重要条件,所以Bioch A也可能调节了细胞的凋亡过程。
Caspase家族的活化被认为是凋亡的直接效应物,因为其在凋亡进程中起到了不可忽视的作用。ROS等因素刺激线粒体,致使线粒体损伤和膜电位的下降,细胞色素C从受损的线粒体中释放,细胞色素C和Caspase-9酶原共同作用形成凋亡复合体,其释放并使Caspase-9活化,随即活化的Caspase-9进一步刺激Caspase-3,降解底物导致细胞凋亡[13]。Caspase-3是细胞凋亡的常见途径和执行者,其活化表明细胞凋亡进入了难以逆转的阶段,它的表达很大程度上能反映出细胞凋亡情况[14-15]。一般情况下,Caspase-3在细胞质内处于无活性状态,但当其被外界刺激所影响时便可触发自我凋亡程序, 通过关键蛋白酶的激活而加快细胞凋亡的进程。根据Western blot结果可以看出,Bioch A预处理能够抑制MPP+刺激的PC12细胞Caspase-3和Caspase-9的活化。表明Bioch A对PC12细胞的凋亡起到一定程度的抑制作用。

