BET蛋白抑制剂JQ1增强索拉非尼对肝癌细胞的增殖抑制研究
王 宇,范璐璐
肝癌是临床上常见的恶性肿瘤,据最新统计[1],全世界新发肝癌患者每年约 70 万,居恶性肿瘤的第 5 位,肝癌因此被称为“肿瘤之王”。索拉非尼是治疗晚期肝癌的重要一线靶向药物,但其治疗效果尚不满意[2],因此努力寻找有效的药物和最优化的治疗方法是当前的研究重点。溴结构域蛋白4(bromodomain-containing protein 4, BRD4)属于溴化结构和BET家族蛋白,BRD4通过结合组蛋白诱导细胞的靶基因活化或抑制, 还可以结合乙酰化的非组蛋白, 来调控DNA复制、细胞周期及基因转录等其他细胞活动。因此,BRD4在肿瘤发生、发展中起着重要作用[3]。JQ1是一种小分子化合物, 是BET家族蛋白抑制剂, 可以竞争性结合于BRD4溴化结构, 阻止BRD4与乙酰化的赖氨酸结合[4]。该研究通过观察JQ1联合索拉非尼对肝癌细胞株的增殖抑制作用,并探讨其可能的机制,为肝癌的临床治疗提供理论基础。
1 材料与方法
1.1 材料人肝癌细胞株HepG2、Bel-7402购自中国科学院上海细胞库;胎牛血清购自美国Gibco公司;DMEM高糖培养基购自美国Hyclone公司;索拉非尼购自美国Selleck公司;JQ1购自美国MedChemExpress公司;兔来源抗人Bcl-2单克隆抗体购自美国Abcam公司;兔来源抗人c-MYC单克隆抗体购自沈阳万类生物科技有限公司;兔来源抗人BIM单克隆抗体购自美国CST公司;鼠来源抗人Actin抗体和所有二抗均购自北京中杉金桥生物技术有限公司;化学发光显影试剂盒购自美国ThermoFisher公司;Annexin V-FITC细胞凋亡检测试剂盒购自上海贝博生物科技有限公司;胰蛋白酶和DMSO均购自上海碧云天生物技术有限公司。
1.2 细胞培养所有细胞在含有10%胎牛血清,1%青霉素和1%链霉素的DMEM高糖培养基中培养,在含有5%CO2的培养箱中于37 ℃培养,1~2 d换液一次,在细胞对数生长期时进行传代。
1.3 细胞增殖实验MTT方法检测细胞增殖抑制率。首先,将HepG2和Bel-7402以5 000个细胞/孔接种于96孔培养板中培养。用JQ1(1 μmol/L)、索拉非尼(10 μmol/L)、JQ1联合索拉非尼分别处理细胞,同时设置空白对照组和阴性对照组,每组设置5个复孔,24、48 h之后向每个孔中加入10 μl MTT试剂,在37 ℃下孵育4 h。 然后,去除细胞培养上清液,并向每个孔中加入150 μl DMSO。 在37 ℃条件下孵育15 min。 最后,通过酶标仪在490 nm处确定每个孔的吸光度值。根据测量的吸光度值计算每个孔的增殖抑制率。
1.4 细胞凋亡实验Annexin V-FITC/PI双染检测细胞凋亡。取对数生长期细胞消化计数后按2×105个/孔接种于6孔细胞培养板中。贴壁后加入DMSO、JQ1(5 μmol/L)、索拉非尼(10 μmol/L)、JQ1联合索拉非尼分别处理细胞,24、48 h后用不含EDTA的胰蛋白酶消化细胞,获取上清后使用预冷的PBS洗涤后离心,将离心后的细胞重悬于结合缓冲液中, 加入5 μl Annexin V-FITC室温避光孵育15 min,之后加入5 μl PI混匀。室温避光孵育5 min。使用FACS流式细胞仪测定凋亡细胞。早期和晚期凋亡细胞均包括在细胞死亡测定中。
1.5 蛋白提取与Western blot实验取对数生长期细胞消化计数后按2×105个/孔接种于6孔细胞培养板中。贴壁后加入JQ1(5 μmol/L)、索拉非尼(10 μmol/L)、JQ1联合索拉非尼分别处理细胞,同时设置对照组,24 h后加入含有蛋白酶抑制剂的裂解液置于冰上裂解30 min,将裂解物在低温(4 ℃)和高速(15 000 r/min)下离心15 min。通过BCA试剂盒检测上清液的蛋白质含量。在纯化的蛋白质样品中加入蛋白上样缓冲液,并在95 ℃条件下加热10 min。通过SDS-PAGE分离蛋白质样品,并在恒定电流下转移到PVDF膜上。使用5 %脱脂牛奶封闭含有蛋白质的膜,在4 ℃下与特异性一抗孵育过夜,然后加入相应的二抗(1 ∶50 000)在37 ℃孵育2 h。使用化学发光显影液使蛋白质条带可视化,上机扫描捕获信号并保存。
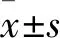
2 结果
2.1 JQ1联合索拉非尼对HepG2和Bel-7402肝癌细胞的增殖抑制作用使用MTT测定法分别检测对照组、JQ1(1 μmol/L)、索拉非尼(10 μmol/L)、JQ1联合索拉非尼作用于HepG2和Bel-7402肝癌细胞24 h或48 h后,肝癌细胞的增殖抑制率(图1)。结果显示,在HepG2肝癌细胞中,24 h各组的增殖抑制率分别是(14.31±0.79)%、(23.94±1.23)%、(32.36±1.72)%和(61.78±1.48)%;48 h各组的增殖抑制率分别是(8.47±1.73)%、(46.32±6.45)%、(54.40±1.30)%和(65.86±2.76)%。在Bel-7402肝癌细胞中,24 h各组的增殖抑制率分别是(7.43±1.65)%、(34.82±3.23)%、(44.87±7.34)%和(58.50±0.40)%;48 h各组的增殖抑制率分别是(8.77±1.90)%、(33.87±036)%、(42.61±9.50)%和(56.75±0.55)%。单独应用索拉非尼或 JQ1以及JQ1联合索拉非尼组均可在体外抑制肝癌细胞的增殖,与单药组比较,联合用药组的增殖抑制率提高,差异有统计学意义(FHepG2,24 h=243.177,FHepG2,48 h=30.012,FBel-7402,24 h=7.62,FBel-7402,48 h=12.437,均P<0.05)。
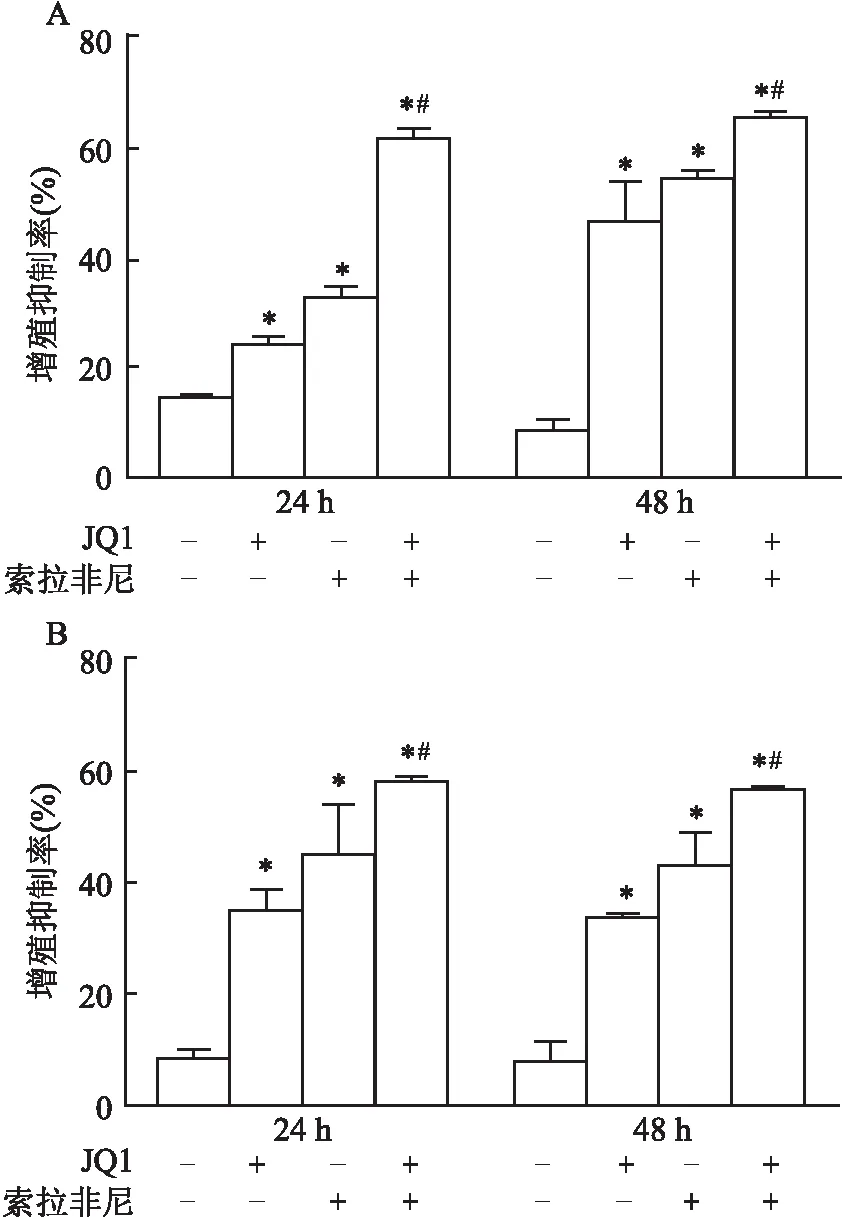
图1 JQ1联合索拉非尼对肝癌细胞增殖率的影响
2.2 JQ1联合索拉非尼对HepG2和Bel-7402肝癌细胞的凋亡作用使用Annexin V-FITC / PI流式细胞术测定对照组、JQ1(5 μmol/L)、索拉非尼(10 μmol/L)、JQ1联合索拉非尼作用于HepG2和Bel-7402肝癌细胞24 h或48 h后的细胞凋亡率(图2)。结果显示,在HepG2肝癌细胞中,24 h各组凋亡率分别是(6.53±1.60)%、(9.03±1.44)%、(18.97±2.74)%和(34.00±4.14)%;48 h各组凋亡率分别是(4.57±0.85)%、(12.20±1.78)%、(27.96±7.59)%和(59.73±2.12)%。在Bel-7402肝癌细胞中,24 h各组凋亡率分别是(7.23±1.53)%、(10.83±1.70)%、(16.20±1.75)%和(26.30±1.43)%;48 h各组凋亡率分别是(7.87±0.63)%、(9.57±0.39)%、(16.60±4.65)%和(48.83±3.77)%。结果显示JQ1联合索拉非尼处理后,HepG2和Bel-7402肝癌细胞凋亡增加,差异有统计学意义(FHepG2,24 h=11.016,FHepG2,48 h=18.125,FBel-7402,24 h=8.174,FBel-7402,48 h=51.243,均P<0.05)。
图2 JQ1联合索拉非尼对肝癌细胞凋亡的影响
2.3 JQ1联合索拉非尼对c-MYC、Bcl-2、BIM表达的影响通过Western blot检测JQ1联合索拉非尼对HepG2和Bel-7402细胞中c-MYC和凋亡蛋白Bcl-2,BIM的表达的影响,在索拉非尼和JQ1单独用药组,Bcl-2和c-MYC表达降低,BIM表达增加,以联合用药组最为明显(图3)。
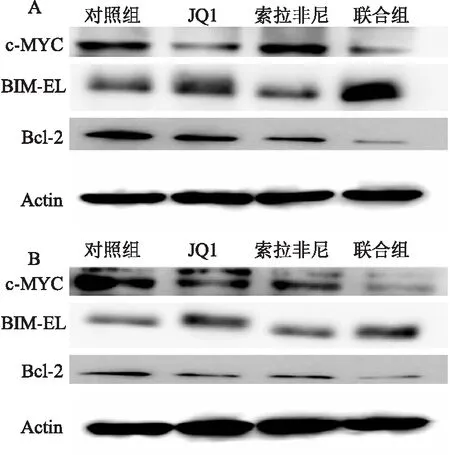
图3 JQ1联合索拉非尼对c-MYC、Bcl-2、BIM表达的影响
3 讨论
索拉非尼是一种口服多激酶抑制剂,是治疗晚期肝细胞癌(hepatocellular carcinoma,HCC)的重要靶向药物。但其疗效尚不满意[5],因此,发现新的干预手段以期提高肝癌细胞对靶向药物的敏感性,是一种治疗肿瘤的新策略。
研究[9]表明在Bcl-2家族的多种成员中,Bcl-2是最主要的凋亡抑制基因,BIM是Bcl-2家族蛋白中最重要的成员,在Bcl-2家族蛋白的4个结构域(BH1~BH4)中,BIM与BH3具有相同的结构域,在本质上具有高度促凋亡作用。BIM在生理和病理生理条件下都启动了内在的凋亡通路。BIM表达的减少与肿瘤的促进和自身免疫有关,而过表达则抑制肿瘤生长和耐药性,因为癌细胞会抑制BIM的表达和稳定性[10]。c-MYC基因通过易位、扩增和突变参与许多肿瘤癌变过程,如神经母细胞瘤、乳腺癌、胰腺癌、结肠癌、前列腺癌等[11]。本研究Western blot结果显示,各给药组均可促进了BIM的表达,抑制Bcl-2的表达,致使HCC细胞的凋亡。以联合用药组最为显著,JQ1和索拉非尼联合应用可能存在协同作用。
综上所述,一定浓度JQ1能增强索拉非尼对肝癌细胞的增殖抑制及凋亡作用,其机制可能在于通过下调Bcl-2和c-MYC的表达,上调BIM表达,JQ1和索拉非尼联合应用可能存在协同作用,为肝癌的治疗提供新思路。但是本研究只是在细胞水平的初步探讨, 还需要大量的动物和临床试验进一步证明。

