ABT-737诱导秀丽线虫生殖腺细胞凋亡及机制研究
齐晓静,陈 斌,赵国平
ABT-737是美国Idun实验室和Abbott实验室研发的一种与Bcl-2同源结构域3(Bcl-2 homology 3,BH3)结构类似的模拟物,抑制B细胞淋巴瘤2基因(B-cell lymphoma gene 2,Bcl-2)家族抗凋亡蛋白Bcl-xL、Bcl-2和Bcl-w的活性。已有实验数据表明ABT-737是有效的凋亡诱导剂[1]。但是,针对ABT-737的研究主要集中在体外培养的细胞,这具有生理受限的缺点。目前,仍然不清楚ABT-737在活体动物细胞触发的凋亡中所涉及的关键途径。秀丽线虫作为模式动物,是许多人类疾病和药物研究的有用模式动物。秀丽线虫生殖腺细胞凋亡是正常卵子发生期间或在细胞质胁迫下发生在性腺环路区域的重要生物学事件,其中的调控因子从线虫至人进化保守。根据先前研究报道,秀丽线虫的生殖腺细胞对外部刺激因子极为敏感,是一种有价值的研究体内凋亡信号通路的生物学模型[2-3]。该实验利用秀丽线虫作为多细胞真核活体动物模型,深入研究ABT-737对秀丽线虫生殖腺细胞凋亡的影响及其作用机制,为今后对ABT-737和秀丽线虫的研究提供进一步实验数据。
1 材料与方法
1.1 材料实验所用线虫品系均购自美国秀丽线虫遗传中心。实验中涉及到的线虫品系如下:野生型秀丽线虫:N2 Bristol。凋亡基因egl-1突变品系:MT1082:egl-1(n487)。DNA损伤检验点突变品系:WS2277:hus-1(op241)。p53同源蛋白cep-1突变品系:VC172:cep-1(gk138)。活性氧自由基(reactive oxygen species,ROS)水平检测品系:CF1553:muls84[(pAD76)sod-3p::GFP+rol-6(su1006)]。MAPK/JNK通路突变品系:VC8:jnk-1(gk7)、FK171:mek-1(ks54);sek-1(qd127)。
1.2 主要实验试剂ABT-737购自美国Med Chem Express公司。吖啶橙(acridine orange,AO)、二甲基亚砜(dimethyl sulfoxide,DMSO)、琼脂粉、蛋白胨、胆固醇均购自生工生物工程(上海)股份有限公司。叠氮化钠(NaN3)购买自北京索莱宝科技有限公司。氯化钠、氯化钙、硫酸镁、磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、氢氧化钠等均购自上海国药集团化学试剂有限公司。
NGM固体培养基:取17 g琼脂粉、2.5 g蛋白胨、3 g氯化钠溶于975 ml超纯水中,121 ℃高压灭菌,冷却至60 ℃,在无菌环境中,加入1 ml经过灭菌的1 mol/L氯化钙、1 mol/L硫酸镁、5 g/L胆固醇(乙醇为溶剂)以及25 ml的1 mol/L磷酸钾缓冲液(3.56 g磷酸氢二钾和10.83 g磷酸二氢钾溶于100 ml超纯水中,高温灭菌后使用),混匀后倒入培养皿中,待其冷却凝固后,上铺一层经37 ℃、200 r/min培养14 h左右的OP50菌液,将NGM板烘干即可使用。
M9缓冲液:取3.0 g磷酸二氢钾、6.0 g磷酸氢二钠、5.0 g氯化钠溶于1 L超纯水中,121 ℃高压灭菌,灭菌后加入1 ml无菌的1 mol/L硫酸镁,混匀分装。
1.3 线虫培养及同步化所有线虫在20 ℃恒温避光培养,以尿嘧啶缺陷型大肠杆菌OP50为食物,培养基为NGM固体培养基或M9液体培养基。同步化处理:将处于产卵期的成虫用M9缓冲液冲洗至离心管中,将M9线虫缓冲液、次氯酸钠溶液和5 mol/L的氢氧化钠溶液以7 ∶2 ∶1的体积比混合均匀,待虫体裂解后,离心去上清,反复冲洗沉淀后,将所得受精卵均匀分散至3 ml的M9缓冲液中,20 ℃避光培养(≥18 h)即可得到L1期的幼虫。将上述所得幼虫接种到平铺OP50的NGM板上培养,就可得到同步化生长的线虫。
1.4 ABT-737处理液配置ABT-737用DMSO溶解配制成浓度为50 mmol/L的储存液,取部分储存液稀释成5、10、20 mmol/L的处理液,-20 ℃保存待用。实验时用M9缓冲液稀释至实验所需要的浓度5、10、20 μmol/L。DMSO在总体积中含量为1‰。
1.5 生殖腺细胞凋亡检测将同步化的秀丽线虫培养至L4期后,将线虫在Control组(1‰的DMSO)和实验组(不同浓度的ABT-737处理)条件下液体培养24 h,从24孔板中收集线虫,以20 mg/L的吖啶橙20 ℃避光染色1 h。染色结束后,将线虫转移至新的含有OP50的NGM板上恢复45 min,使肠道内及表皮上的吖啶橙清除干净。之后,用NaN3麻醉线虫并通过Leica正置荧光显微镜(DM4B)观察凋亡细胞,凋亡细胞呈致密的亮黄色。
1.6 活性氧水平检测CF1553线虫是超氧化物歧化酶3(SOD3)的绿色荧光品系,超氧化物歧化酶(SOD)是线虫体内清除ROS的首要物质,线虫体内SOD水平的高低与ROS水平直接相关,SOD3是其中表达变化最明显的,因此利用荧光品系CF1553线虫进行ROS水平的检测[4]。同步化处理后培养至L4期的CF1553线虫经ABT-737处理24 h后,挑取线虫至载玻片上,并用NaN3麻醉线虫。使用Leica正置荧光显微镜的常规绿色荧光观察,在同一设置条件下对线虫进行图像摄取,摄取的图像用软件ImageJ测量每条线虫的相对荧光,统计线虫的平均相对荧光。
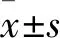
2 结果
2.1 ABT-737诱导线虫生殖腺细胞凋亡将同步化的N2野生型线虫培养至L4期,暴露于含0、5、10、20 μmol/L的ABT-737液体环境中24 h后,探究ABT-737对秀丽线虫生殖腺细胞凋亡的影响。在浓度为10、20 μmol/L的ABT737处理N2线虫后,野生型线虫N2的凋亡细胞数目从(2.31±0.06)个增加至(4.02±0.09)、(4.40±0.08)个,见图1A。与Control组比较,ABT-737处理线虫后凋亡细胞数目增加(P<0.05),表明ABT-737以剂量依赖的方式诱导秀丽线虫生殖腺细胞凋亡。

图1 ABT-737诱导线虫生殖腺细胞凋亡
2.2 ABT-737通过调控ROS来诱导生殖腺细胞凋亡本实验利用SOD3的荧光强度来检测ROS的产生,探讨ROS在ABT-737诱导的生殖腺细胞凋亡中的作用。对荧光品系CF1553线虫进行20 μmol/L ABT-737药物处理24 h,将Control组相对荧光强度设为1,与Control组比较,20 μmol/L ABT-737处理线虫后CF1553线虫的荧光强度增加,相对荧光强度上升至Control组的(1.30±0.02)倍(P=0.001 6),即说明ROS水平上升。见图2。
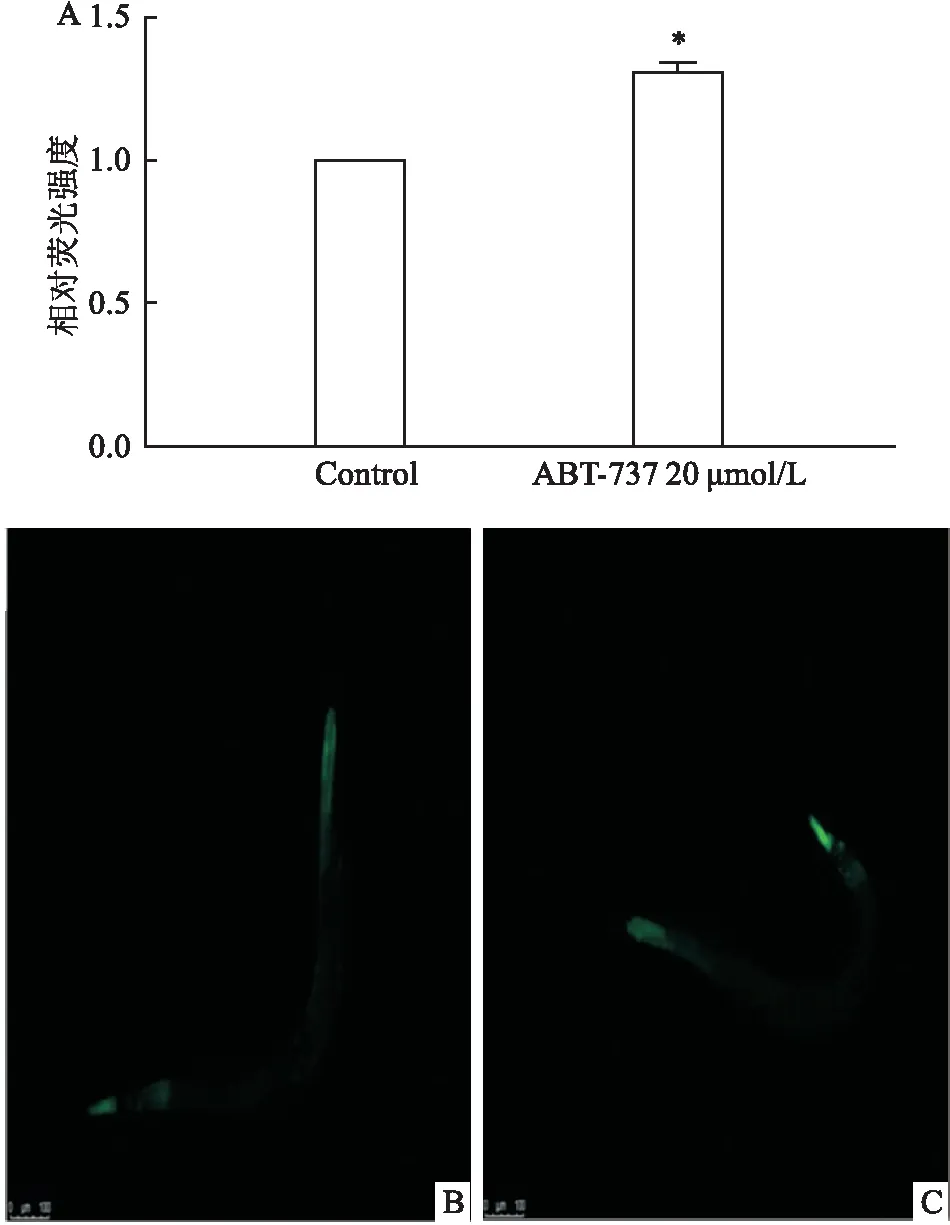
图2 ABT-737通过调控ROS来诱导生殖腺细胞凋亡
2.3 ABT-737通过JNK通路调控生殖腺细胞凋亡本实验利用mek-1、jnk-1(JNK通路中的作用因子)这2种缺陷型线虫品系验证JNK通路是否参与细胞凋亡。20 μmol/L ABT-737处理24 h后,mek-1和jnk-1这2种缺陷型品系线虫的凋亡细胞数未有增加,见图3。结果表明,JNK通路参与调控ABT-737诱导的生殖腺细胞凋亡。
2.4 DNA损伤应答途径参与ABT-737诱导生殖腺细胞凋亡为了检查DNA损伤应答途径与ABT-737诱导的细胞凋亡的关系,将L4期的hus-1、cep-1、egl-1缺陷型线虫品系暴露于20 μmol/L ABT-737中24 h。与Control组比较,20 μmol/L ABT-737处理未能引起这3种线虫品系的生殖腺细胞凋亡的增加,见图4。这些数据表明,这些DNA损伤应答基因对ABT-737诱导的生殖细胞凋亡是不可缺少的,DNA损伤应答途径参与ABT-737诱导的生殖细胞凋亡。
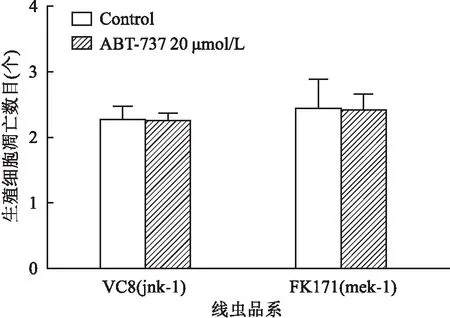
图3 ABT-737通过JNK通路调控生殖腺细胞凋亡
图4 DNA损伤应答途径参与ABT-737诱导生殖腺细胞凋亡
3 讨论
ABT-737作为一种BH3结构类似的模拟物,是Bcl-2家族抗凋亡蛋白Bcl-2、Bcl-xL、Bcl-w的一种强有力的抑制剂,ABT-737对许多肿瘤细胞的生存至关重要,能够诱导体外培养的肿瘤细胞凋亡。但是,越来越多的证据表明[5-6],在体外细胞培养系统中研究潜在的候选药物的生物学效应具有生理机制的局限性,比如无法模拟体内环境对药物生物学效应的影响。为了克服体外细胞培养研究的缺点,且由于秀丽线虫的基因组与人的基因组有40%~60%的相似性,本研究以秀丽线虫作为多细胞真核生物模型,探究ABT-737在活体生物上对线虫内源性生殖腺细胞凋亡的影响及其作用机制。
在先前细胞研究中,ABT-737通过与Bcl-2的结合从而降低正常状态的Bcl-2/Bax异质二聚体, 激活Bax活性,从而改变线粒体膜通透性,激活细胞内源性凋亡通路,并且ABT-737还会诱导产生ROS,并激活JNK通路,进而诱导肿瘤细胞凋亡[7-8]。在本研究中,ABT-737与在细胞中的作用相同,可以诱导线虫生殖腺细胞凋亡,且产生ROS。ROS水平上升触发的主要信号传导途径是DNA损伤反应途径[9]。在秀丽线虫中,hus-1是DNA损伤诱导细胞凋亡所必需的检查点基因,DNA损伤反应被认为是秀丽线虫生殖腺细胞中应激诱导的细胞凋亡的重要触发因素。作为抑癌蛋白p53的同源物,cep-1对秀丽线虫中DNA损伤剂诱导的凋亡也至关重要。hus-1将DNA损伤应答信号传输到cep-1,cep-1随后通过促进靶基因egl-1的转录来促进凋亡信号[10-13]。本研究的结果验证了这一通路中的3种作用因子在ABT-737诱导的线虫生殖腺细胞凋亡中起作用。在秀丽线虫和哺乳动物中JNK通路具有保守性,mek-1和jnk-1这2个基因是 JNK通路中的作用因子,在激活JNK通路中起重要作用。其中mek-1与人MAP2K7基因同源,jnk-1与人MAPK10基因同源,在mek-1和jnk-1缺陷型线虫中发现这2种基因参与ABT-737诱导的线虫生殖腺细胞凋亡。以上这些结果初步说明,ABT-737能使秀丽线虫产生大量ROS,激活氧化应激反应进而会触发JNK/MAPK通路和DNA损伤应答途径,诱导最终凋亡的发生。
本研究证实ABT-737在秀丽线虫活体水平上诱导生殖腺细胞凋亡发生。研究结果对活体动物内源性细胞中ABT-737触发的信号传导途径有了新的认识,为今后对ABT-737和秀丽线虫的研究提供了进一步的实验数据。

