线虫液体培养和监测过程关键参数的实验研究
张 普,王 巍,卢盈宇,元姝棋,杨倩倩,钟润涛,孙野青
(大连海事大学环境科学与工程学院环境系统生物学研究所,大连116026)
1 引言
秀丽隐杆线虫[1](Caenorhabditis elegans)具有个体小、抗逆性强、容易搭载等优点,是一种非常适合空间生物学研究的模式生物[2]。 在生长环境对线虫不利时,线虫在L2 期后会激活一个特殊时期——道尔期[3],进入道尔期的线虫不再进食,停止发育,该时期的线虫对恶劣环境抵抗力较强。 目前航天飞机计划STS[4-6]及DELTA MISSION(ICE-FIRST)任务中[7-8]已搭载有很多线虫实验。 但这些研究表明,无论采用固体培养装置还是液体培养装置进行在轨培养,飞行器返回后线虫都是多代混淆的群体状态,这种混淆状态对线虫研究结果的稳定性和重现性有很大影响。Xu 等[9]为了避免多代样品间的干扰,利用无菌固体培养基诱导道尔期线虫,进行了神舟8 号飞船搭载实验,飞船返回后对野生型线虫和微重力感受缺失线虫及辐射损伤修复缺失型线虫进行比较,研究了空间辐射与微重力效应,揭示了空间生物学效应的功能基因组和转录后调控相关的通路。 上述提到的所有研究均是线虫在返回后进行的结果分析。 为了能在空间环境中在轨监测当代线虫的状态,特别是线虫个体发育的不同阶段在微重力环境下的变化特点,需要利用微纳流控技术[10]进行单线虫的培养和监测。
中国空间站使用微流控芯片在轨进行线虫生长发育的观察和分析,首先要解决线虫的培养环境问题,因为自动化培养需要使用流体控制,而线虫传统培养环境为固体培养基;其次是芯片的设计问题,芯片的通道设计依赖培养线虫的身体大小,并且芯片培养线虫时的培养时间和换液时间也需要考虑到线虫的生活习性;最后对线虫进行观测时的光照是否对线虫产生影响及影响的程度也需要确认。
综上,为实现线虫在微流控芯片上的培养,本文使用小体系培养和筛选线虫方法,解决如何获取适应液体环境的秀丽隐杆线虫问题,并且对适应液体环境的线虫进行一系列指标的测量,获取体长、体宽发育曲线、产卵期和存活曲线,并确认观测时的光照对线虫发育的抑制作用。
2 材料与方法
2.1 材料
实验室中线虫主要在NGM (Nematode Growth Medium)培养基上生长[2],以尿嘧啶营养缺陷型大肠杆菌OP50 为食,Szewczyk[11],Samuel 等[12]的研究已经证实,线虫除用NGM 固体培养基之外,还可以生长在液体培养基中。 液体培养基又分为有菌液体培养基和无菌液体培养基,其中有菌液体培养基以S.Medium[2]为代表,无菌液体培养基以C.elegansMaintenance Medium(CeMM)[11]和C.elegansHabituation and Reproduction Media (mCeHR)[12]为代表。 S.Medium 培养基基本成分与NGM 培养基类似,通过添加大肠杆菌OP50 作为食物,但是在S.Medium生长中的线虫比NGM 上的线虫更细更长。CeMM 和mCeHR 培养基中明确添加了线虫生长所需的全部营养元素,不需要额外添加大肠杆菌作为线虫的食物来源,所以可以减少耗氧需求,比传统的NGM 方法培育起来更简单。 适应CeMM 培养环境的线虫从卵至成虫的发育周期为6 ~8 天,适应mCeHR 培养基的线虫发育周期较快,为2 ~3 天。 CeMM 培养基曾被多次应用于线虫的空间搭载实验中[7-8],并且CeMM 近似黄色透明状态,视野清晰,不影响线虫生长状态的观察。 mCeHR 培养基规定的营养成分与CeMM 相似,额外添加了血红素/脱脂牛奶等,但由于脱脂牛奶成分并不明确,mCeHR 并不能称之为完全稳定化学成分定义的培养基。 李孟惠[13]实验证明,不同品牌牛奶会对线虫的发育有不同的影响,并且由于mCeHR 里含有的牛奶具有胶体性质,相对于CeMM 更加浑浊。 根据在轨线虫监测的需要,CeMM 相对更占优势,所以选用CeMM 培养基为实验用的液体无菌培养基。
秀丽隐杆线虫野生型N2来自美国线虫遗传中 心( Caenorhabditis Genetics Center, CGC)。CeMM 培养基配制参考Szewczyk[11]的研究,其中部分药品调整如表1 所示。

表1 CeMM 配置药品调整表Table 1 Reagent modification for CeMM preparation
2.2 线虫同步化
在超净台中将培养瓶中处于妊娠期的线虫取出至15 mL 离心管中。 1 000 rpm离心1 min,弃上清。 加入无菌水洗涤,重复3 次。 最后一次弃上清,剩下3.5 mL 包含线虫的液体。 离心管内加入0.5 mL 5M 氢氧化钠和1 mL 次氯酸钠(有效氯浓度≥5%),摇晃混匀,每隔2 min 混匀一次,肉眼观察至线虫虫体溶解时,加入M9 溶液终止反应,裂解时间约5 min 30 s(当观察到液体变浑浊,大部分线虫溶解时停止)。 反应完成后4 000 rpm离心1 min。 弃上清,加入10 mL 无菌M9 进行冲洗,摇晃混匀。 重复该步骤2 次至PH约为7,离心后的沉淀即为虫卵。 再将虫卵转移至加有CeMM 的6 孔板中,将含虫卵的6 孔板放置于脱色摇床上孵化。 待虫卵孵化后,用移液器将聚集漂浮于液面上未孵化的线虫卵及杂质吸除,留下的即为同步化后的L1 期线虫。
2.3 线虫的驯化
线虫在实验室内主要在NGM 平板上生长,为了得到适应CeMM 液体生存环境的线虫,需要对线虫进行驯化,从而获取稳定的CeMM 品系线虫,过程如下:将NGM 上的N2线虫同步化后得到虫卵,将虫卵转移至20 管预先加入200 μL CeMM 的PCR 管中,在20 ℃下培养至第7 ~10天,开始每天观察,筛选出未染菌的PCR 管,并且观察管中线虫是否处于正常生长状态,直至观察到有成虫出现时,将成虫取出至6 孔板中CeMM培养,该线虫即为初代驯化线虫。 将该线虫的后代扩大培养,再重复进行同步化操作获取下一代线虫,直至线虫培养体系稳定不染菌,并且线虫从卵至成虫的发育时期稳定在一个固定时间(不同品系的线虫发育时间不一致,CeMM 中的N2从虫卵发育到成虫约为6 ~8 天),即视为获取到适应液体无菌培养基的线虫。 获取到驯化线虫后,可使用细胞培养瓶和CeMM 进行大体系培养。
2.4 体长及体宽测量
适应CeMM 环境的线虫生长指标有非常明显的变化,所以需要测量生长发育关键指标如从幼虫发育至成虫过程中的体长和体宽的增长、产卵期、寿命等来为微流控芯片设计提供参考支持。
采用Motic 显微镜配套图像分析软件Motic Image Plus 3.0 进行线虫显微图像分析和测量。测量体长时选取线虫身体的中间位置,测量线虫体宽时选取线虫咽部位置。 体长、体宽测量如图1所示。

图1 体长(左)体宽(右)测量示意图Fig.1 Schematic of body length (left) and body width (right) measurement
2.5 产卵期测定
将同步化后的线虫稀释加样至96 孔板中,选取只有1 条线虫的孔进行跟踪,第4 天开始连续每天观察,直到观察到孔内出现子代L1 期幼虫,向前推一天,即为产卵的起始时间(观察时显微镜的光强用光度计调至700 lux)。 每天对幼虫计数并记录,幼虫数量即视为产卵数量。 数据统计直至母代线虫所产下的子代产卵或者一些孔内已无法用肉眼进行计数为止。
2.6 寿命测定
由于线虫产的卵发育成子代后很快就会发育成母体大小,导致分辨不清母代和子代,因此对线虫寿命的测定通常使用FudR (5-fluoro-2′-deoxyuridine) 抑制线虫产卵,Van raamsdonk 等[14]研究表明FudR 对野生型线虫寿命影响很小。 将同步化后的线虫稀释加样至96 孔板中并记录加入的线虫数量,在20 ℃下培养至第3 天时,用移液枪向孔内CeMM 培养基中加入FUdR 抑制线虫产卵(FUdR 在去离子/蒸馏水中稀释并添加到CeMM 至终浓度为40 mol/L)。 观察记录孔内线虫是否存活(若线虫不动,则用振动刺激线虫,观察线虫是否有反应),每天记录存活的线虫数量,并和加入的线虫总数量对比,从而计算出每天线虫群体的存活率,绘制出线虫的存活曲线,通过存活曲线可观察线虫的整体寿命。
2.7 显微镜光照梯度实验
线虫正常生长在黑暗中,对适应黑暗培养环境的线虫来说,显微镜持续观察时的光照会引起线虫发育的不稳定。 夏志涛[15]研究指出不同波长的光对线虫发育有不同的影响,为了确定在轨监测中显微镜光照因素对线虫的影响,需进行光照强度参数的分析。
使用96 孔板培养线虫,每天分别用卤素灯光源显微镜(Motic AE21)和LED 光源显微镜(Motic AE2000)持续对每孔中的线虫照射2 min,观察同步化后的线虫在CeMM 中的发育情况,按光照强度分为700 lux,5 000 lux,15 000 lux 3 组。 在光照刺激的同时,拍摄线虫图像,进行体长、体宽的测量。 黑暗组提前准备好每天使用的孔板,拍照测量完之后即丢弃该板,第2 天使用新的孔板进行测量。 从L1 幼虫观察至发育为成虫。 上述步骤涉及到的含线虫的96 孔板,除光照刺激时,均在温度20 ℃,相对湿度80%的恒温恒湿培养箱中避光培养。
3 结果与讨论
3.1 N2 线虫在CeMM 中的驯化
按照2.3 节中的实验方法,在CeMM 中成功驯化了来源为固体NGM 培养的N2线虫,驯化后的线虫可以在完全无菌的CeMM 培养基中生长繁殖(图2),并且从L1 幼虫发育至成虫稳定在(7±1)天(图3),可以进行大体系的扩繁和同步化操作(实验所用液体培养环境的线虫来源均为此次驯化后的野生型线虫)。 需要注意的是在获取初代线虫时(即从NGM 首次转移至CeMM)极易染菌,所以将其分装到多管小体系的PCR 管中,分散染菌风险,并且可以通过筛选小体系中发育较好的线虫,单独分离培养,加快获取适应液体环境的线虫速度。

图2 适应CeMM 的N2 线虫生存状态Fig.2 Survival status of N2adapted to CeMM
对驯化后的CeMM 线虫进行了一系列生长指标的测量,并与NGM 上生长的线虫进行比较,包括体长、体宽、产卵期、寿命等。 这些指标与NGM 线虫相比存在较大差异。

图3 驯化后的线虫在CeMM 中第1 ~8 天的发育过程Fig.3 Developmental process of domesticated nematodes from day 1 to day 8 in CeMM
3.1.1 N2线虫在CeMM 发育的体长体宽
通过跟踪驯化后的CeMM 线虫发育,测量每天的线虫体长、体宽的增长幅度。 与NGM 上生长的野生型线虫相比(图4、图5),发现适应CeMM 环境的线虫生长缓慢,在相同的发育天数,CeMM 中的线虫体长比NGM 上的线虫短,体宽比NGM 上的线虫细。 线虫体宽变细对微流控芯片的线虫控制通道的设计和加工制作提出了更加精细的要求。 线虫每天的体长和体宽变化数据(图6)可以给线虫微流控芯片提供设计理论支持,其体长由发育第1 天L1 期平均184.65 μm 增长到成虫期平均996.60 μm,最长可达1 128.94 μm;体宽由L1 期平均14.62 μm 增长至成虫期35.32 μm,最宽可达39.23 μm。
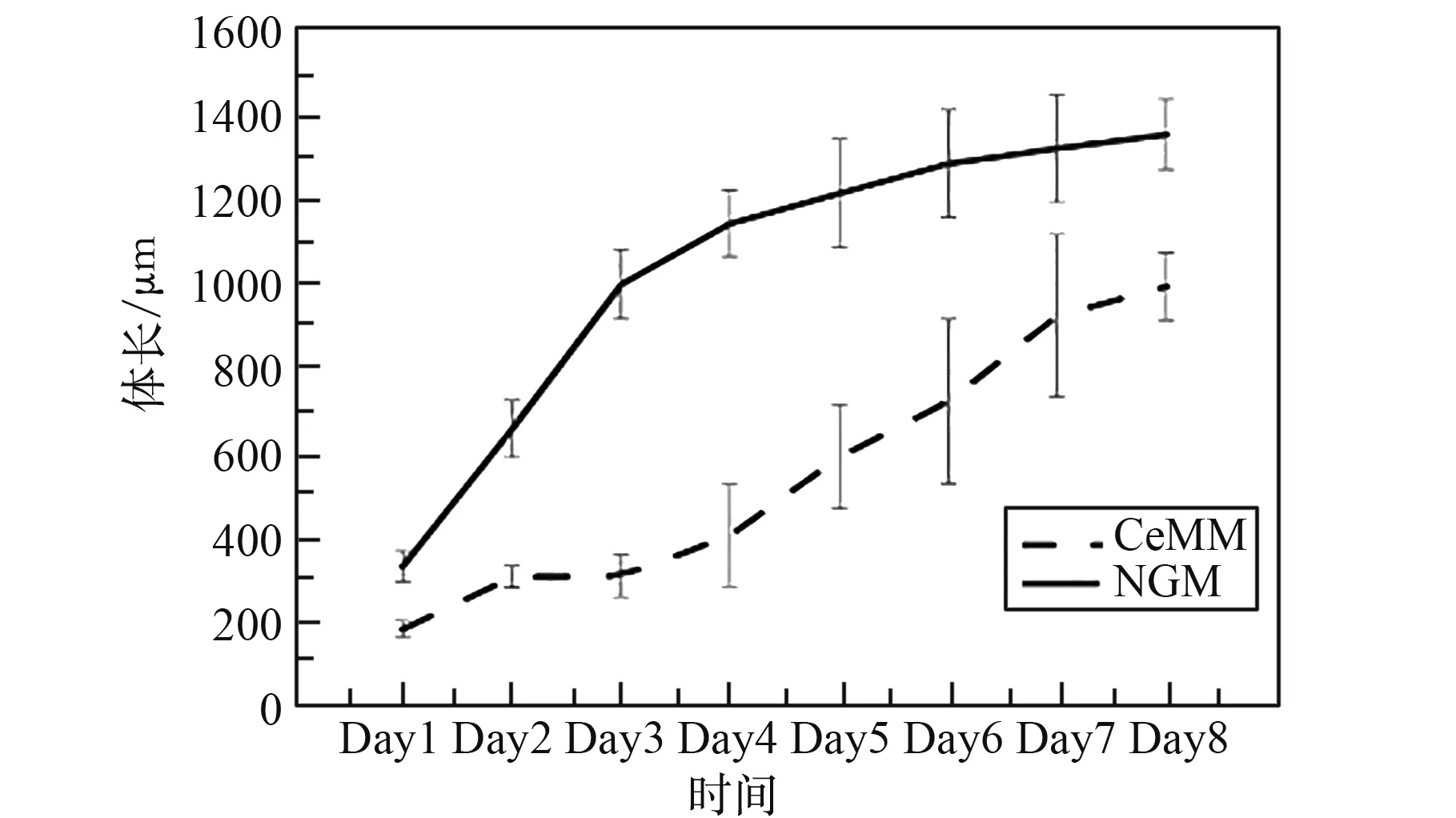
图4 CeMM 中生长的线虫与NGM 上线虫的体长对比(N≥15)Fig. 4 Comparison of body length of nematodes grown in CeMM and nematodes grown on NGM (N≥15)
3.1.2 N2线虫在CeMM 发育的产卵期
线虫除了体长和体宽发生变化,适应CeMM的线虫的产卵期也发生了改变。 目前利用96 孔板进行液体培养无法清除线虫的卵,卵发育至成虫会产生混淆导致无法统计,所以该实验只能进行到发育的第14 天。 统计如图7 所示,NGM 上线虫的产卵从第3 天开始,第6 天后基本结束;而CeMM 上的线虫产卵从第7 天开始,直至第14 天时线虫体内仍可观察到有卵未产出,所以CeMM上的线虫产卵起始时间向后推迟并且整个产卵期被延长,并且其产卵量少于在NGM 固体培养基上生长的线虫产卵量。 实验结果证实,线虫可以满足在轨的相对长期观察,并且可以在第7 天后开始利用微流控技术进行液体培养基的换液,将线虫产生的子代在发育前回收至培养袋内,在不影响当代在轨监测的同时,还能获得多代混合的线虫子代供返回后分析。
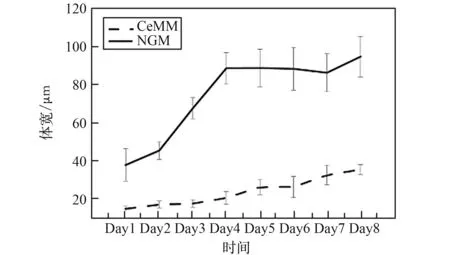
图5 CeMM 中生长的线虫与NGM 上生长的线虫的体宽对比(N≥15)Fig.5 Comparison of body width of nematodes grown in CeMM and nematodes grown on NGM (N≥15)
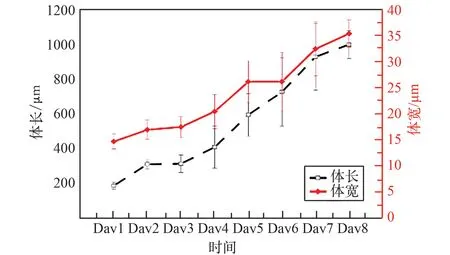
图6 在CeMM 中驯化后的野生型线虫体长体宽发育情况(N≥15)Fig.6 Body length and body width development of wild-type nematodes acclimated in CeMM (N≥15)
3.1.3 N2线虫在CeMM 发育的寿命
通过FudR 处理可以避免子代对母代线虫的混淆。 经过连续跟踪观察,在CeMM 培养基中的线虫平均寿命可延长至30 天以上,而NGM 中的线虫最长寿命仅为18 天(图8)。 在空间在轨实验中,线虫的暴露时间越长,接受的辐射量越大,所以线虫寿命的延长有利于得到更多有效的辐射损伤数据。 但在寿命观察实验中使用了FUdR 抑制线虫产卵,实验证实FUdR 对线虫的产卵行为有高效的抑制作用,在30 天内并无线虫产卵。Van raamsdonk 等[14]研究证实FUdR 不会影响生长于NGM 培养基上野生型线虫的寿命测定,但CeMM 中的线虫是否会被影响寿命暂时还未有文献报导。 所以不排除本实验中FUdR 对线虫寿命增长有促进作用,在线虫微流控芯片投入使用后将会进一步确认是否受FUdR 的影响。

图7 CeMM 中线虫与NGM 中线虫的产卵对比(N≥90)Fig.7 Comparison of nematodes oviposition data in CeMM and NGM(N≥90)

图8 CeMM 线虫与NGM 线虫寿命对比(N≥133)Fig.8 The lifespan of CeMM nematodes and NGM nematodes.(N≥133)
3.2 显微观察过程中的光照影响
实验过程中发现,每天定时利用显微镜观察产生的光照刺激对线虫的发育产生一定的生长抑制,使部分线虫发育不同步,甚至不能正常发育到成虫期(图9)。 为研究显微镜的光照强度对线虫发育的影响,确定显微镜光源的限制条件,分别利用卤素灯光源和LED 灯光源进行了3 个不同光照强度700 lux、5 000 lux、15 000 lux培养和黑暗培养线虫的对比实验,其中700 lux 强度是不影响对线虫的体长等数据测量的最低光照强度。

图9 线虫发育不同步Fig.9 Inconsistent development of nematodes
结果发现,卤素灯光源照射对CeMM 培养的N2 线虫的发育有明显的抑制作用, 体长发育对比见图10, 体宽发育对比见图11,并且随着光照强度的增强,抑制作用越明显;LED 光源照射与黑暗对照组相比对线虫也有生长抑制作用,体长发育对比见图12,体宽发育对比见图13,但抑制作用较弱,与卤素灯不同的是,生长抑制的程度并没有随着光照强度的增强而明显增强。 2 种光源照射下第7 天时不同光照组与黑暗组的体长、体宽显著性差异分析见表2。 分析原因发现,2 种光源最大的区别是LED 为冷光源,几乎不会产热,而卤素灯为热光源,产热。 所以卤素灯与LED 光源相比会随着光强的增加而增强热效应。 线虫生长温度以20 ℃为最佳,高温会抑制线虫的生长,所以卤素灯会有更强的抑制效应。
实验结果和夏志涛[15]研究中提到的光照抑制线虫发育的现象一致,但文献[15]中使用的是NGM 培养的线虫,本实验是CeMM 中培养的线虫,这可以证明在不同培养基上线虫的生长都会受到光照抑制。 实验结果提示在空间站线虫在轨监测过程中,数据采集模块的光源要采用冷光源,并且在保证获取实验数据的前提下,尽量减少光照强度和光照时间,最大化减弱光照对线虫的影响。
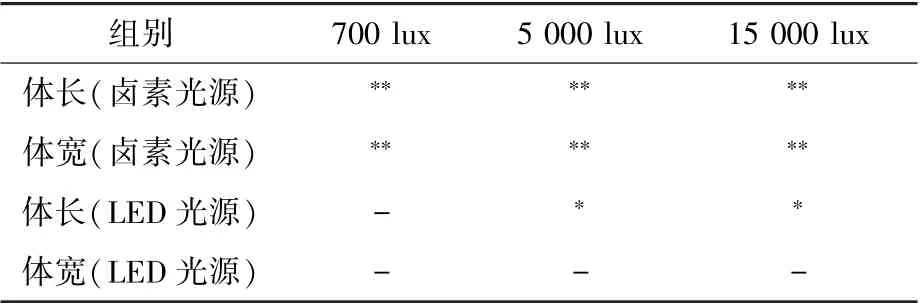
表2 不同光强光照与黑暗培养线虫发育显著性差异分析(DAY 7)Table 2 Analysis of significant difference between the light groups and the dark group (DAY 7)
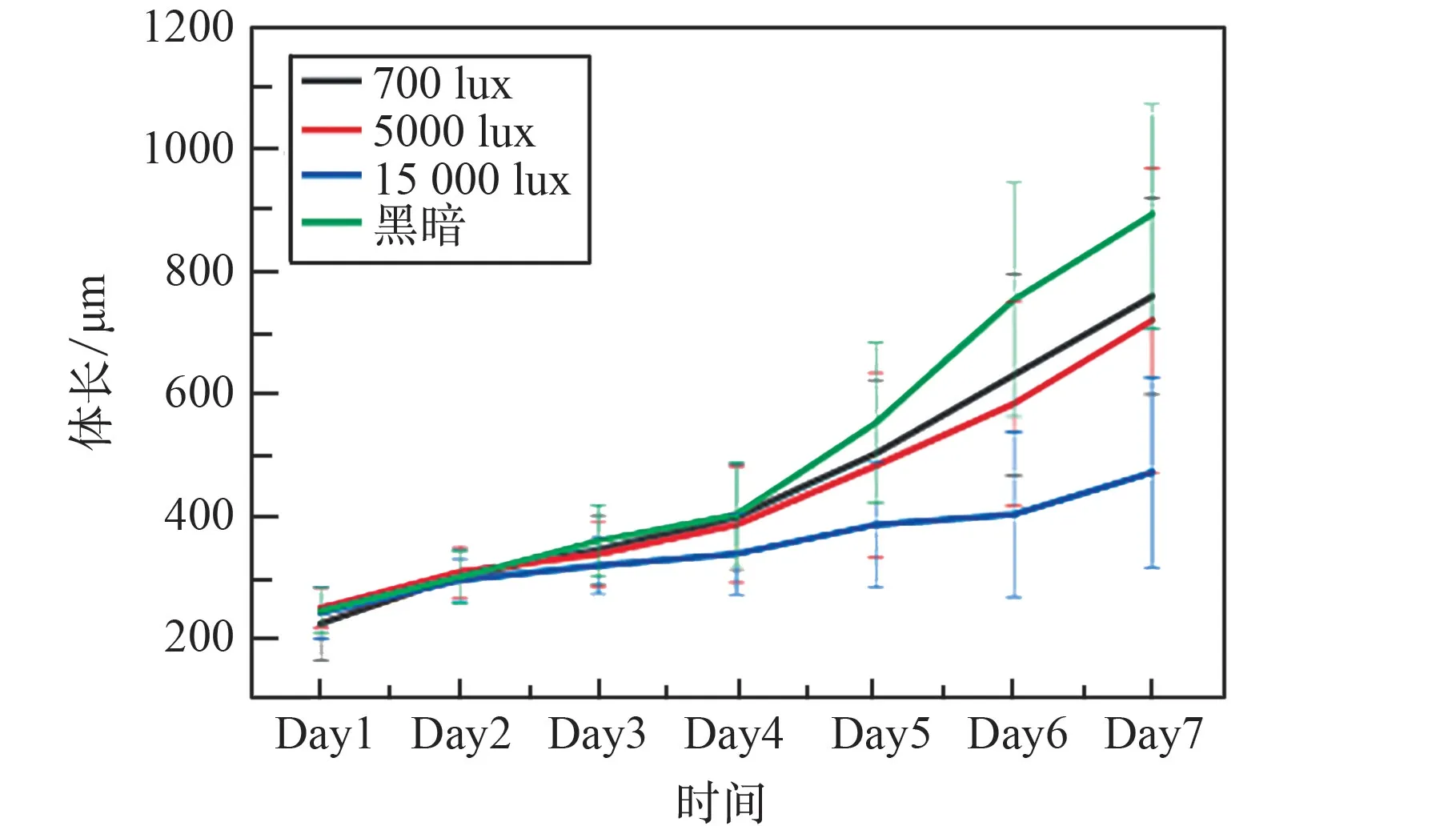
图10 3 个光照处理组和黑暗对照组的体长发育对比(卤素灯)Fig.10 Comparison of body length development between three light treatment groups and the dark control group (Halogen lamp)

图11 3 个光照处理组和黑暗对照组的体宽发育对比(卤素灯)Fig.11 Comparison of body width development between three light treatment groups and the dark control group (Halogen lamp)

图12 3 个光照处理组和黑暗对照组的体长发育对比(LED)Fig.12 Comparison of body length development between three light treatment groups and the dark control group (LED)

图13 3 个光照处理组和黑暗对照组的体宽发育对比(LED)Fig.13 Comparison of body width development between three light treatment groups and the dark control group (LED)
4 结论
本文对在CeMM 培养基中生长的线虫的体长、体宽、寿命、产卵期以及光照条件进行分析,为在微流控芯片上使用液体培养基实现线虫自动化培养的设计提供了技术参数。
1)驯化后的N2秀丽隐杆线虫可以适应CeMM 无菌液体培养,并完成生命周期,这为微流控芯片实现自动化培养所需的液体环境提供基础。
2)CeMM 培养线虫的发育速度、产卵期和寿命与NGM 培养基相比均被延长,较长的寿命有利于观察当代样品长期暴露在太空中接受宇宙射线产生的变化;芯片通道的设计可以按照实验需求并根据CeMM 线虫每天的发育数据进行调整;产卵期数据提示可以在使用微流控芯片培养线虫至第7 天时执行换液。
3)在空间站线虫在轨监测过程中,采集光源要采用冷光源,光照强度推荐设置为700 lux,光照时间尽量减少,以最大化减弱光照对线虫的影响。

