HIF-1α及PI3K/Akt信号通路在中耳胆脂瘤中的表达及意义
马佐鹏 李全成
中耳胆脂瘤(middle ear cholesteatoma)是中耳角化鳞状上皮的肿瘤性生长,据报道在欧洲每10万人每年7~9人患病[1],是一种位于中耳的囊形结构,不属于真性肿瘤,但由于其具备肿瘤组织的内部结构,且具有侵袭性、扩张性、非正常调控的增殖和变异性,复发率高,同时大多数患者存在严重的并发症,可导致严重的骨质破坏从而影响正常听力,导致前庭功能障碍、面神经麻痹及颅内外一系列的并发症,甚至引起致命的颅内感染。胆脂瘤发展的基础是中耳腔中的异位角化上皮细胞,但其发病机制尚不完全清楚。各种分子机制,如上皮细胞的分化、增殖[2,3]、上皮细胞凋亡[4]、炎症[5]、感染[6,7]骨质侵蚀、脂质代谢[8,9]和血管生成[10],都可能在胆脂瘤的发展和行为中发挥作用。中耳胆脂瘤由于鼓室负压,上皮组织增生及袋状内陷,会形成缺氧微环境,缺氧诱导因子-1(hypoxia-inducible factor 1,HIF-1)是细胞及组织在缺氧条件下产生的一种氧依赖的转录激活因子。HIF-1由两个亚基组成,分别为HIF-1α和HIF-1β。其中HIF-1α是决定HIF-1转录活性的关键蛋白[11]。研究发现,HIF-1α与细胞的增殖凋亡密切相关[12]。而缺氧状态下激活的PI3K/AKT信号通路是否通过影响HIF-1α调节胆脂瘤细胞的增殖凋亡从而影响中耳胆脂瘤的发病成为本研究的重点。本研究通过对中耳胆脂瘤组织及原代细胞中HIF-1α及PI3K/AKT信号通路的表达,从分子水平研究缺氧环境对于胆脂瘤形成的关键作用。
1 材料与方法
1.1 材料
1.1.1 胆脂瘤组织采集:30例中耳胆脂瘤标本采集于我院耳鼻喉科住院患者,同时随机选取外耳道骨部正常组织10例为对照组,术中新鲜标本放入4%的多聚甲醛固定,常规石蜡包埋,作4 μm厚的连续切片,为后续HE及免疫组化使用。患者签署知情同意书,并经医院伦理委员会同意。
1.1.2 原代胆脂瘤细胞(MEC)培养:取5例中耳胆脂瘤组织,置于含有双抗(P/S)的PBS中,反复漂洗后,剪成5 cm×5 mm大小,4℃置于中性蛋白酶12 h,后移入胶原酶Ⅰ常温摇床30 min,用200目筛网过滤后加入教师细胞培养基漂洗,加10%的含血清完全培养基,与37℃,5%CO2培养箱中培养,隔天换液,细胞融合至80%时进行传代。
1.1.3 试剂与仪器:胎牛血清(Gibco,美国),角质细胞培养基(Gibco,美国)、胶原酶Ⅰ(Gibco,美国)、HIF-1α单克隆抗体(Santacruze,美国)、p-Akt-308单克隆抗体(CST,美国)、p-Akt-492单克隆抗体(CST,美国)、p-PI3K单克隆抗体(CST,美国)、PI3K/Akt抑制剂LY294002(Target mol,美国)、免疫组化试剂盒(碧云天,上海)。CO2培养箱(Therom,美国)、酶标仪(BIO-RAD)公司、三气培养箱(Thermo,美国)、自动细胞计数仪(BIO-RAD,美国)垂直电泳仪(BIO-RAD,美国)、Western bolt湿转仪(BIO-RAD,美国),化学发光成像系统(BIO-RAD,美国)。
1.2 方法
1.2.1 HE染色及免疫组化检测胆脂瘤及正常组织中HIF-1α的表达:每个样本取HE染色,观察其病理结构,及病理层次。石蜡切片加热后二甲苯脱蜡,梯度乙醇水化,蒸馏水冲洗后于PBS中浸泡,3%的过氧化氢去离子水孵育,高压抗原修复,山羊血清工作液孵育,滴加HIF-1α一抗,4℃摇床过夜,PBS冲洗,滴加二抗,室温孵育后PBS冲洗,滴加辣根酶标记链霉素卵白素工作液,常温孵育后,PBS清洗,DAB显色,蒸馏水冲洗后苏木素复染,二甲苯透明后封片。HIF-1α在胆脂瘤与正常组织中的表达 在400倍镜下选取5个视野进行阳性细胞计数,计算阳性细胞所占比例。判定标准:(-)<10%;(+):阳性细胞数在10%~25%;(++):阳性细胞数在26%~50%;(+++):阳性细胞数>50%。
1.2.2 胆脂瘤骨质破坏程度与HIF-1α的相关性分析:通过根据患者术前中耳CT结合文献报道[13]将胆脂瘤破坏分为3级:Ⅰ度:盾板和听小骨无可视的破坏,或仅单个听小骨破坏;Ⅱ度:鼓室天盖、2个或2个以上的听小骨破坏;Ⅲ度:听小骨完全破坏,且累及骨迷路、外耳道后壁、面神经管及内耳。对不同破坏程度与HIF-1α的不同程度阳性表达的例数进行Speraman检验分析对胆脂瘤骨质破坏程度与HIF-α阳性表达表达进行相关性分析。
1.2.3 常氧及缺氧状态下抑制PI3K/Akt通路对MEC增殖的影响:原代胆脂瘤细胞培养后 将MEC以1×105种于6孔板,分别与常氧培养箱(95%O2)及缺氧培养箱(1%O2、5%CO2、94%N2)培养,同时在缺氧及常氧状态下给予PI3K/Akt信号通路抑制剂LY294002 50 μm/ml干预MEC,分别与1 d、3 d、5 d、7 d、9 d进行细胞计数,每次计数3个复孔,取平均值后绘制细胞生长曲线。
1.2.4 缺氧条件下,HIF-1α及PI3K/Akt信号通路的改变:在缺氧条件下,给予LY294002缺氧培养48 h,快速冰上提取蛋白以防止HIF-1α降解,蛋白定量后,95℃煮蛋白定性,培养上样后,SDS-PAGE电泳,转膜,BSA封闭,HIF-1α、p-Akt-308、p-Akt-492、p-PI3K一抗封闭,4℃摇床过夜,洗膜后二抗孵育,配置显影液,上机显影。
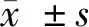
2 结果
2.1 HE染色及免疫组化检测胆脂瘤及正常组织中HIF-1α的表达 HE染色后发现胆脂瘤组织中包含上皮组织、上皮下结缔组织及焦化上皮破碎细胞成分及胆固醇结晶鳞状上皮可见局部乳头状生长,基质层中结缔组织疏松,而正常外耳道组织可清楚区分基底层、棘层、颗粒层、透明层及角质层,基质层结构整齐。免疫组化发现在胆脂瘤组织中HIF-1α的表达明显高于对照组,其中胆脂瘤中HIF-1α的表达为(++)及(+++)细胞比例明显高于对照组(P<0.05)。见表1,图1。
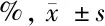
表1 不同组织中HIF-1α阳性细胞所占比例比较
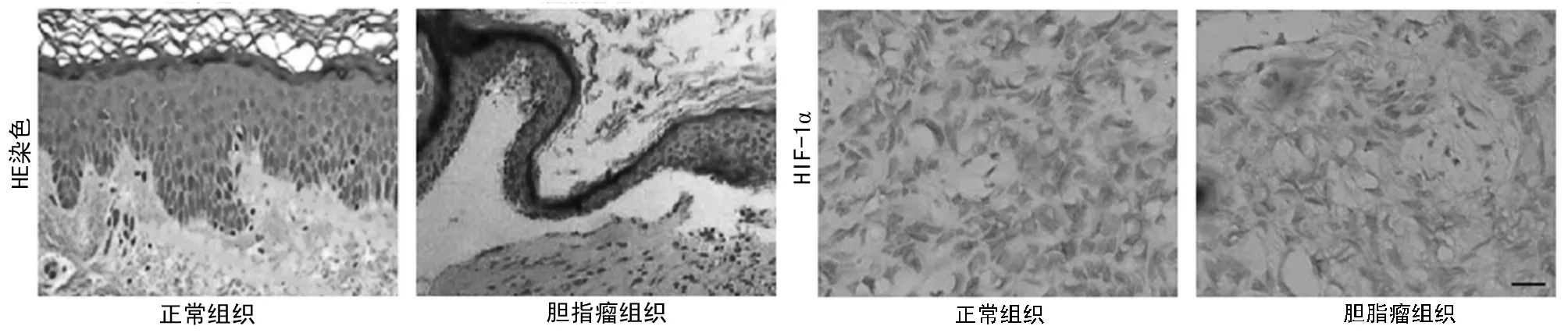
图1 HE染色后正常耳组织与胆脂瘤组织及HIF-1α的表达(HE×200)
2.2 胆脂瘤骨质破坏程度与HIF-1α的相关性分析 通过线性趋势检验(P=0.012),认为胆脂瘤骨质破坏程度与HIF-1α的表达之前存在等级相关性,Spearman等级相关系数(16.286),认为骨质瘤骨质破坏程度与HIF-1α的表达呈正相关,且相关性较强,即HIF-1α阳性表达程度越高,脂质瘤骨质破坏程度越高。见表2。
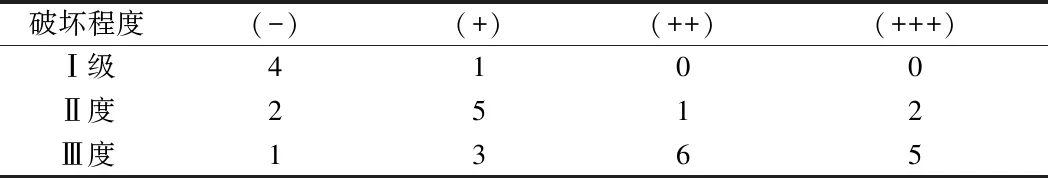
表2 胆脂瘤不同程度骨质破坏与HIF-1α表达的相关性 例
2.3 常氧及缺氧状态下抑制PI3K/Akt通路对MEC增殖的影响 将MEC分别在常氧及缺氧条件下培养,同时给予PI3K/AKT信号通路抑制剂LY294002干预48 h,在缺氧培养3 d后,MEC的增殖速度明显高于常氧培养,在缺氧5 d、7 d后,MEC的增殖较常氧增殖更为迅速。在常氧条件下给予LY294002后,MEC的增殖速度虽有所降低,但前期差异无统计学意义(P>0.05),在干预后7 d增殖速度才较常氧降低。在缺氧条件下给予LY294002干预后,在干预的3 d MEC的增殖速度明显降低,而随着缺氧培养时间的增加,对于MEC的增殖抑制作用更为明显。提示在缺氧条件下,抑制PI3K/AKT信号通路可以起到抑制MEC增殖的作用。见表3。
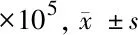
表3 不同条件下MEC细胞增殖的改变
2.4 缺氧条件下,HIF-1α及PI3K/Akt信号通路的改变 在缺氧条件下培养48 h后,发现缺氧诱导因子HIF-1α的表达明显升高,而PI3K/Akt信号通路中的关键蛋白PI3K蛋白及Akt蛋白的2个位点308、492位点都出现了不同程度的升高,说明在缺氧条件培养后,PI3K/Akt信号通路被激活。而给予PI3K/Akt信号通路抑制剂干预后,磷酸化PI3K及磷酸化Akt-308、492位点被明显抑制,与此同时HIF-1α的表达也明显降低。见图2。
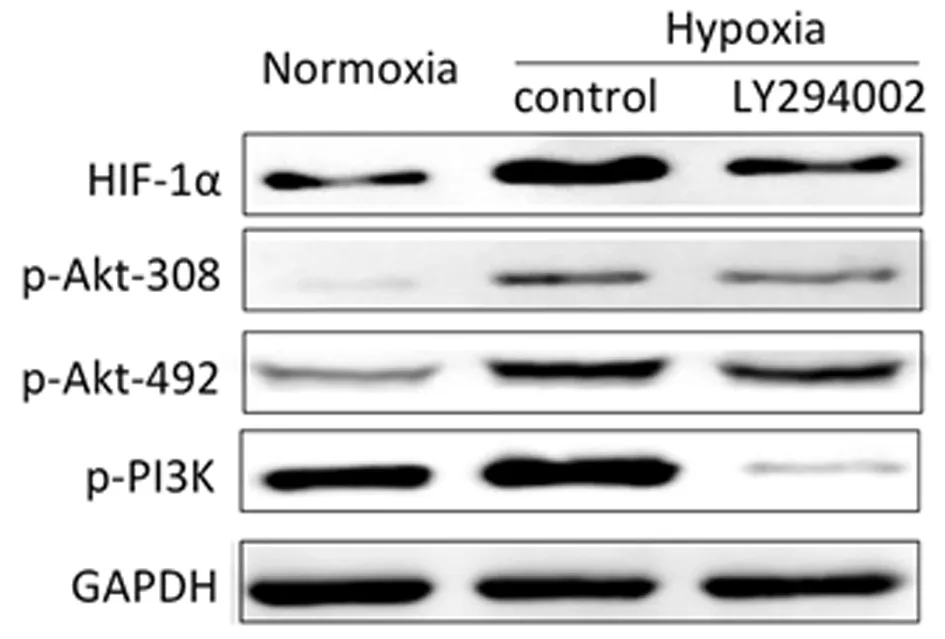
图2 缺氧条件下,HIF-1α及PI3K/Akt信号通路的改变
3 讨论
中耳胆脂瘤是耳鼻喉科常见的疾病,是一种位于中耳的囊形结构,内壁为复层鳞状上皮,囊外通过纤维组织于骨壁或组织相连,在囊内充满脱落上皮组织、角化物及胆固醇结晶,因此称为胆脂瘤。胆脂瘤虽非真性肿瘤,但由于其具有侵袭性、快速增殖、破坏骨质结构同时易复发的特性,可导致患者严重的听力下降或丧失、前厅功能紊乱,甚至引起颅内外并发症,影响患者的生命健康。目前对于胆脂瘤形成机制主要有“上皮移行学说” “袋状内陷学说”、“鳞状上皮化生学说”及“基质细胞增殖学说”等[14,15],但具体机制并不明确,由于其具有肿瘤的特性,上皮细胞过度增殖、骨质破坏吸收成为研究的重点。Yu等[16]通过对胆脂瘤的基质和前基质存在炎性细胞浸润,同时随着Toll样受体(TLR)4和促炎细胞TNF-α和IL-β表达的增加,但治理路的侵袭能力、骨质破坏能力及听力丧失程度都显著增高,Hmood等[17]通过对19例新鲜胆脂瘤组织进行前瞻性定量免疫组化研究发现,Ki-67与CK17的表达较正常组织明显升高,同时Ki-67与CK17的表达与骨侵蚀评分呈中度正相关。
胆脂瘤内大量的上皮细胞增殖氧耗量增大,而其内部血管生成的速度不能满足增殖细胞的需求,同时鼓室负压袋状内陷,使胆脂瘤内呈缺氧的状态。在多种肿瘤如肺癌[18]、乳腺癌[19]、卵巢癌[20],缺氧已被证明与肿瘤细胞的增殖、耐药、侵袭密切相关,然而胆脂瘤作为假性肿瘤此方面的研究较少。HIF-1是细胞核组织在缺氧状态下产生的一种氧依赖的转录因子,由HIF-1α与HIF-1β组成,其中HIF-1α是决定其转录活性的关键蛋白。在缺氧条件下,HIF-1已被证明可直接影响肿瘤细胞的增殖。Kim等[21]通过恶性间质瘤(HMM)进行缺氧诱导后发现,HMM细胞的体外克隆形成显著增加,同时HMM的侵袭和转移能力都显著增效,在低密度细胞的增殖速度远高于常氧条件。Bai等[22]在胃肠道间质瘤(GIST)中发现,在缺氧条件下HIF-1α通过上调FoxM1的表达,促进GIST细胞增殖、细胞周期进程、侵袭、转移,在异种移植瘤中进一步证实了HIF-1α及HIF-1β的作用。本研究中,通过免疫组化检测胆脂瘤组织中HIF-1α的表达发现,胆脂瘤较正常耳组织HIF-1α的表达明显升高,说明胆脂瘤中的缺氧环境能够激活缺氧诱导因子HIF-1α的表达,同时将胆脂瘤在缺氧条件下培养后,增殖速度明显高于常氧培养,在缺氧条件下培养5 d、7 d后,胆脂瘤的增殖较常氧增殖更为迅速,这与真性肿瘤的研究相一致。通过Sperman相关性分析发现,胆脂瘤骨质破坏程度与HIF-1α的表达之前存在等级相关性,且呈正相关,相关性较强,即HIF-1α阳性表达程度越高,脂质瘤骨质破坏程度越高。
磷脂酰肌醇3-激酶(PI3Ks)信号通路参与细胞的增殖、凋亡及分化作用。PI3K及其下游蛋白激酶B(Akt)通路与肿瘤的发生密切相关,调节肿瘤的增殖,并且其异常激活可以诱导细胞的恶变。在胆脂瘤中,PI3K/AktT通路可以促使外耳道皮肤角质化细胞从G1期进入2期,从而促使细胞增殖,同时介导了角质化鳞状上皮的增殖与转移。缺氧条件可以激活PI3K/Akt信号通路,同时PI3K/Akt通路可影响HIF-1α的表达。刘伟等[23]在肾癌细胞中发现激活PI3K/Akt信号通路可通过提高HSP90蛋白的表达抑制HIF-1α的降解,从而使HIF-1α的表达相对增加。Huang等[24]通过THP-1细胞建立缺氧诱导的细胞损伤模型,发现缺氧可以诱导Aktlin的磷酸化,从而激活PI3K/Akt信号通路。本研究结果发现,缺氧培养后,磷酸化PI3K蛋白及Akt蛋白的2个位点308、492位点均出现了明显的升高。由于磷酸化的PI3K能够促使细胞质膜上产生PIP3,促使PDK1磷酸化Akt蛋白的s308位点从而活化Akt蛋白,同时磷酸化的Thr473蛋白也可以激活Akt蛋白[25],因此可以认为缺氧条件培养后,PI3K/Akt信号通路被激活。而在常氧条件下培养的胆脂瘤给予LY294002后,胆脂瘤细胞的增殖速度虽有所降低,但降低速度较对照组差异无统计学意义。而在缺氧条件下给予LY294002后,胆脂瘤的增殖速度较同等条件下培养明显降低,说明在缺氧条件下抑制被激活的PI3K/Akt信号通路可以明显抑制胆脂瘤的表达,而在常氧条件下,可能由于PI3K/Akt通路本身处于未激活状态或未完全激活状态,故效果不明显。在给予PI3K/Akt通路抑制剂后,可以发现磷酸化PI3K及磷酸化Akt-308、492位点被明显抑制,与此同时HIF-1α的表达也明显降低,说明当抑制PI3K/Akt信号通路对HIF-1α具有正向调节作用。
综上所述,缺氧条件可以促进胆脂瘤细胞的增殖,HIF-1α在胆脂瘤组织中呈高表达状态,同时与胆脂瘤造成的骨质破坏程度呈正相关。而在缺氧条件下被激活的PI3K/Akt信号通路在缺氧条件下可以调节胆脂瘤细胞的增殖,并且对HIF-1α具有正向调节作用。通过抑制PI3K/Akt信号通路可以减缓胆脂瘤的增殖速度,其可能机制是PI3K/Akt通路通过下调HIF-1α的表达而实现的。本研究为胆脂瘤的发生发展的分子学机制提高了理论依据,并为胆脂瘤的防治提供了新的靶点与思路。

