EphA2在鼻咽癌致病过程中的作用及治疗靶点展望*
梁政 董恺悌 周慧芳 综述 任秀宝 审校
鼻咽癌(nasopharyngeal carcinoma,NPC)好发生于中国华南地区、东南亚及部分非洲地区,全世界约80%的NPC 发生在中国,严重威胁人们的生命健康。NPC 对放疗较敏感,随着放疗技术的不断发展,早期NPC 的5年生存率已达95%[1]。病理上NPC 以低分化非角化性鳞癌和未分化癌多见,其他类型为角化性鳞状细胞癌。NPC发病与遗传因素、EB病毒感染、环境因素、饮食习惯等因素有关。但在临床实践中,由于NPC 发病部位隐匿,早期症状的非特异性导致确诊时常处于中晚期,同时伴有较高的复发率和(或)远处转移,很大程度上增加了死亡率[2]。因此早期的筛查和诊断,寻找新的治疗靶标,对提升NPC整体诊治水平具有重要意义。
促红细胞生成素产生肝细胞受体(erythropoietin-producing hepatocellular receptor,Eph)及其配体ephrin[3],是最大受体酪氨酸激酶(RTK)家族,RTK通常通过与可溶性配体结合而激活。区别于其他RTK家族,ephrin 配体和Eph 受体均结合在细胞膜上,激活信号的转导通路,一般发生在直接接触的细胞之间,双向信号转导是其独特特点[4]。Eph受体是一种膜结合型Ⅰ型糖蛋白,主要由N末端糖基化配体结合区、跨膜区和胞内具有酪氨酸激酶活性区域构成。ephrin配体通过A类糖基磷脂酰肌醇锚蛋白(GPI)锚定作用或通过跨膜蛋白和包括1个PDZ-结合基序的胞质区(B 类)与细胞膜结合,与此相对应是A 类或B类Eph 受体。Eph 受体共有16 个亚型,即EphA(1~10)和EphB(1~6)[5]。
配体受体结合产生的正向信号通常需要酪氨酸激酶结构域活化,激活的Eph受体通过招募调节Rho家族蛋白(包括RhoA、Rac 和CDC42)GTP 酶激活状态,针对细胞骨架改变、细胞黏附、细胞运动性能产生调控。配体受体结合还可以招募p120Ras-GAP,抑制RAS家族蛋白(H-RAS、R-RAS),从而抑制Ras-ERK通路[6]。
Eph 受体-ephrin 配体相互作用和信号转导通常导致细胞排斥、分离、细胞收缩、失去黏着斑和细胞变圆[4,7],这种排斥性细胞收缩反应在许多生理和病理过程中起到关键作用,包括胚胎发育、神经系统发育中轴突的引导和损伤后组织再生的抑制[4]。在癌细胞中,Eph受体引起的排斥反应对恶性肿瘤在不同状态下有着不同的影响。
1 EphA2的信号特点
在16 种Eph 受体中,EphA2 与肿瘤的联系最强,因此已被广泛研究[8-10]。肿瘤细胞中的EphA2 信号转导可能具有促肿瘤或抑肿瘤的作用,这取决于肿瘤微环境[11],EphA2经典信号转导涉及Eph-ephrin结合、酪氨酸自磷酸化和激酶活性。在正常组织中,EphA2 在上皮细胞中表达,膜结合的Ephrin-A 成员(A1、A2、A3、A4 和A5)在邻近细胞中表达,其结合EphA2,引发配体依赖信号[12]。EphA2配体依赖信号能有效抑制Ras/ERK的信号通路和ErbB等其他生长因子受体激活的PI3K/AKT致癌信号通路[13-14]。
EphA2也可以产生不需要配体或激酶活性(非经典信号)的另一种信号形式,并且在连接激酶结构域和SAM 结构域的片段中涉及S897 的磷酸化,表现为癌蛋白功能。EphA2S897磷酸化是由丝氨酸/苏氨酸激酶(如AKT、RSK 和PKA)引起的,并促进细胞迁移、侵袭、转移和肿瘤干细胞样特征。S897的磷酸化对促进癌细胞恶性肿瘤的EphA2非经典信号机制至关重要[15-17]。在癌症进展过程中,受体EphA2的过度表达可导致其配体无关的原癌性激活,这是由与配体Ephrin-A 的结合减少引起的。这些非经典的EphA2受体的原癌性作用可通过配体刺激逆转,触发了EphA2 内在的肿瘤抑制信号通路,包括抑制PI3K/AKT 和ERK通路[18]。EphA2其他促瘤机制包括EphA2 的配体结合区常被膜型金属蛋白酶MT1-MMP切割,促进配体非依赖的信号转导,锚定不依赖性生长和细胞迁移[19],而解整合素-金属蛋白酶ADAM12增强Ephrin-A1从EphA2切割促进肿瘤转移[20](图1)。
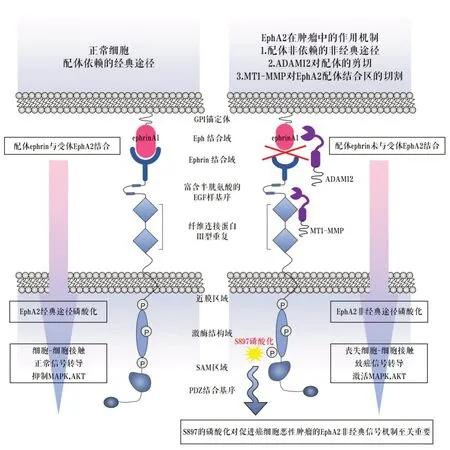
▶图1 EphA2在肿瘤中的作用
2 EPHA2表达在NPC致病过程中的作用
2.1 NPC中EPHA2信号通路与临床意义
Li等[21]发现,在高转移性NPC 细胞中,相对于非转移性NPC细胞,EphA2的S897处磷酸化显著上调,而EphrinA1 的表达水平显著降低。AKT/Stat3/介导下磷酸化S897-EphA2 与EphA2 依赖性NPC 细胞生长、侵袭、转移和干性呈正相关,与患者总生存率呈负相关。EphA2的S897磷酸化位点可作为NPC的一个有前景的治疗靶点。该研究同时报道了ANXA1与Cbl 竞争结合EphA2,通过抑制Cbl 介导的EphA2 泛素化降解,提高EphA2 稳定性,从而促进NPC 的体内、外生长和转移。有研究[22-23]发现,NPC 组织中EphA2表达增多,EphA2的表达与临床分期及淋巴结转移显著相关。上调EphA2表达可提高NPC5-8F细胞的存活率。EphA2 的过度表达通过调节PI3K/Akt信号通路介导的细胞周期进程而非凋亡过程,其过度表达降低了NPC 细胞对紫杉醇的敏感性。EphA2降表达可提高对紫杉醇化疗药物的敏感性。EphA2还可以通过介导P-gp 蛋白表达,进而调控NPC 细胞紫杉醇耐药性,P13K/AKT 通路可能参与这一过程,因此EphA2有望成为NPC紫杉醇化疗增敏靶点[24]。
2.2 EPHA2是NPC EB病毒感染的关键分子
非角化性NPC 是我国NPC 的主要类型,EB 病毒(epstein-barr virus,EBV)感染是非角化性NPC 最主要的致病因素,几乎所有的非角化性NPC 患者均存在EBV感染。EBV的感染增加了发生恶性肿瘤的危险,EBV 相关性肿瘤主要包括伯基特淋巴瘤、霍奇金淋巴瘤、弥漫大B 淋巴瘤、NK/T 细胞淋巴瘤、胃癌、NPC等。
EBV主要感染B淋巴细胞和上皮细胞[25],EBV进入靶细胞是EBV 致病的重要步骤,需要病毒糖蛋白和细胞受体介导的病毒膜和宿主细胞膜融合。病毒糖蛋白包括gp350、gHgL、gB 和gp422,虽然B 细胞和上皮细胞的感染机制不同,gHgL 和gB 是B 细胞和上皮细胞感染共同所必需的蛋白。
EBV 感染B 细胞需要其糖蛋白gp350 或剪接突变体gp220 与细胞表面受体CD21 之间的相互作用,以及病毒糖蛋白gp42 与MHCⅡ的相互作用[26-27],活化gp42 能够将信号转导至gH/gL 和gB,以防止其与包括整合素受体在内的其他细胞受体相互作用。因此,gp42 被认为是EBV 特异性感染B 细胞所必需的[28-30]。与B 细胞不同,EBV 进入上皮细胞与gp350/gp220和gp42无关,而上皮细胞的EBV感染也需要糖蛋白gH/gL 和gB[31-34]。Chesnokova 等[35-36]研究表明,糖蛋白gH/gL 与3 种上皮整合素受体(αvβ5、αvβ6 和αvβ8)的相互作用与EBV 进入上皮细胞有关。近年有研究报道,EphA2 受体也可以作为介导EBV 感染进入受体,Chen等[38]研究发现,EphA2与EBV编码的gH/gL 相互作用,促进EBV 融合和内吞,此外发现整合素受体αvβ5、αvβ6 和αvβ8 对EBV 进入上皮细胞无影响,这与Chesnokova等[36-37]发现不一致。
Zhang 等[38]通过整合微阵列和RNA 干扰筛选分析发现,EphA2 对EBV 进入上皮细胞有重要作用。EphA2敲除可显著降低EBV上皮细胞感染,EphA2过表达增加上皮细胞EBV 感染。在易受EBV 感染的B细胞淋巴瘤细胞系(Akata、Akata-EBV 和Raji)中未检测到EphA2 的表达,表明EphA2 对上皮细胞的EBV 感染是必需的,但对B 细胞感染则非必需。EphA2 的配体结合区和纤维黏连蛋白Ⅲ型重复区是EphA2介导的EBV感染的必需区域。
上皮细胞感染EBV 需要EphA2,但EBV 编码蛋白同样调节EphA2 的表达。Xiang 等[39]研究发现,EBV 阳性NPC 细胞中EphA2 的表达水平明显高于EBV 阴性NPC 细胞,PI3K/AKT 信号通路在NPC 的异种移植和临床标本中均被显著激活。Miao等[40]报道EphA2 和AKT 之间的相互调节环,非经典途径的EphA2 是AKT 的底物,提示EBV 可能通过AKT 信号途径调节EphA2的表达。
3 EPHA2的靶向治疗展望
EphA2 在NPC 中过表达以及其在正常组织中有限的功能提示可以作为开发新的抗肿瘤药物的候选靶标,并为开发新的阻断EBV 感染策略提供新的选择。针对EphA2 的各种治疗策略正在开发中,包括小分子拮抗剂、ANXA1 衍生肽、ephrinA1 多肽类似物、单克隆抗体、免疫治疗、RNAi介导的EphA2抑制、免疫偶联物,为治疗肿瘤提供了宝贵的机会。
Zhang等[38]在体外实验中应用可溶性EphA2蛋白、抗EphA2抗体、可溶性EphA2配体ephrin A1或Eph A2抑制剂2,5-二甲基吡咯苯甲酸衍生物有效阻断EBV上皮细胞感染。另一种小分子酪氨酸激酶抑制剂达沙替尼具有对EphA2的有效抑制活性。达沙替尼是一种口服活性抑制剂,其作用靶向多种激酶,包括BCR-ABL和Src家族激酶[41]。一项进行中的研究发现,基于ANXA1与EphA2结合的N端氨基酸20~30区,应用一种ANXA1衍生肽A1,其能切断ANXA1与EphA2的连接,成功下调EphA2,并在体内外抑制NPC的致癌性。EphA2高表达的胶质母细胞瘤U-251MG细胞用EphrinA1 cDNA转染,结果显示显著降低EphA2水平,显著抑制细胞增殖和迁移[42]。Koolpe等[43]尝试利用EphrinAl多肽类似物封闭EphA2治疗肿瘤。EphA2激动剂单克隆抗体可以降低卵巢癌HeyA8细胞的EphA2水平,在体内研究中EphA2激动剂单克隆抗体或与剂紫杉醇联合使用,显著抑制了鼠肿瘤的生长[44]。EphA2表位在肿瘤细胞和正常细胞中的差异表达为肿瘤免疫治疗提供了靶点[45]。EphA2肽段在多种肿瘤中被呈递,能够诱导肿瘤特异性CD8+T细胞反应[46],因此以EphA2为靶点的免疫治疗研究逐步开展。为了抑制EphA2的过度表达,RNA干扰(RNAi)方法特异性沉默EphA2基因表达的序列已经得到应用,在胰腺癌来源的MIA-PaCa2细胞中,RNAi抑制EphA2表达,同时抑制裸鼠异种移植模型中的肿瘤生长[47]。
由于其在肿瘤细胞中的表达模式,EphA2受体被认为是一个很有前途的肿瘤归巢靶向传递策略,123B9靶向EphA2酪氨酸激酶受体配体结合区。在胰腺癌和黑色素瘤模型中,123B9与紫杉醇结合,比未结合药物更有效[48]。EphA2靶向免疫偶联物将选择性地诱导癌细胞的细胞毒性,同时保留正常细胞,EphA2单克隆抗体1C1偶联到高效微管抑制剂MMAF(monomethyl auristin phenylalanine),在EphA2阳性卵巢癌HeyA8细胞和原位卵巢癌模型中显示出疗效[49]。BT5528为双环肽结合到MMAE(maleimidocaproyl-monomethyl auristatin E)显示出更强的药代动力学和更小的毒副作用[50]。
随着针对EphA2 的各种途径靶向治疗研究不断取得进展,EphA2有望成为开发新型NPC靶向治疗方法的一个有前途的策略(图2),为NPC患者的治疗提供了宝贵的机会。
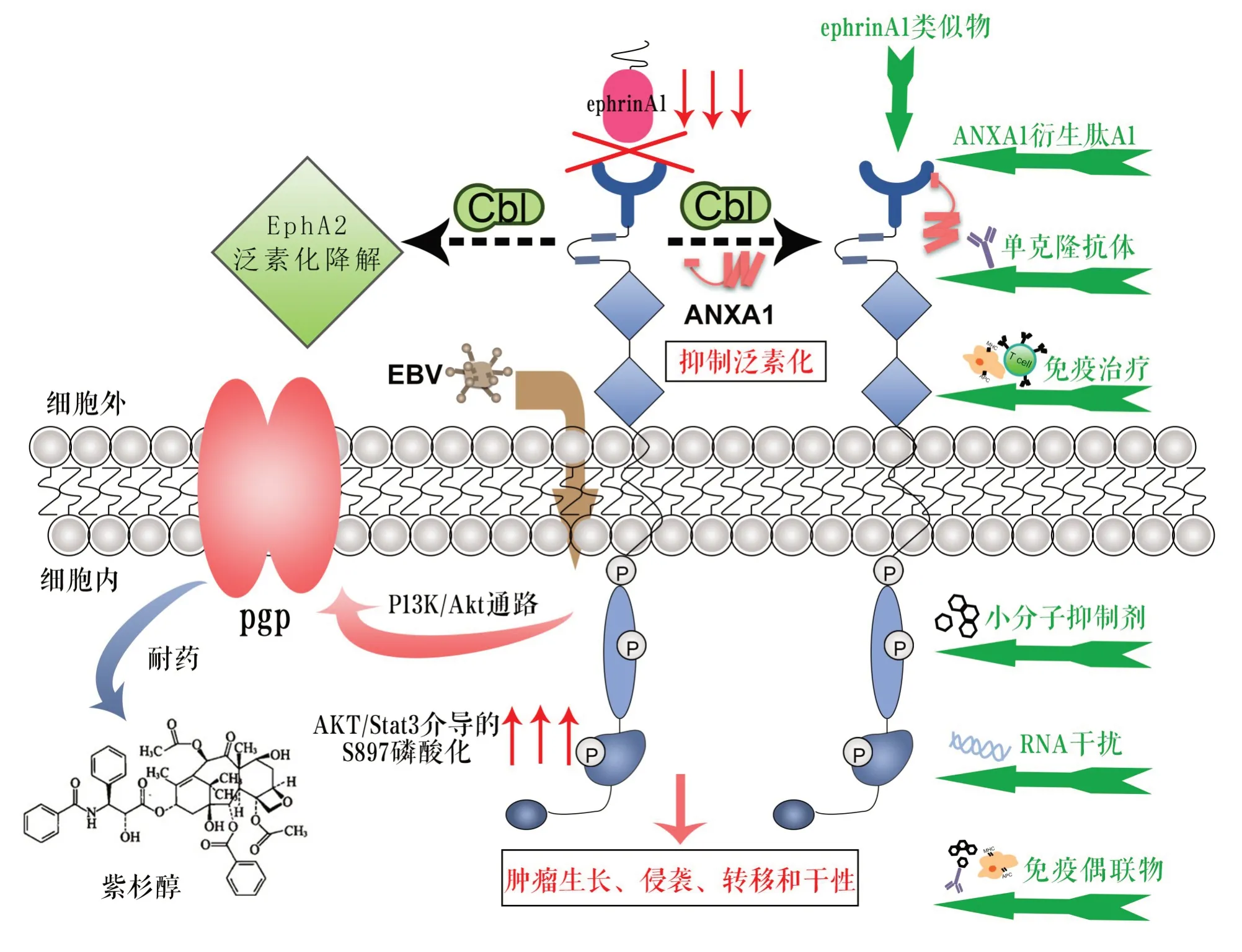
图2 EphA2在NPC致病过程中的作用及治疗靶点
4 结语
EPHA2在NPC中致病过程和EBV感染中的作用是明确的,EphA2受体及其ephrin配体之间的相互关系复杂。关于EphA2和ephrin配体在其他生长因子受体及其肿瘤微环境中的功能需要进一步阐明,因此探明EphA2在NPC发生和发展中的分子机制将为今后NPC诊断和靶向治疗提供新的线索,为合理设计针对Eph-ephrin系统的靶向治疗策略提供理论依据。

