骨髓增殖性肿瘤急变期的治疗进展*
何志鹏 吴勇 李菲
BCR-ABL1阴性骨髓增殖性肿瘤(myeloproliferative neoplasm,MPN)是一类克隆性造血干细胞疾病,包括原发性血小板增多症(essential thrombocythemia,ET)、真性红细胞增多症(polycythemia vera,PV)以及原发性骨髓纤维化(primary myelofibrosis,PMF)[1]。在疾病进程中,MPN 均存在向MPN 急变期(MPN blast phase,MPN-BP)进展的可能,是严重威胁患者生存的主要危险因素之一。MPN继发性急性白血病即为临床上定义的外周血或骨髓中幼稚细胞≥20%,也称MPN-BP。MPN发生急变的风险取决于MPN亚型,以PMF发生率最高,其10年发生率为20%;而PV及ET 10年发生率分别为4%和1%~3%。PMF和PV或ET 纤维化期之间的白血病转化率似乎无差异[2]。MPN-BP患者预后差,中位生存期(median overall survival,mOS)为2.6~7.0 个月[3]。驱 动 基 因(JAK2,CALR 及MPL)突变缺失PMF 患者,及非驱动基因突变(ASXL1、TET2、SRSF2、RUNX1、SETBP1 及TP53)均增加白血病转变风险[4-5]。此外,染色体异常(包括+1q,5,7,17p)也可显著增加转变为MPN-BP 的风险[4,6]。尽管MPN-BP 同急性白血病意义相近,但两者在分子学及临床方面显著不同[7]。当前,MPN-BP尚无标准的治疗方案。因此,本文将就MPN-BP的治疗进展进行综述。
1 对症支持治疗
支持治疗包括抗生素治疗,红细胞和(或)血小板输注,以及口服羟基脲的治疗。但是,这些治疗均未能改善患者的生存,单纯支持治疗的mOS仅为6~8 周[8-11]。支持治疗尚无法改善MPN-BP 患者的结果。
2 诱导化疗
诱导化疗曾被认为是MPN-BP 患者很有前景的治疗手段。部分患者经诱导化疗达到完全缓解(complete remission,CR),有些达到完全缓解伴不完全血液学恢复(CR with incomplete count recovery,CRi),有些达到MPN慢性期。但MPN-BP患者接受传统的抗白血病强化疗的结局普遍不佳,其mOS 为3.9~19.2个月以上[9-13]。
一项关于91例MF 继发急性髓系白血病(acute myeloid leukemia,AML)患者的回顾性分析中,24例患者接受AML相似的诱导化疗(包括阿糖胞苷+蒽环类药物,大剂量阿糖胞苷,米托蒽醌+依托泊苷),41%患者恢复到骨髓纤维化慢性期。但是维持时间很短暂,其mOS 为3.9 个月,这与接受低强度化疗的患者相似。诱导化疗患者治疗相关死亡率为33%[9]。
Tefferi等[11]回顾性分析梅奥诊所248例MPN-BP患者的治疗情况,69例患者接受AML样的诱导化疗,包括基于伊达比星/阿糖胞苷的“3+7”方案,基于柔红霉素/阿糖胞苷的“3+7”方案和“阿糖胞苷+米托蒽醌+依托泊苷”等。强化疗患者的CR 和CRi 率分别为35%和24%,而其他低强度化疗患者CR 率不足5%。化疗获得CR/CRi 但未移植的患者(n=24)的1、3 和5年生存率分别为37%、19%和13%。
目前,MPN-BP 患者接受AML 相似的诱导化疗反应率较低,化疗不良反应强,致死率高,长期预后仍较差。其疗效及生存期尤其不如原发性AML[14-15]。老龄及因合并症导致严重的器官功能障碍可部分解释MPN-BP患者预后差的原因。
3 去甲基化治疗
鉴于多数MPN-BP患者为老龄且合并症较多,通常需考虑低强度化疗。表观遗传学调控被认为在髓系肿瘤的疾病进展中发挥重大作用[16],MPN-BP患者的去甲基化治疗是基于观察到其p15/p16 基因启动子位点超甲基化,但不存在于MPN 慢性期[17]。当前有效的去甲基化药物包括地西他滨和阿扎胞苷,均已被美国食品药品监督管理局(FDA)批准用于MPN-BP 的治疗。上述两种药物均可结合到DNA中,阿扎胞苷还可结合RNA。然后,其与DNA甲基转移酶结合形成共价复合物,将其捕获和降解,导致DNA去甲基化。研究发现,在很高剂量下,这些药物的细胞毒性作用占主导;但是较低剂量下,其可导致去甲基化,从而达到表观调控[18-19]。
阿扎胞苷治疗MPN-BP 患者的mOS 为7.9~9.9个月,CR/CRi 率为15.4%~26.3%[10,20-21]。一项包括54例MPN 进展期患者接受阿扎胞苷(中位疗程为6个月)治疗的研究中,26例MPN-BP 患者中4例(15.4%)获得CR 或CRi,mOS 为8 个月。治疗过程中有6例发生致命性感染或出血[21]。Andriani等[20]回顾性分析19例MPN-BP 患者对阿扎胞苷的治疗反应,中位年龄为71.3岁。所有患者均接受阿扎胞苷标准治疗剂量为75 mg/m2。有2例患者分别死于肺部真菌感染和呼吸衰竭,疾病进展4例,疾病稳定4例,血液学改善3例,部分缓解1例,CR为5例(26.3%)。其mOS 为9.9 个月,明显优于支持治疗为主的患者(3.1个月)。最近,该学者将MPN加速期(MPN-accelerated phase,MPN-AP)一同纳入分析,扩大研究样本数为39例(MPN-BP 为23例,MPN-AP 为16例),MPNAP 患者的mOS 有优于MPN-BP 患者的趋势(18.7 个月vs.9.3个月)[22]。
地西他滨治疗MPN-BP患者的mOS为6.7~20.0个月,CR/CRi率为23.8%~50.0%[23-25]。Badar等[24]报道了21例MPN-BP患者接受地西他滨治疗的回顾性数据,6例(29%)患者对地西他滨有反应(3例CR、2例CRi和1例部分缓解),2例患者为诱导化疗失败后接受地西他滨治疗获得CR。发生反应患者的中位治疗周期为2 个月,治疗反应中位持续时间为7 个月。在无治疗反应患者中,10例(48%)患者死于疾病进展,3例(14%)死于败血症。有应答者mOS显著更长(10.5个月vs.4.0个月),所有患者mOS为6.9个月,这同该研究早期报道的35例患者接受强化疗的mOS(7.6 个月)无显著性差异。Zhou 等[4]研究显示,16例MPN-BP 患者中接受2 个疗程以上地西他滨治疗的mOS为6.7个月,优于所有患者mOS(2.6个月)。地西他滨也有助于改善脾肿大及输血依赖。
MPN-BP 患者去甲基化治疗疗效并不弱于强化疗,不良反应更轻。对于不适合异基因造血干细胞移植的患者,可考虑使用去甲基化药物。此外,去甲基化治疗控制疾病有利于等待移植供者,也可作为移植前强化疗的替代治疗。
4 JAK抑制剂
JAK2 V617F 功能获得性突变的发现以及JAK2抑制剂在经典型MPN的临床试验表明,JAK2抑制剂降低了MPN 向白血病转变的发生率[26]。尽管JAK2等位基因频率可能与白血病转变无直接关系,但可能与疾病恶化相关[2]。芦可替尼是一种强效选择性和竞争性JAK1/2 激酶抑制剂,已在国内上市用于治疗MPN 患者,也被探索性用于多项临床试验治疗MPN-BP。
在一项针对38例复发难治性急性髓系白血病患者的Ⅱ期临床试验中,芦可替尼的剂量为25~50 mg,每日2次,每2个周期后评估疗效。在18例MPN-BP中,3例患者达到CR/CRi。芦可替尼耐受性相对较好,其中4例患者出现3 级或3 级以上的药物相关不良反应,1例在严重的血小板减少期死于颅内出血[27]。该研究发现,治疗反应与JAK2 V617F 突变之间无相关性,故认为存在另一条通路与异常细胞增殖相关。
基于前期在MPN-BP的JAK2V617F+/P53-小鼠模型实验中证实,芦可替尼联合地西他滨存在协同的抗克隆活性。近期,有两项临床试验分别报道了芦可替尼联合地西他滨治疗MPN-BP的疗效。Rampal等[28]对21例MPN进展期(MPN-AP/BP)患者进行芦可替尼(10~50 mg、每日2次)联合地西他滨(20 mg/m2、连用5天)治疗的Ⅰ期临床试验报道,中位年龄63岁,中位治疗周期为3 个周期,MPN-BP 患者总反应率(CR/CRi/PR)为38.5%。MPN-AP及MPN-BP患者mOS分别为16.0及7.2个月,常见死因为脓毒症、肺炎、疾病复发或进展。Bose等[29]公布了芦可替尼联合地西他滨治疗MPN-BP患者的Ⅰ/Ⅱ期临床试验研究,纳入29例MPN-BP患者,中位年龄69岁,中位治疗周期为2个周期,总反应率为45%,CR/CRi率为41%。29例患者mOS为6.9个月,其中,应答者和非应答者的mOS分别为9.4个月和6.2个月。主要不良反应为乏力、皮疹、腹泻、恶心及眩晕,均为1级或2级不良反应。
芦可替尼联合地西他滨治疗MPN-BP 安全性可靠,可耐受,疗效优于单药治疗。该方案对于疾病结局改善有待提高,可作为其他新药或靶向药的基础治疗。芦可替尼联合化疗也在进一步探索中。
5 造血干细胞移植
异基因造血干细胞移植(allogeneic stem cell transplant,Allo-SCT)一直被认为可为MPN-BP 患者提供治愈可能的机会。一项来自欧洲工作组关于Allo-SCT 治疗继发性AML 的报道显示,中位随访时间为46.5个月,422例MPN-BP患者3年OS和无复发生存率分别为32%和25%,与骨髓增生异常综合征继发性AML相比,MPN-BP为显著的不良预后因素[30]。
在欧洲血液和骨髓移植工作组注册的1 048例骨髓纤维化患者的研究,有46例因转为MPN-BP 接受了Allo-SCT。该研究3年无进展生存率及OS分别为26%和33%,CR与非CR患者的生存期具有显著性差异(69%vs.22%,P=0.008),Allo-SCT后3年复发率为47%(31%~63%),移植前有无CR 患者之间的复发率相当,所有患者1年治疗相关死亡的累积发生率为28%(14%~42%),非CR 患者的发生率更高(35%vs.0)[31]。MPN-BP 同原发性急性白血病的发生机制不同,关于MPN-BP的治疗也在探索中(表1)。
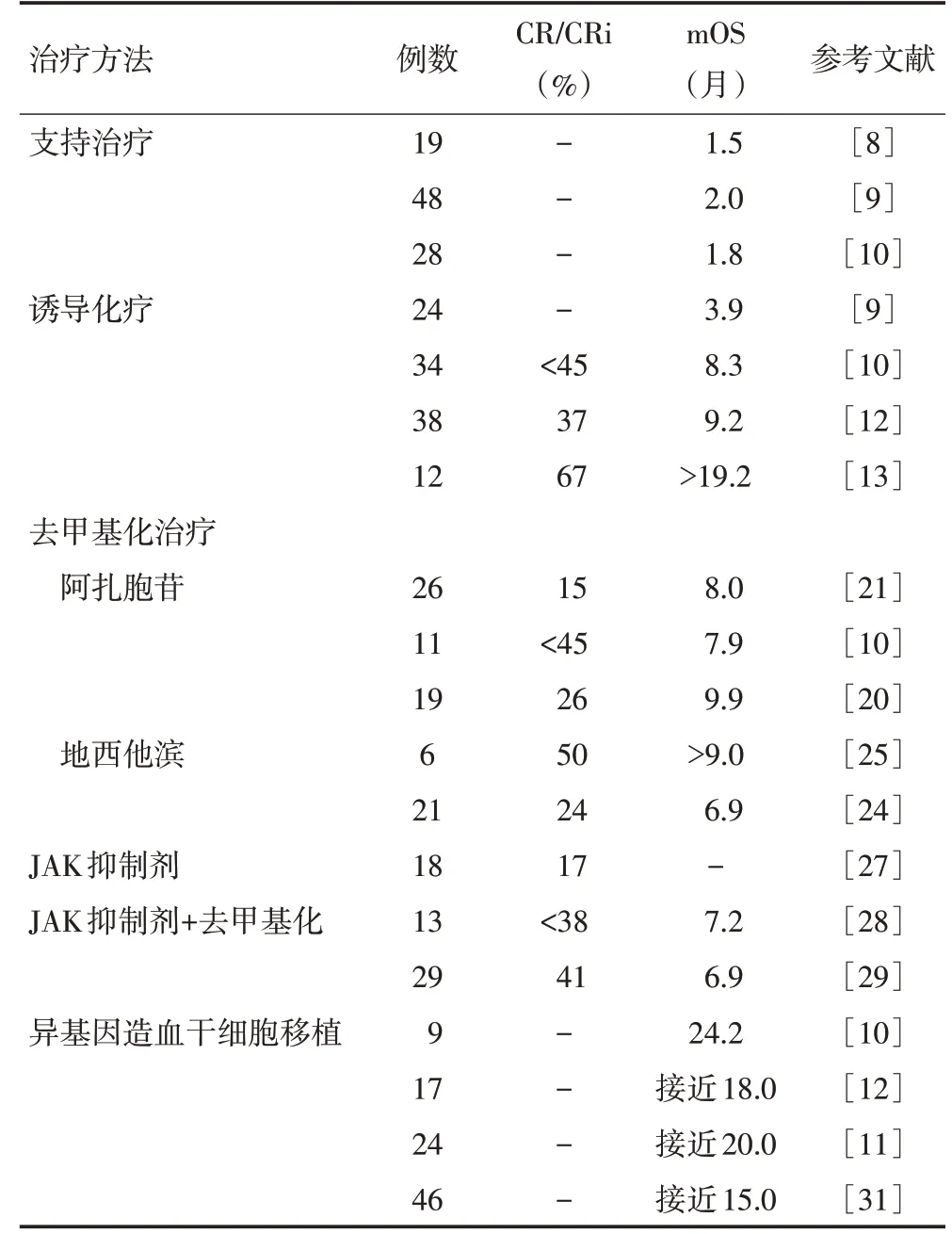
表1 MPN-BP的治疗结果
来自梅奥诊所248例MPN-BP患者数据显示,24例(CR/CRi 者16例)接受了Allo-SCT,化疗获得CR/CRi,但未移植的患者(n=24)1、3和5年生存率分别为37%、19%和13%;而Allo-SCT患者1、3和5年生存率分别为66%、32%和10%[11]。该研究多因素分析发现,Allo-SCT 是影响MPN-BP 患者的生存期独立影响因素。
由于存在多种因素影响患者的治疗反应,依据上述研究难以准确预测Allo-SCT 的疗效。其中,大多数研究受到研究对象例数少的限制。尽管如此,MPN-BP 患者中仍有1/3 有可能通过Allo-SCT 得到治愈。即使诱导化疗后表现为难治性或进行性进展的患者中,甚至有25%可以实现长期缓解。Allo-SCT前获得CR 的患者预后较好,3年无进展生存率可达55%[2]。因此,Allo-SCT 为MPN-BP 患者具有最大治愈潜能和缓解可能的治疗选择,尤其是桥接化疗获得缓解后。Allo-SCT 后复发及相关并发症导致的死亡仍是未来改进的目标。
6 探索性治疗
目前,正在研究的药物层出不穷。其中,组蛋白去乙酰基酶抑制剂包括panobinostat 在MPN 患者小样本的研究显示出初步的临床改善和良好的安全性[32]。CPX-351 为阿糖胞苷和柔红霉素的脂质体制剂,于2016年被FDA 批准用于治疗相关性或继发性AML。CPX-351 较AML 标准化疗改善老龄和高危AML患者生存期有一定优势[18,33]。此外,一系列靶向药物也为患者带来希望,包括针对IDH2抑制剂(enasidenib),CD33 抑 制 剂(gemtuzumab ozogamycin),Bcl-2抑制剂(venetoclax)[34]和雷帕霉素抑制剂[35]。
7 结语
MPN转白血病的过程相对缓慢,而其一旦急变,则预后极差。MPN-BP 仍为临床上有待攻克的难题。虽然近年来不断有新药出现,Allo-SCT 仍为唯一具有潜在治愈MPN-BP 的手段。但需要进行前瞻性合作研究,以阐明移植的相对益处,并确定最有可能受益的患者。鉴于对这类疾病的分子遗传学异常的认识不断加深,可运用分子生物学信息设计MPNBP的靶向药物阻断疾病进程甚至预防急变。JAK抑制剂仍在大规模的前瞻性试验中,尤其是联合去甲基化药物或新型的抗白血病靶向药物。因此,MPNBP的治疗前景值得期待。

