TRPM8激活Calcineurin-NFATc3通路调节结肠癌细胞免疫逃逸
黄绪群 刘国军
作者单位:435000黄石 1黄石市中心医院普爱院区胸部肿瘤内科;2黄石市中心医院乳甲肿外一科
结肠癌在全球范围内的发病率和死亡率分别排在全部恶性肿瘤的第3位和第2位[1],我国发病率和死亡率则均位列第5位[2]。肿瘤细胞免疫逃逸是远处转移和复发的重要原因,但目前结肠癌免疫逃逸的机制尚未完全阐明。研究发现细胞程序性死亡配体1(programmed death ligand-1,PD-L1)是介导结肠癌细胞免疫逃逸的关键分子[3-4]。TRPM8(transient receptor potential melastatin 8)是瞬时受体电位(transient receptor potential,TRP)家族中的一员,该家族成员可介导钙离子内流,调节肿瘤细胞的生物学行为[5]。在结肠癌研究中发现下调TRPM8表达可抑制其发生和进展[6]。而钙调磷酸酶(Calcineurin)-活化的 T 细胞核因子(nuclear factor of activated T cells,NFAT)是钙离子下游的经典信号通路,转录因子NFAT的激活不仅可调节肿瘤免疫微环境,还可促进肿瘤细胞增殖和转移[7]。LIU 等[8]研究发现,NFAT 成员 NFATc3 在缺氧条件下可被激活,从而促进结肠癌血管生成和远处转移。在JASPAR数据库(http://jaspar.genereg.net)中预测PD-L1启动子区上游存在多个NFATc3的结合位点,提示转录因子NFATc3的激活可能促进PD-L1表达。结合以上研究结果和数据库预测,推测钙离子通道蛋白TRPM8可能通过促进Calcineurin-NFATc3信号通路活化,继而调节PD-L1表达,从而在结肠癌细胞的免疫逃逸中发挥重要作用。本研究通过在人结肠癌细胞系SW630中过表达和干涉TRPM8,探讨TRPM8对SW620细胞的增殖、凋亡的影响,以及是否通过免疫逃逸发挥作用。
1 材料与方法
1.1 主要材料及试剂
血液样品来源于黄石市中心医院初诊或仅接受手术治疗的结肠癌患者,年龄35~50岁,均不合并其他恶性肿瘤,患者知情同意。正常人结肠上皮细胞系CCD 841 CoN和人结肠癌细胞系SW620购自美国ATCC公司,并保存于湖北理工学院医学院。将CCD 841 CoN细胞和SW620细胞分别接种至含10% FBS的RPMI-1640培养基和含10% FBS的Leibovitz′s L15培养基,置于5% CO2、37℃条件下培养,隔天换液,细胞密度达80%时传代。
FBS、RPMI-1640 培养基和Leibovitz′s L15 培养基购自美国Gibco公司,TRIzol试剂购自德国Ambion公司,QuantiNova SYBR Green RT-PCR试剂盒购自德国QIAGEN公司,引物由上海生工生物工程公司合成,TRPM8siRNA、Control siRNA、过表达TRPM8基因质粒pcDNA3.1-TRPM8和空质粒pcDNA3.1购自上海生工生物工程公司,Lipofectamine 3000购自美国Invitrogen公司,Annexin V-APC/7-AAD凋亡试剂盒购自中国联科生物技术公司,CD8+T细胞分离试剂盒购自美国BioLegend公司,CCK-8试剂盒、BCA蛋白浓度测定试剂盒、小鼠抗β-actin和GAPDH单克隆抗体、辣根过氧化物酶耦合二抗购自中国碧云天生物技术公司,Calcineurin的特异抑制剂 FK506、Calcineurin活性测定试剂盒、兔抗 TRPM8、NFATc3、p-NFATc3(phosphor S165)、Lamin A+C、PD-L1 单克隆抗体均购自美国Abcam公司。
1.2 细胞转染与分组
将对数生长期的SW620细胞接种于6孔板中培养(2.5×105/孔),待细胞密度为 20%~30%时,采用Lipofectamine 3000转染试剂盒,分别将 2条TRPM8 siRNA、Control siRNA、pcDNA3.1-TRPM8和pcDNA3.1转染至SW620细胞。实验分组:TRPM8 siRNA-1组、TRPM8 siRNA-2组、Control siRNA 组、pcDNA3.1-TRPM8组和pcDNA3.1组。转染12 h后更换为含血清培养基继续进行细胞常规培养。
1.3 流式细胞仪分选CD8+T细胞
取10 mL结肠癌患者血液样品加入PBS和Ficoll溶液,离心,吸取白色细胞层移至新试管,加入PBS,再次重悬离心。按照CD8+T细胞分离试剂盒说明书操作,加入10 μL蛋白酶抑制剂cocktail后,用流式细胞仪分选细胞CD8+T细胞。
1.4 qRT-PCR检测TRPM8 mRNA表达
用TRIzol试剂提取各组细胞的总RNA,按逆转录试剂盒说明操作,获得cDNA,根据QuantiNova SYBR Green RT-PCR试剂盒说明书配置qRT-PCR反应体系,反应条件:95 ℃ 10 min,95 ℃ 30 s、55 ℃ 30 s、72℃30s共40个循环。以GAPDH为内参。引物序列:TRPM8正义链为 5′-AAGATGTCCTTTCGGGCAGC-3′,反义链为 5′-TCCGTGGCCTTGGAATCTTT-3′;GAPDH正义链为5′-AAAAGGGCCCTGACAACTCTT-3′,反义链为 5′-ACCCTGTTGCTGTAGCCAAA-3′。采用2-ΔΔCt方法计算TRPM8 mRNA的相对表达量。实验重复3次。
1.5 CCK-8检测细胞活力
将各组细胞接种于96孔板(约6 000/孔),分别培养 1 d、2 d、3 d 后,每孔 100 μL 培养基加入10 μL CCK-8反应液,继续培养2 h后用酶标仪测定450 nm波长处的吸光度(OD)值。将 CD8+T细胞分别与TRPM8 siRNA-2 组、Control siRNA 组、pcDNA3.1-TRPM8组和pcDNA3.1组的SW620细胞混匀,接种于96孔板共同孵育(约8 000/孔),并分别定义为TRPM8 siRNA-SW620+CD8+T组、Control siRNASW620+CD8+T组、pcDNA3.1-TRPM8-SW620+CD8+T组和pcDNA3.1-SW620+CD8+T组。共孵育24 h后,同上述步骤测定OD值。
1.6 集落形成实验检测TRPM8对细胞增殖能力的影响
将各组细胞接种于6孔板(约800/孔),在 37℃、5% CO2的细胞培养箱中培养10 d后,用多聚甲醛固定15 min,0.5%结晶紫染液20 min,用流水冲洗染色液后待培养板自然干燥,通过Image J软件对形成的细胞群落进行计数。实验重复3次。
1.7 流式细胞术检测TRPM8对细胞凋亡的影响
各组细胞分别接种于6孔板(2×105/孔),培养48 h后,收集细胞,按照Annexin V-APC/7-AAD凋亡试剂盒操作说明,每个流式管中加入350 mL Binding Buffer,重悬细胞后每管加入10 μL Annexin V-APC染液避光孵育15 min,再加入10 μL 7-AAD染液孵育10 min,上流式细胞仪检测细胞凋亡水平。实验重复3次。
1.8 细胞核蛋白和细胞浆蛋白分离
将对数生长期的SW620细胞接种于细胞培养瓶,常规培养 24 h 后更换含 FK506(2 μmol/L)的培养基培养24 h,收集细胞,离心,在细胞沉淀中加入细胞浆蛋白抽提试剂A,冰浴15 min后加入细胞浆蛋白抽提试剂B,冰浴1 min后,离心,吸取上清液,即细胞浆蛋白;在沉淀物中加入细胞核蛋白抽提试剂,冰浴30 min后,离心,获得的上清即为细胞核蛋白。采用Western blot法检测细胞浆和细胞核中PD-L1和NFATc3的表达,以Lamin A+C作为细胞核蛋白内参,β-actin作为细胞浆蛋白内参。
1.9 酶标仪检测细胞中的Calcineurin活性
各组细胞分别接种于96孔板中培养48 h;另将对数生长期的SW620细胞接种于96孔板中,培养24 h后更换为含有 FK506(2 μmol/L)的培养基,继续培养24 h。各孔依次加入 25 μL Calcineurin Assay Buffer、5 μL Calcineurin、10 μL 蒸馏水,室温放置 10 min;加入 10 μL Calcineurin Substrate,继续孵育 10 min;加入100 μL Green Assay Reagent终止反应,用酶标仪测定620 nm波长的吸光度(OD)值。Calcineurin活性(%)=(OD实际值/OD标准值)×100%。实验重复3次。
1.10 Western blot检测蛋白表达水平
收集各组细胞,分别用RIPA裂解液提取细胞中的总蛋白,用BCA试剂盒对蛋白浓度进行定量。将蛋白样品用SDS-PAGE凝胶分离后,转至PVDF膜,用5%脱脂奶粉封闭2 h,分别加入一抗(稀释比例为1∶2 000),4 ℃过夜孵育;TBST 洗膜后,加入相应辣根过氧化物酶耦合的二抗(稀释比例为1∶5 000),室温孵育2 h,用ChemDocTM XRS+System仪器检测目的条带。实验重复3次。
1.11 统计学方法
采用GraphPad Prism 6软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,若组间差异有统计学意义,进一步的两两比较采用Bonferroni检验;两组间均数比较采用独立样本t检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 TRPM8在结肠癌SW620细胞中表达上调
qRT-PCR和Western blot检测结果显示,SW620细胞中TRPM8 mRNA和蛋白表达均高于CCD 841 CoN细胞,差异有统计学意义(P<0.01),见图1。
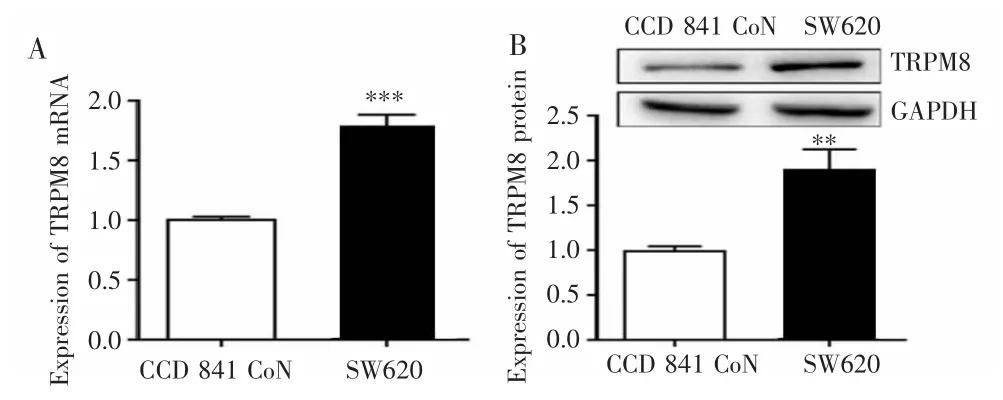
图1 TRPM8在结肠癌SW620细胞中表达上调Fig.1 TRPM8 was overexpressed in colon cancer SW620 cells
2.2 TRPM8促进结肠癌SW630细胞增殖
转染后,TRPM8 siRNA-1组、TRPM8 siRNA-2组和Control siRNA组的TRPM8蛋白表达量比较差异有统计学意义(F=243.90,P<0.001),其中TRPM8 siRNA-1组、TRPM8 siRNA-2组均低于 Control siRNA 组(P<0.001),且TRPM8 siRNA-2组低于TRPM8 siRNA-1组(P<0.05);而pcDNA3.1-TRPM8组TRPM8蛋白表达量高于pcDNA3.1组(P<0.001),见图2A。3组不同时间点的细胞活力及细胞增殖能力的差异均有统计学意义(F=30.17,P<0.001;F=36.93,P<0.001),且 TRPM8 siRNA-1组、TRPM8 siRNA-2组均低于Control siRNA组(P<0.05),见图 2B~C;而 pcDNA3.1-TRPM8 组细胞活力和细胞增殖能力均高于pcDNA3.1组(P<0.05),见图2D~E。3组间细胞凋亡率比较差异亦有统计学意义(F=36.93,P<0.001),其中 TRPM8 siRNA-1 组、TRPM8siRNA-2组均高于Control siRNA组(P<0.001);但pcDNA3.1-TRPM8组与pcDNA3.1组比较无明显差异(P<0.05),见图 2F。
2.3 TRPM8调节CD8+T细胞对结肠癌SW620细胞的杀伤能力
转染后,TRPM8 siRNA-1组、TRPM8 siRNA-2组和Control siRNA组的PD-L1蛋白表达量比较差异有统计学意义(F=192.10,P<0.001),其中 TRPM8 siRNA-1组、TRPM8 siRNA-2组均低于Control siRNA组(P<0.001),且 TRPM8 siRNA-2组低于 TRPM8 siRNA-1组(P<0.05);而 pcDNA3.1-TRPM8组细胞中 PD-L1蛋白表达量高于pcDNA3.1组(P=0.002),见图3A。
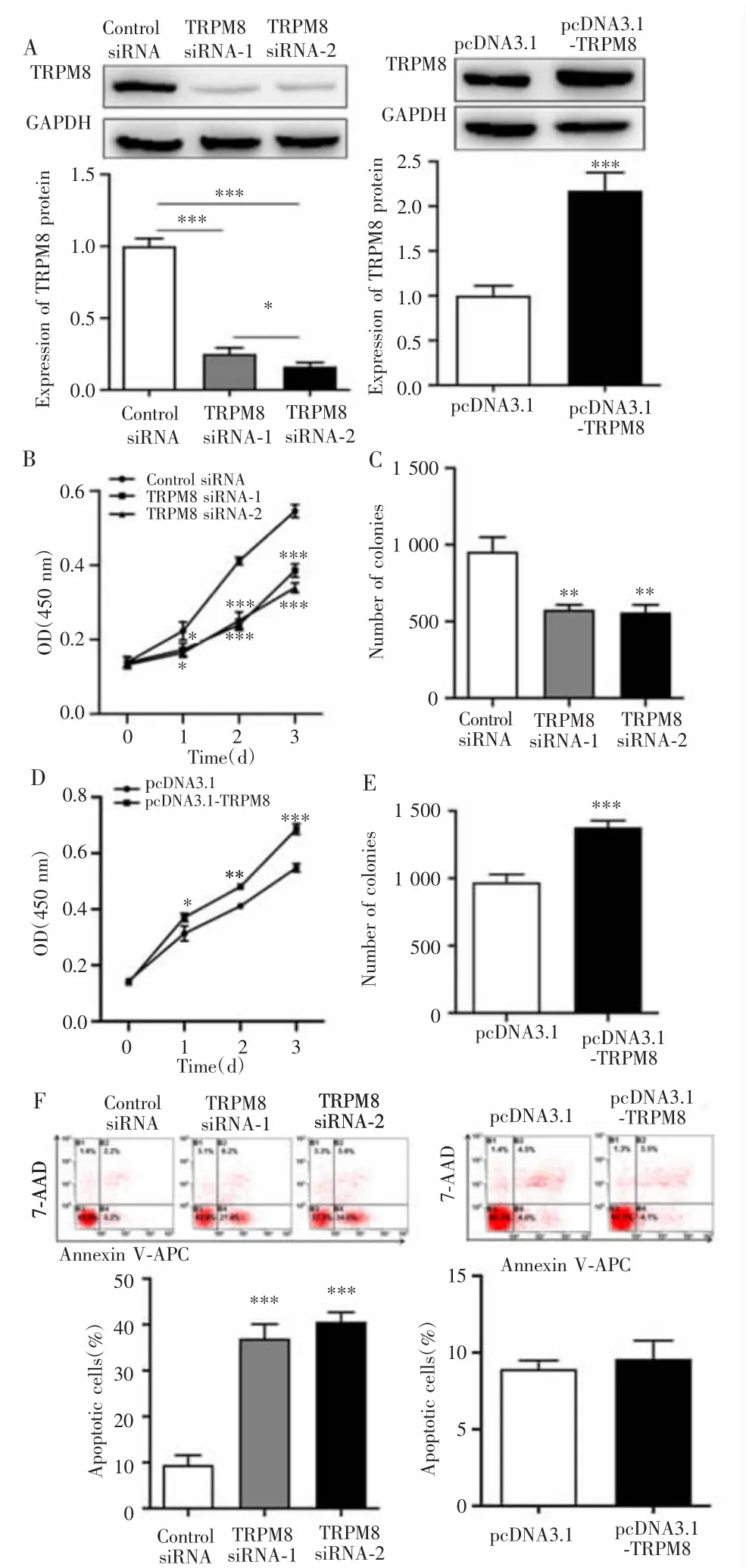
图2 TRPM8促进结肠癌SW620细胞增殖Fig.2 TRPM8 promoted the proliferation of colon cancer SW620 cells
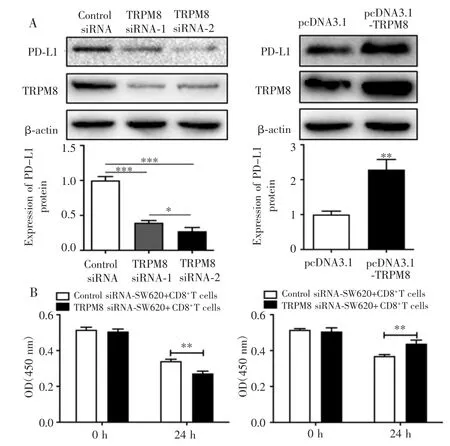
图3 TRPM8调节CD8+T细胞对结肠癌SW620细胞的杀伤能力Fig.3 TRPM8 regulated the killing ability of CD8+T cells against colon cancer SW620 cells
共孵育24 h后,CCK-8实验结果显示,TRPM8 siRNA-SW620+CD8+T组细胞活力较Control siRNASW620+CD8+T组低(P=0.002);而pcDNA3.1-TRPM8-SW620+CD8+T组细胞活力高于pcDNA3.1-SW620+CD8+T组(P=0.005)。见图3B。
2.4 TRPM8激活Calcineurin-NFATc3信号通路促进PD-L1表达
转染后,TRPM8 siRNA-1组、TRPM8 siRNA-2组和Control siRNA组Calcineurin活性比较差异有统计学意义(F=193.90,P<0.001),且前两组均较 Control siRNA组低(P<0.001);而pcDNA3.1-TRPM8组Calcineurin活性高于 pcDNA3.1组(P<0.001),见图 4A。3组的NFATc3和p-NFATc3蛋白表达量比较差异有统计学意义(F=18.92,P=0.003;F=31.45,P<0.001),其中TRPM8 siRNA-1组和TRPM8 siRNA-2组的NFATc3蛋白表达量均低于Control siRNA组(P=0.003,P=0.005),p-NFATc3蛋白表达量则均高于Control siRNA组(P=0.003,P=0.002);而与pcDNA3.1组相比,pcDNA3.1-TRPM8组NFATc3蛋白表达量升高(P<0.001),p-NFATc3蛋白表达量降低(P=0.002),见图4B。Calcineurin特异抑制剂FK506处理SW620细胞24 h后,Calcineurin活性降低(P<0.001),且FK506处理后细胞浆内的PD-L1和细胞核内NFATc3的蛋白表达亦降低(P=0.002;P<0.001),见图 4C~4D。
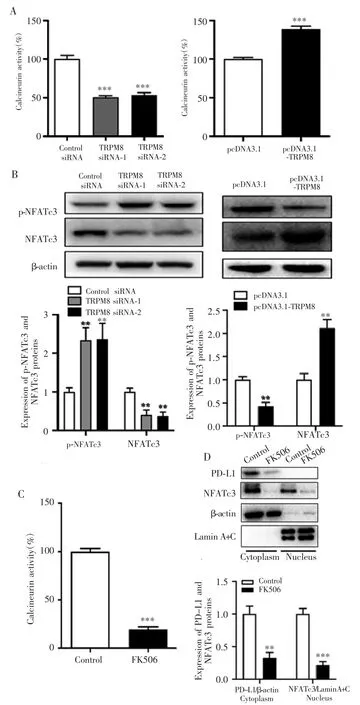
图4 TRPM8激活Calcineurin-NFATc3信号通路促进PD-L1表达Fig.4 TRPM8 promoted PD-L1 expression by activating Calcineurin-NFATc3 signaling pathway
3 讨论
结肠癌复发和转移是造成患者死亡的重要原因,而免疫逃逸是结肠癌复发和转移的重要生物学事件[3]。因此,阐明结肠癌免疫逃逸的分子机制尤为重要。TRP家族属于非选择性阳离子通道蛋白,包含6个亚家族,主要定位于细胞膜,可以介导钙离子进入细胞内[9]。TRPM是TRP家族中的一个亚家族,主要由8个成员分子组成,在肿瘤发生发展中发挥重要作用[5]。目前研究显示TRPM8在不同肿瘤中发挥不同的作用。在乳腺癌中,TRPM8呈高表达,抑制TRPM8表达可降低肿瘤细胞活力和迁移能力[10]。同样,在口腔鳞癌上调TRPM8表达发现可促进细胞增殖能力[11]。然而,在黑色素瘤中,激动剂激活TRPM8通道诱导钙离子内流却降低肿瘤细胞活力[12]。本研究在结肠癌SW620细胞中干涉和过表达TRPM8后,发现干涉TRPM8表达可抑制细胞增殖和促进细胞凋亡,而过表达TRPM8则促进肿瘤细胞增殖,提示TRPM8在结肠癌中可能发挥促癌的作用,与上述文献[10-11]报道一致。
钙离子是细胞内重要的第二信使,可参与调节细胞的各种生理病理过程[13]。研究表明,钙离子激活Calcineurin-NFAT信号通路可促进乳腺癌[14]、神经母细胞瘤[15]、透明细胞肾癌[16]和结肠癌[17]等肿瘤增殖能力和迁移能力。NFAT包含5个成员(NFATc1、NFATc2、NFATc3、NFATc4和TonE-BP),通常以磷酸化形式(p-NFAT)存在于细胞浆中,并以磷酸化-非磷酸化形式保持动态平衡;当p-NFAT被抑制而非磷酸化NFAT增加,后者即可被激活而进入细胞核,发挥其转录作用,调节肿瘤细胞的生物学行为[7,18]。本研究结果显示,TRPM8过表达的 SW620细胞中Calcineurin活性增加,NFATc3蛋白表达量升高,且p-NFATc3蛋白表达量降低,提示TRPM8过表达可促进Calcineurin-NFATc3信号通路活化。PD-L1是介导肿瘤细胞免疫逃逸的关键分子。肿瘤细胞表达的PD-L1结合到T细胞表面PD-1可传导抑制性信号到T细胞,导致T细胞周期停滞和凋亡,以及造成细胞毒性物质产生减少,因而杀伤肿瘤细胞的作用降低[19]。有研究发现,丙酮酸脱氢酶激酶可促进卵巢癌细胞表达PD-L1,当过表达丙酮酸脱氢酶激酶的卵巢癌细胞与CD8+T细胞共培养,可抑制CD8+T细胞分泌干扰素,并促进其凋亡[20]。另有学者发现,阻断PD-L1可增加乳腺癌和肺癌组织中CD8+T细胞数量,并抑制瘤体生长[21];同时有效减少细胞集落形成[22]。本研究发现,干涉TRPM8表达的SW620细胞中PD-L1蛋白表达量降低,而TRPM8过表达时则PD-L1蛋白表达量升高。将干涉TRPM8表达的SW620细胞与CD8+T细胞共孵育,结果总细胞活力进一步降低,而TRPM8过表达的SW620细胞与CD8+T细胞共培养则可相对提高总细胞活力,表明TRPM8可能通过调节PD-L1的表达进而影响CD8+T细胞对SW620细胞的杀伤作用。此外,JASPAR数据库检索结果发现PD-L1启动子区上游存在NFATc3结合位点。本研究采用Calcineurin的特异性抑制剂FK506抑制Calcineurin后,发现NFATc3在细胞核中的表达减少,同时伴随PD-L1在细胞浆中的表达减少。由此推测,TRPM8可能通过激活Calcineurin-NFATc3信号通路促进PD-L1表达。
本研究发现,TRPM8可能通过激活Calcineurin-NFATc3信号通路进而上调PD-L1表达,介导结肠癌细胞免疫逃逸,从而促进结肠癌细胞增殖,但TRPM8在共孵育体系中对CD8+T细胞穿孔素、干扰素等产生的影响以及NFATc3对促进PD-L1转录的机制均未明确,因此TRPM8发挥促结肠癌细胞增殖和免疫逃逸的作用机制尚需进一步验证。

