Clp蛋白酶复合体亚基ClpX在肝细胞癌中的表达及意义
王大林 宋健 丛春林 杨世荣白翔宇 安家泽
作者单位:710032 西安 1空军军医大学西京医院肝胆外科;221000 徐州 2陆军第71集团军医院干部病房;710038西安 3空军军医大学唐都医院普外科;475004 开封 4河南大学药学院
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,我国每年有超过全世界50%的肝癌确诊病例[1]。但目前对HCC发病及恶性进展的机制尚不完全清楚,难以做到早期诊断、精准治疗,大多数患者确诊时已处于中晚期,外科手术为首选治疗手段,患者预后差异较大[2]。良好的预后标志物有助于评估HCC患者病情、选择合适的治疗策略,从而提高生存率。然而临床上常用的生物标志物由于受多种因素调控及HCC异质性影响,如甲胎蛋白(AFP)等敏感性和特异性均不高[3]。故仍需寻找行之有效的预后标志物[4]。线粒体是细胞的能量工厂,通过合成ATP维持细胞生命活动,还可调控细胞氧化还原状态,介导信号转导、细胞凋亡、细胞分化和细胞代谢等[5]。大量研究证实,线粒体功能异常参与多种肿瘤的发生和进展,并在其中发挥关键调控作用[6-9]。Clp蛋白酶复合体的ATP依赖性亚基(ATP-dependent Clp protease ATP-binding subunit,ClpX)是ATP酶亚单位与蛋白酶亚单位ClpP组成的Clp蛋白酶复合物,可靶向错误折叠蛋白质进行水解,广泛存在于真核生物的线粒体中[10-12]。已有研究表明ClpX异常表达可能与前列腺癌发生相关[13]。然而ClpX在HCC中的作用尚不明确,与HCC预后的关系尚无报道。本研究通过检测HCC癌组织中ClpX的表达并分析其与临床病理特征及预后的相关性,同时在细胞层面观察其对HCC细胞增殖的影响,初步探讨ClpX与HCC的关系及其临床指导意义。
1 材料与方法
1.1 组织样本来源
收集2013年1月至2014年12月于空军军医大学西京医院肝胆外科行根治性肝切除术的166例HCC患者癌组织及癌旁正常组织标本。手术标本均经病理检查确诊,术前未接受化疗或放疗,无其他恶性肿瘤病史。本研究经空军军医大学西京医院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 随访
随访方式包括门诊随访、住院病例随访以及电话随访。术后第1年每3个月随访1次,第2~5年每6个月随访1次,截止日期为2019年12月,患者死亡或失访后终止随访,随访内容主要为患者生存情况。本组患者随访时间为3~60个月,中位随访时间为27个月。总生存期(overall survival,OS)定义为自手术至死亡或者末次随访的时间。
1.3 主要材料及试剂
人肝细胞癌细胞株SNU739购自ATCC细胞库;胎牛血清购自中国BBI Life Sciences公司,RPMI1640培养基购自中国瑞博公司;青链霉素混合液购自中国索莱宝公司;携带ClpX干涉及过表达质粒的慢病毒购自中国上海吉玛基因公司;ClpX抗体(HPA040262)购自美国Sigma-Aldrich公司;β-actin抗体和兔二抗购自中国北京天德悦公司;免疫组化试剂盒、DAB显色试剂盒购自中国福州迈新试剂公司;BCA蛋白定量试剂盒购自中国碧云天公司;蛋白上样Marker购自美国Thermo Fisher公司;MTS检测试剂盒购自美国Promega公司。
1.4 免疫组化检测
石蜡切片常规烤片、脱蜡水化、酸性抗原修复(柠檬酸钠抗原修复液)、灭活内源性过氧化物酶、山羊血清室温封闭非特异性抗原位点,滴加ClpX抗体(1∶150)4℃过夜,生物素标记的二抗37℃孵育20 min,链霉亲和素标记的辣根过氧化物酶三抗28℃孵育20 min,DAB工作液显色,苏木素复染、脱水、透明、中性树胶封片。免疫组化评分标准:总分=细胞染色强度评分×细胞阳性率评分。细胞染色强度评分:无染色计0分、弱染色计1分、中染色计2分、强染色计3分;细胞阳性率评分:0~9%计 0分、10%~25%计 1分、26%~50%计2分、51%~75%计3分、76%~100%计4分。总分≤3分为低表达,>3分为高表达。
1.5 细胞培养和慢病毒转染
人肝细胞癌细胞株SNU739用含10%胎牛血清和1%青链霉素混合液的DMEM培养基于37℃、5% CO2培养箱中培养。将处于对数生长期的细胞用胰蛋白酶消化并接种于6孔板(5×104/孔)。实验分为4组:shCtrl组转染阴性干涉质粒慢病毒,shClpX组转染ClpX干涉质粒慢病毒,EV组转染空载质粒慢病毒,ClpX组转染含ClpX过表达质粒的慢病毒。待细胞贴壁且覆盖率为70%~80%时转染慢病毒:960 μL无血清DMEM培养基+40 μL感染增强液+5 μL病毒原液(病毒浓度为108/mL),转染10 h后更换为含血清培养基。转染48 h后用荧光倒置显微镜观察转染效率,采用嘌呤霉素(浓度为5 ng/mL)进行病毒转染抗性筛选。
1.6 Western blot检测ClpX的表达
转染48 h后收集细胞,用RIPA裂解液裂解细胞并提取蛋白,按照BCA法检测蛋白浓度。取40 μg蛋白上样,10%聚丙烯酰胺分离凝胶电泳,转至PVDF膜,用含5%脱脂奶粉室温封闭1 h,加入ClpX抗体(1∶1 000)4 ℃孵育过夜;1×TBST 洗膜后,加入二抗室温孵育1 h。TBST洗涤后,用ECL化学发光液显影分析,并采用Image J软件行半定量分析。以β-actin为内参蛋白,相对蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.7 MTS法检测细胞增殖能力
取对数生长期的慢病毒稳定转染细胞株,以2×103/孔的细胞密度接种至96孔板,设5个复孔及阴性对照,待细胞贴壁后加入MTS工作液(20μL/孔),于37℃、5% CO2条件下孵育1h。用酶标仪检测490 nm波长处各孔的吸光度值,并记录为起始数据(0 h),同法分别于24 h、48 h、72 h和96 h再次测定,记录数据并绘制细胞增殖曲线。
1.8 统计学方法
采用SPSS 16.0以及Graph Pad Prism 7.0软件行统计学分析,计量资料以均数±标准差(±s)表示,癌组织及癌旁正常组织中分子表达差异分析采用配对t检验,实验组和对照组比较采用独立样本t检验;生存曲线描绘采用Kaplan-Meier法,两组生存曲线比较采用Log-rank检验;单因素和多因素分析采用Cox比例风险回归模型;比较两组曲线差异采用重复测量方差分析,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 ClpX在HCC癌组织及癌旁正常组织中的表达
免疫组化检测结果显示,ClpX主要染色于细胞质,癌旁正常肝细胞胞质大部分呈中染色至强染色,HCC细胞胞质大部分呈弱染色。HCC癌组织及其癌旁正常组织中ClpX的免疫组化染色评分分别为(2.891±1.253)分和(8.275±1.836)分,差异有统计学意义(P<0.001),见图 1。
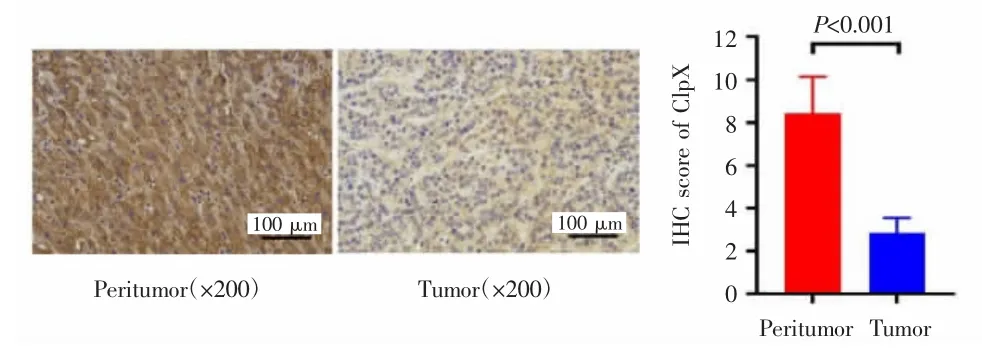
图1 ClpX在HCC癌组织及癌旁正常组织中的表达Fig.1 Expression of ClpX in HCC tissues and adjacent normal tissues
2.2 ClpX表达与HCC患者临床病理特征及生存的关系
不同年龄、性别、组织分化程度、肝功能分级、有无肝硬化、HBsAg阳性情况、AFP水平患者的ClpX表达水平比较,差异均无统计学意义(均P>0.05)。但对于TNM分期,Ⅲ+Ⅳ期患者ClpX表达较Ⅰ+Ⅱ期患者降低,差异有统计学意义(P=0.008),见表1。Kaplan-Meier生存分析显示,ClpX高表达患者和低表达患者的中位生存时间分别为41个月和28个月,且两组生存曲线差异有统计学意义(P=0.009),见图2。
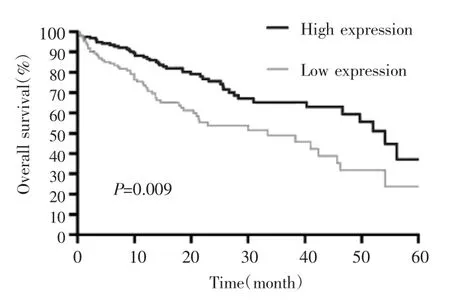
图2 ClpX表达与HCC患者生存的关系Fig.2 The relationship between the expression of ClpX and prognosis in patients with HCC
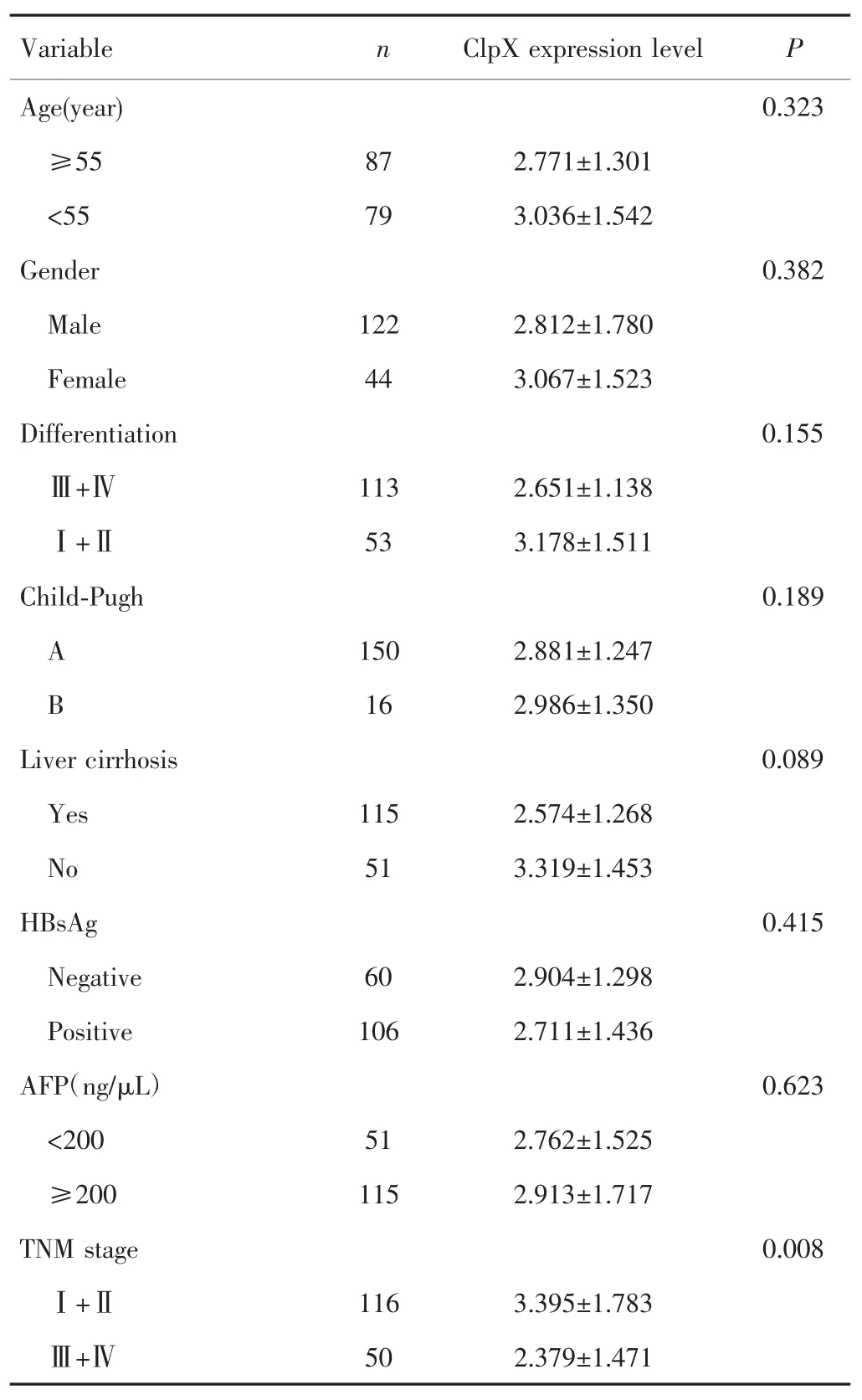
表1 ClpX表达与HCC患者临床病理特征的关系Tab.1 The relationship between the expression of ClpX and clinical features in patients with HCC
2.3 单因素和多因素分析
单因素Cox回归分析显示,年龄、分化程度、肝硬化、AFP、TNM分期和ClpX蛋白表达水平均与HCC患者总生存期相关。多因素Cox回归分析显示,ClpX低表达是影响HCC患者总生存期的独立危险因素(P=0.046)。见表 2。
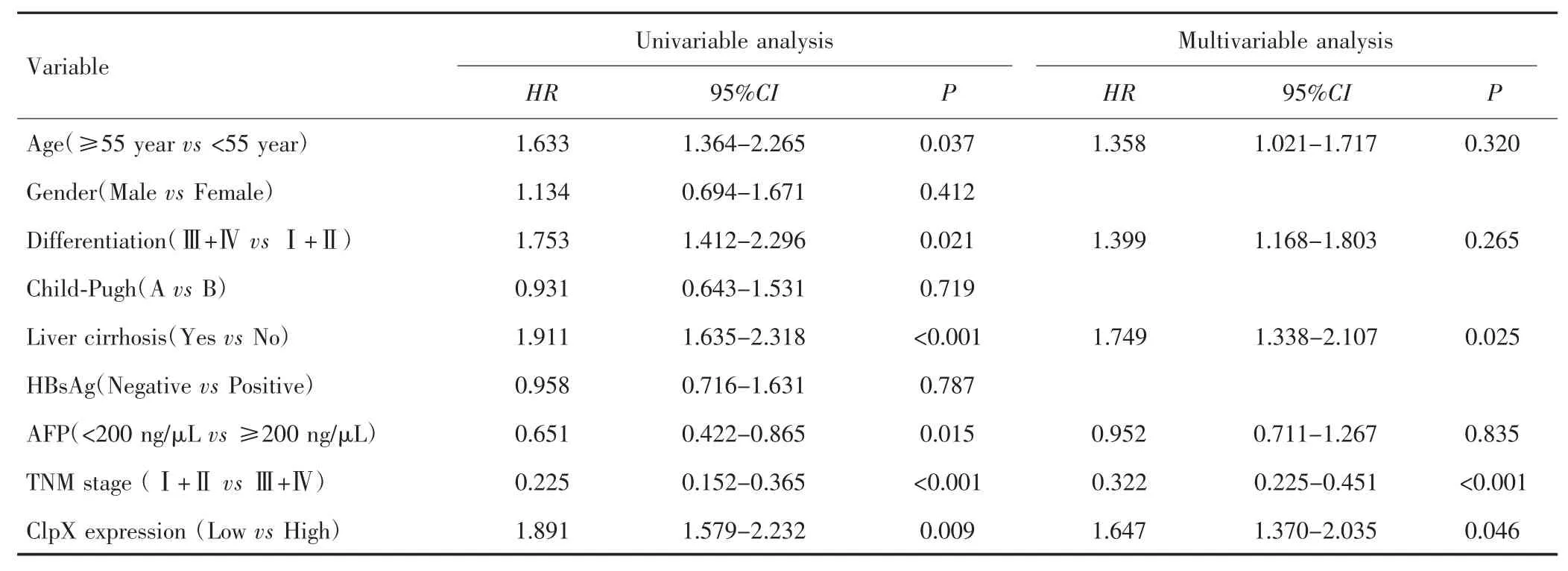
表2 影响HCC患者术后OS的单因素和多因素分析Tab.2 Univariable and multivariable analysis of postoperative OS in patients with HCC
2.4 慢病毒转染SNU739细胞后ClpX的表达水平
Western blot检测结果显示,SNU739细胞中,shClpX组的ClpX表达水平低于shCtrl组(0.552±0.083 vs 1.286±0.216,P<0.001),而 ClpX 组 ClpX 表达水平高于 EV 组(1.894±0.287 vs 1.236±0.114,P=0.009),见图3。说明ClpX干涉和过表达肝癌细胞系SNU739构建成功。
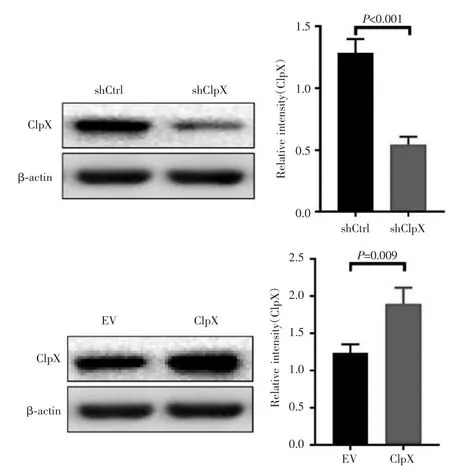
图3 Western blot检测转染慢病毒后SNU739细胞中ClpX蛋白的表达Fig.3 The expression of ClpX in SNU739 cells after lentivirus transfection detected by Western blot
2.5 干涉/过表达ClpX对SNU739细胞增殖能力的影响
MTS实验检测结果显示,SNU739细胞中,shClpX组的细胞增殖能力均较shCtrl组增强(F=130.625,P<0.001),而ClpX组细胞增殖能力均较EV组下降(F=87.931,P<0.001),见图 4。
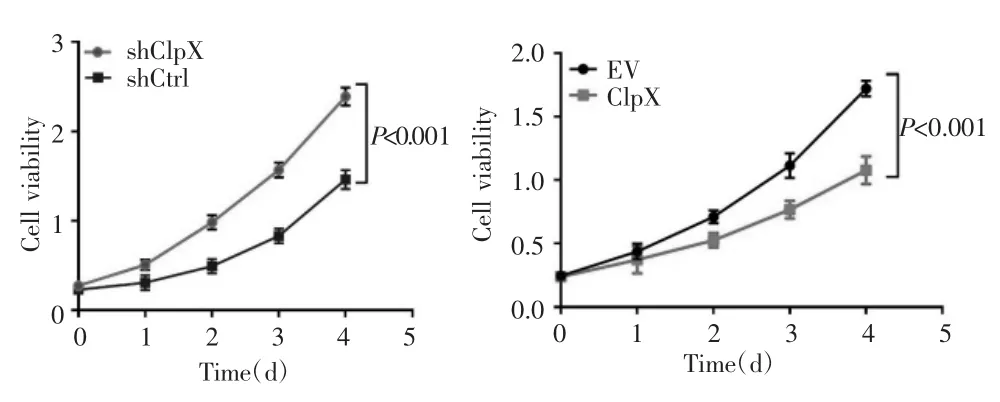
图4 MTS法检测干涉/过表达ClpX后SNU739细胞的增殖能力Fig.4 The proliferation of SNU739 cells after interference/overexpression of ClpX detected by MTS assay
3 讨论
HCC是最常见的原发性肝癌亚型,大量研究表明HCC的发生和恶性进展涉及肝脏相关的糖、脂等多种代谢途径和信号通路异常[14]。而线粒体作为细胞能量代谢枢纽,承担着物质代谢和氧化供能的重要使命,其功能异常在HCC的发生发展中扮演着不可或缺的角色。已有研究提示抑制线粒体功能可促进HCC的代谢重编程[15]。除此之外,线粒体功能异常对维持肿瘤细胞恶性进展至关重要,而维持线粒体功能需要严格控制蛋白质稳态,这就要求Clp蛋白酶复合体发挥作用,当相关分子异常表达时可能会造成线粒体蛋白质稳态被破坏,影响氧化磷酸化及氧化应激,进而影响细胞的恶性转化[16]。COLE 等[17]发现ClpP在急性髓系白血病患者细胞中过表达,同时发现与ClpP相互作用的大多数蛋白质是呼吸链和线粒体代谢酶的组分,而抑制ClpP可通过增加ROS、降低呼吸链复合体Ⅱ活性,进而损害线粒体代谢和氧化磷酸化,诱导白血病细胞死亡。本研究中ClpX作为Clp蛋白酶复合体的另一蛋白组分,在HCC细胞中低表达,提示其可能在HCC中发挥着与ClpP截然不同的作用。
尽管已有研究表明ClpX在肺、胃、肝、甲状腺、膀胱、乳腺、卵巢、前列腺等肿瘤中普遍高表达,且与患者生存期缩短有关[18]。但是目前ClpX相关研究较少,其在HCC中的作用及机制尚不清楚。本研究通过免疫组化实验首次发现ClpX在HCC癌组织中表达下调。进一步分析ClpX与患者临床病理特征的关系,发现ClpX在中晚期患者中的表达水平较早期患者显著降低,且ClpX低表达患者的预后更差。此外,Cox比例风险回归模型多因素分析发现ClpX低表达是影响患者总生存期的独立危险因素。这说明ClpX的异常表达可能与HCC的恶性进展相关。SEO等[13]在前列腺癌PC3细胞株研究中发现,干涉ClpX可抑制PC3细胞增殖,影响前列腺癌进展。为了深入探究ClpX表达水平对HCC的影响,本研究通过慢病毒转染分别在HCC细胞株SNU739干涉和过表达ClpX,结果发现干涉ClpX可显著增强SNU739细胞的增殖能力,而过表达ClpX则显著抑制其增殖能力,表明ClpX可能通过特定机制调控HCC的进展。有研究[13]报道,当ClpX异常表达时,可能影响氧化磷酸化复合体Ⅱ亚单位琥珀酸脱氢酶B(SDHB)的稳定性,进而影响细胞能量代谢,通过氧化应激促进HCC发生。此外,ClpX异常表达可间接影响线粒体DNA的分布及稳定性[19],进而导致线粒体呼吸链功能异常,增强Warburg效应,从而介导细胞的恶性进展。VERHAGEN等[20]通过体外实验发现ClpX可与E3泛素连接酶XIAP相互作用,进而影响细胞线粒体途径凋亡。另有研究[21]表明,下调线粒体ClpX的表达水平可增加癌细胞对顺铂的敏感性。因此,ClpX异常低表达可能通过多种途径影响线粒体功能进而介导HCC发生发展,但具体机制有待进一步研究。
综上所述,本研究首次发现ClpX在HCC癌组织中低表达,且低表达者预后较差,在HCC细胞株中干涉ClpX可促进细胞增殖,提示ClpX可能成为HCC潜在的预后标志物。但本研究纳入临床样本量有限,采集的临床相关指标不完整,且缺少体内实验验证以及对ClpX影响HCC的机制研究。故有待下一步扩充样本量、增设研究指标进行验证,并探究ClpX参与HCC恶性进展的可能机制。

