计算机断层扫描三维重建联合带钩钢丝定位对ⅠA期肺癌的诊疗价值研究Δ
高鹏,董志辉,倪明立,张超,杜诗霖,陆方方,雷其良,周津如
洛阳市中心医院1医学影像科CT室,2肿瘤科,3胸外科,河南 洛阳 471009
肺癌在中国恶性肿瘤中发病率和病死率均居首位,国家癌症统计中心数据显示,2015年全国新发肺癌73.33万例,61.02万例死于肺癌[1]。虽然肺癌总体5年生存率仅为15%,但ⅠA期肺癌患者术后5年生存率可达80%~97%[2]。然而,肺癌早期症状不具有特异性,容易漏诊,发现时多已属于晚期。即使早期诊断的肺癌,也可能因为体积较小或心存侥幸等原因放弃手术。文献报道,12%~73%的孤立型肺小结节(solitary pulmonary nodule,SPN)为肺癌或癌前病变[3]。另外,传统开胸手术难以对较小的SPN进行定位,反复挤压、寻找肿瘤容易造成肿瘤细胞的扩散[4]。近年来,计算机断层扫描(CT)三维重建并引导带钩钢丝(Hookwire)定位和电视胸腔镜手术(video-assisted thoracoscopic surgery,VATS)能较好地解决病灶定位和精准切除的难题,实现了诊断治疗一次完成[5]。本研究拟对94例SPN患者行CT三维重建联合Hookwire定位,根据术中病理结果确定手术切除范围,旨在为早期肺癌的临床诊治提供参考,现报道如下。
1 对象与方法
1.1 研究对象
选取2017年3月至2019年7月在洛阳市中心医院诊治的94例SPN患者作为研究对象。纳入标准:①经低剂量螺旋CT诊断为SPN;②结节最大直径≤3 cm,符合《国际抗癌联盟恶性肿瘤TNM分期(7版)》[6]关于ⅠA期肺癌的诊断标准;③根据《美国国立综合癌症网络肺癌筛查指南(2016)》[7],随访和治疗后不能明确诊断,怀疑肺癌者。排除标准:①肺内多发结节;②既往有恶性肿瘤史,考虑为肿瘤转移。根据术后病理将患者分为恶性SPN组(60例)和良性SPN组(34例)。恶性SPN组中,男32例,女28例,年龄49~83岁,平均(63.46±5.29)岁;良性SPN组中,男22例,女12例,年龄46~79岁,平均(62.27±6.19)岁。两组患者年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核通过,所有患者均对本研究知情,并签署知情同意书。
1.2 治疗方法
1.2.1 三维重建 首先对患者进行胸部增强CT扫描(Toshiba A quilion ONE 320),增强用药为碘海醇注射液(300 mg/ml)。工作站三维处理软件采用多平面重建(multiplanar reconstruction,MPR)、容积再现(volume reconstruction,VR)、最大密度投影(maximum intensity projection,MIP)和表面覆盖显示(surface sheathe display,SSD)等技术,直观、立体地显示结节的位置、深度、边界、毛刺征、分叶征、胸膜凹陷征、血管集束征及空泡征等特点。根据三维重建图像,明确病灶所属肺段及预期的处理方式。
1.2.2 Hookwire 定位 术前1 h以内,患者取合适体位,常规CT平扫,根据三维重建模型中病灶位置及组织毗邻关系,选择最佳进针途径并标记体表穿刺点,根据病灶-胸壁距离及穿刺点与病灶角度确定穿刺深度及角度。常规消毒、铺巾、局部浸润麻醉,Hookwire针沿选定路径进针,再次行CT平扫观察穿刺针是否位于病灶中心,有偏差时进行调整,直至针尖到位,然后释放Hookwire定位钢丝针,回收针套,立即送患者至手术室。
1.2.3 VATS 手术方案 患者取健侧卧位,行双腔气管内插管静脉复合麻醉,健侧单肺通气。选取腋前线第7肋间做1.0 cm切口为主操作孔,腋后线第9肋间做1.0 cm切口为观察孔,术中可于腋中线第4肋间做0.5 cm切口牵拉肺叶。胸腔镜下根据定位钩位置定位病灶,采用切割缝合器楔形切除病灶及周围5 mm肺组织。切开取出的病灶确认切除正确,而后立即送快速冰冻切片检查,确认良性SPN及原位癌则手术完毕;如为浸润性肺癌则进一步行根治性手术,延长第4肋间操作孔至1 cm,行肺叶/肺段切除术+纵隔淋巴结清扫术。若出现胸膜粘连严重者转行微创开胸手术。
1.3 观察指标
记录患者术前病灶影像学特征、术后病理类型、VATS手术时间、术中出血量及住院时间。观察并分别记录Hookwire针定位操作和VATS手术相关并发症。VATS手术时间指从胸腔镜进入胸腔至病灶切除的时间间隔,不含因各种原因转开胸手术者。
1.4 统计学分析
采用SPSS 22.0统计学软件对数据进行分析。计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 病理结果
94例患者中,恶性SPN 60例(58.51%),其中腺癌55例(58.51%),鳞状细胞癌4例(4.26%),腺瘤样不典型增生1例(1.06%);良性SPN 34例,其中炎性损害20例(21.28%),错构瘤9例(9.57%),结核瘤3例(3.19%),肺囊肿2例(2.13%)。患者术后病理结果与术中快速病理结果符合率为100%。
2.2 三维影像学特征
良恶性SPN病灶血管集束征、空泡征及左右肺分布比例比较,差异均无统计学意义(P>0.05)。恶性SPN边界不规则、毛刺征、分叶征、胸膜凹陷征、内部钙化灶和肺上叶比例均高于良性SPN病灶,差异均有统计学意义(P<0.05)。(表1、图1)
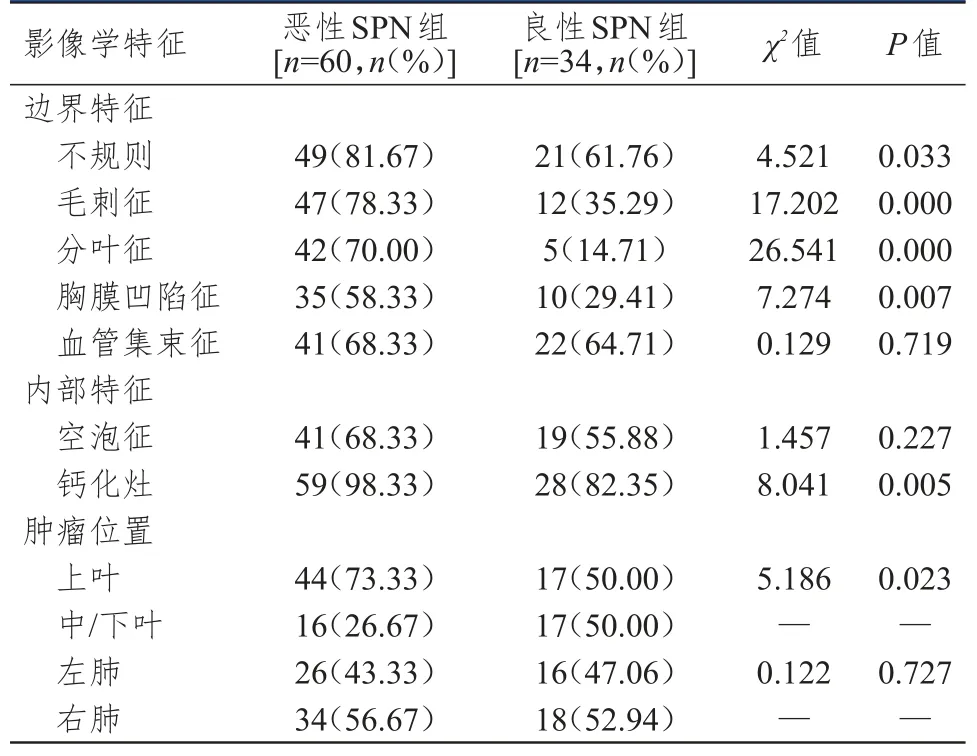
表1 恶性和良性SPN患者影像学特征的比较(n=94)
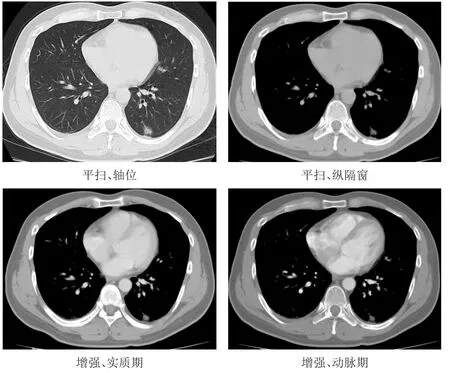
图1 典型病例左下肺结节影像图
2.3 手术情况
Hookwire定位针首次定位成功93例,成功率为98.94%,1例失败原因是脏层胸膜增厚,定位针未能一次穿透,二次定位成功。术中发现定位针脱落2例(2.13%),均能在胸腔镜下通过观察脏层胸膜下血肿准确定位并切除病灶。VATS楔形切除手术成功率为98.94%,1例患者因胸膜粘连严重转行微创开胸手术。VATS楔形切除手术时间为(20.75±8.22)min,术中出血量为(26.58±9.43)ml,术后住院时间为(5.45±2.16)d。
2.4 并发症发生情况
定位操作并发症发生率为17.02%(16/94),其中少量气胸9例(9.57%),胸膜反应3例(3.19%),定位针脱落2例(2.13%),肋间血管损伤致少量胸腔积血2例(2.13%)。未发生VATS术中并发症。术后并发症发生率为4.26%(4/94),其中肺部感染2例(2.13%),乳糜胸1例(1.06%),胸腔出血1例(1.06%)。
3 讨论
虽然中国肺癌发生率较高,但肺癌的早期诊断率仍明显低于发达国家水平[8],主要原因:①健康人群健康体检率低,高危人群低剂量螺旋CT筛查率低;②许多体检发现的SPN未被充分重视;③肺癌早期症状无特异性,易漏诊。近年来,早期肺癌的诊疗技术有了长足进步,薄层CT的广泛应用,使许多微小病灶得以早期发现[9];CT三维重建技术的应用,使术前病灶形态和定位更加精确;Hookwire定位针和VATS手术的应用使小病灶的定位和切除更加精准,诊断和手术一次完成,避免了细针穿刺活检带来的肿瘤细胞沿窦道扩散的风险[10]。
本研究采用CT三维重建联合Hookwire定位的方式,VATS病灶/肺段切除手术时间仅为(20.75±8.22)min,明显短于一般VATS手术[11]。CT三维重建联合Hookwire定位的优点:①术前明确病灶解剖关系,缩短手术时间。由于肺支气管和肺段常存在个体变异,较为复杂,肿瘤病灶常伴有血管生长紊乱,若术中才弄清患者肺段情况和病灶的血管走形,无疑会延长手术时间,增加患者负担[12]。②精确定位病灶位置,避免病灶被不断挤压。三维重建模型是在肺充气状态下建立的,而手术时肺处于萎陷状态,两者间移位较大,三维模型不能与实际手术视野完全对应[13]。另外由于ⅠA期肺癌≤3 cm,且部分癌灶位置深、触感较软,术中寻找困难,而Hookwire定位针的延长线可帮助术者快速找到病灶中心,避免了反复挤压肺组织发生肿瘤细胞扩散风险。③预判肺段切缘,提高手术切除精度。术前根据患者肺段血管、支气管及邻近肺段关系,在三维重建图像上标记安全切缘,可在保证切除病灶的基础上,将切除范围尽可能缩小,术中快速准确获得切缘[14]。④设计手术方案,便于制定预案。
CT三维重建联合Hookwire定位也存在一些缺点:①CT三维重建尚不成熟。三维重建由外科医师和放射科医师手工完成,费时费力,且获得病灶图像和CT断面图精度无差异,本研究中恶性SPN边界不规则、毛刺征、分叶征、胸膜凹陷征和内部钙化灶比例均高于良性SPN病灶(P<0.05),与以往研究无异[15]。②Hookwire定位并发症风险较高,本研究中发生率为17.02%(16/94),虽然多数是少量气胸、胸膜反应等轻微并发症,但2例(2.13%)患者出现定位针脱落,与文献报道脱落率(0.8%~6.9%)接近[16]。所幸本研究2例脱落患者术后病理均为炎性反应。而对于恶性肿瘤是否会因为定位针脱落造成肿瘤细胞种植转移,脱钩后如何补救,仍需要大量研究。③增加医疗成本,加重患者负担。对于一般良性SPN患者,医疗成本显著增加。
综上所述,CT三维重建联合Hookwire定位较好地解决了ⅠA期肺癌精准定位切除的问题,但也存在定位针脱落等风险,仍需进一步研究论证。

