国内人乳头瘤病毒检测技术在不同实验室间的重复性评价研究△
薛鹏,沈洁,韩历丽#,江宇,陈汶,乔友林
1中国医学科学院北京协和医学院公共卫生学院,北京 100730
2国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院流行病学研究室,北京 100021
3首都医科大学附属北京妇产医院北京妇幼保健院妇女保健科,北京 100026
宫颈癌是女性常见的恶性肿瘤,严重威胁女性的生命健康。随着高危型人乳头瘤病毒(high riskhuman papillomavirus,HR-HPV)和宫颈癌病因关系的建立,针对HR-HPV的检测已成为宫颈癌筛查的主要手段[1-2]。由于人乳头瘤病毒(human papillomavirus,HPV)检测技术具有较高的灵敏度和阴性预测值,现已被一些国家作为初筛方法纳入国家宫颈癌筛查体系[3-5]。2015年,中国国家食品药品监督管理总局(China Food and Drug Administration,CFDA)进一步规范了HPV检测试剂盒的临床功能验证[6]。尽管中国部分HPV试剂已通过严格的临床性能评价[7],表现出较高的灵敏度和特异度,但尚缺乏国产HPV试剂在不同实验室间的重复性评价研究,难以保证其HPV检测结果的真实可靠,在一定程度上限制了其作为宫颈癌初筛方法的推广和应用。本研究初步评价国内两种实时荧光聚合酶链反应(polymerase chain reaction,PCR)方法在不同实验室间检测HPV的可重复性,以确保其HPV检测结果的可靠性,旨在为中国HPV检测技术的发展提供数据依据,现报道如下。
1 对象与方法
1.1 研究对象
选择2016年11月至2017年5月于中国医学科学院肿瘤医院和北京大学第一医院接受宫颈癌筛查或门诊就诊的210例患者,年龄为23~65岁,平均(40.2±6.3)岁,无妊娠可疑征兆,无子宫或宫颈外科手术史。本研究经中国医学科学院肿瘤医院伦理委员会批准,所有患者均对本研究知情并签署知情同意书。
1.2 标本收集和处理
各医院妇科医师应用宫颈细胞采样刷收集宫颈脱落细胞标本,并转移至细胞保存液PreservCyt中保存,严格遵守无菌操作原则进行分样,分别低温保存并运送至北京洛奇临床检验所实验室和爱普益医学检验中心实验室进行透景HPV检测,以及运送至北京凯普医学检验所和朝阳区妇幼保健院实验室进行凯普HPV检测。
1.3 透景HPV 检测
收集1 ml经PreservCyt提取纯化后的DNA 5.0 μl,加入含有 20 μl反应液的 PCR 管中,置于ABI7500荧光PCR仪上。设置参数:95℃10 min;95 ℃ 10 s,60 ℃ 35 s,72 ℃ 20 s,共循环46次,单点荧光检测在60℃,PCR反应体系的体积为25 μl。采用ABI7500荧光PCR仪的3种荧光通道(VIC、ROX、FAM)分别检测HPV16、18和其他12种HRHPV(HPV31、33、35、39、45、51、52、56、58、59、66、68)。当VIC、ROX、FAM荧光通道的Ct值≤30且增长曲线呈光滑型起跳时,则判定为阳性;当Ct值>30时,则判定为阴性。
1.4 凯普HPV 检测
取纯化后的 DNA 2.0 μl,加入含有 18 μl反应液的PCR管中,置于全自动定量PCR荧光仪上。设置参数:95 ℃ 10 min;95℃ 10 s,60 ℃ 60 s,38℃5 s,共循环47次,单点荧光检测在60℃,PCR反应体系的体积为20 μl。3种荧光通道(FAM、HEX、ROX)可分别检测HPV16、18和其他12 种 HR-HPV(HPV31、33、35、39、45、51、52、56、58、59、66、68)。当FAM、HEX、ROX 荧光通道的Ct值≤40时,则判定为阳性;当Ct值>40时,则判定为阴性。
1.5 统计学分析
采用SAS 9.4软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kappa检验评价不同实验室检测技术的可重复性。以P<0.05为差异有统计学意义。
2 结果
2.1 不同实验室间透景HPV 检测结果的比较
透景HPV试剂在不同实验室间检测HR-HPV的总一致率为99.52%(95%CI:97.35%~99.92%),Kappa值为 0.99(95%CI:0.97~1.00);检测 HPV16和HPV18的总一致率分别为99.52%(97.35%~99.92%)和 100%,Kappa值分别为 0.99(95%CI:0.97~1.00)和1.00;检测其他12种HR-HPV的总一致率为99.52%(95%CI:97.35%~99.92%),Kappa值为0.99(95%CI:0.97~1.00)。(表1)
2.2 不同实验室间凯普HPV 检测结果的比较
凯普HPV试剂在不同实验室间检测HR-HPV的总一致率为99.05%(95%CI:96.59%~99.74%),Kappa 值为 0.98(95%CI:0.96~1.00);检测 HPV16和HPV18的总一致率分别为98.57%(95%CI:95.88%~99.51%)和100%,Kappa值为0.97(95%CI:0.93~1.00)和1.00;检测其他12种HR-HPV的总一致率为98.57%(95%CI:95.88%~99.51%),Kappa值为0.97(95%CI:0.93~1.00)。(表2)
2.3 两种检测技术在不同实验室间检测HPV的不一致结果
对不一致的HPV检测结果进行分析,透景试剂检测HPV16有1例不一致样本,Ct值为26.79,检测其他HR-HPV有1例不一致样本,Ct值为25.47。凯普试剂检测HPV16有3例不一致样本,Ct值分别为28.96、25.96和34.57,检测其他HRHPV有3例不一致样本,Ct值分别为36.58、33.69和39.33。两种试剂检测HPV18均未发现不一致。(表 3)
3 讨论
目前,宫颈癌筛查存在多种策略,主要检测技术包括HPV DNA和薄层液基细胞学[8]。由于细胞学检查主观性强,可重复性差,需要经验丰富的细胞学医师和专业设备,同时国内细胞学相关技术人员稀缺,难以建立行之有效的宫颈癌筛查体系[9]。基于中国的国情及宫颈癌筛查现状,采用HPV DNA检测作为宫颈癌的初筛方法更具筛查效能,中国政府已将HPV检测技术纳入国家“两癌”筛查项目中,而HPV检测方法的准确性是决定宫颈癌筛查质量的关键[8,10]。国际上针对HPV试剂能否应用于宫颈癌筛查有具体规定,新研发的HPV检测试剂的灵敏度和特异度不能劣于参照标准HC2或GP5+/GP6+PCR,此外,其实验室内和实验室间重复性的较低置信区间界限不低于87%,同时保持Kappa值大于或等于0.5[11]。美国食品药品管理局(Food and Drug Administration,FDA)批准上市的HPV检测试剂包括HC2、Cervista HPV、Cobas HPV、Aptima HPV和BD Onclarity HPV,均经过上述严格的评价过程,表现出理想的临床性能和实验室内、实验室间的重复性[12-13]。但考虑其检测试剂和仪器设备造价昂贵,推广至中国宫颈癌筛查体系中受到限制。近年来,国产HPV检测试剂飞速发展,由CFDA批准的HPV检测试剂多达60余种[14]。中国一项研究针对国内市场上不同平台的HPV试剂进行了系统性临床性能评价,结果表明,84.2%(16/19)的实验室及HPV试剂的临床灵敏度均达到了90%以上,特异度为89.1%~65.94%,其中实时荧光PCR方法的临床性能最佳[15],但尚不明确其HPV检测结果是否真正准确及可靠。
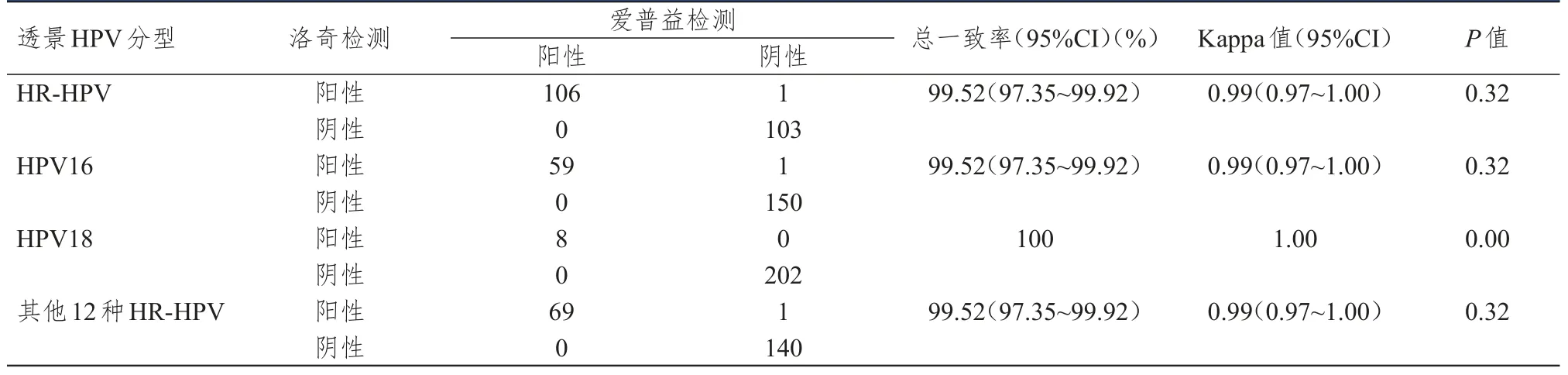
表1 不同实验室间透景HPV检测结果的比较(n=210)
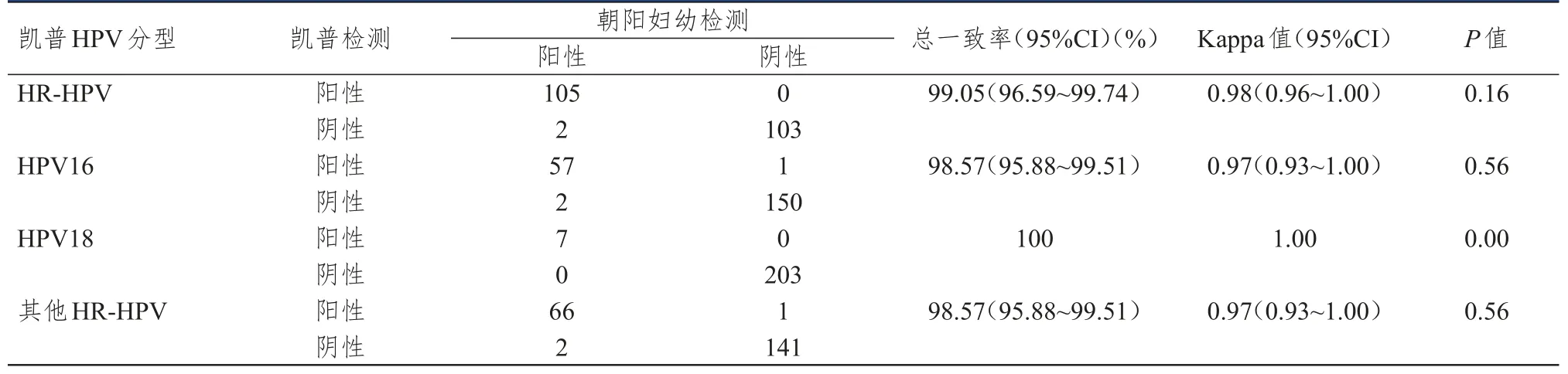
表2 不同实验室间凯普HPV检测结果的比较(n=210)
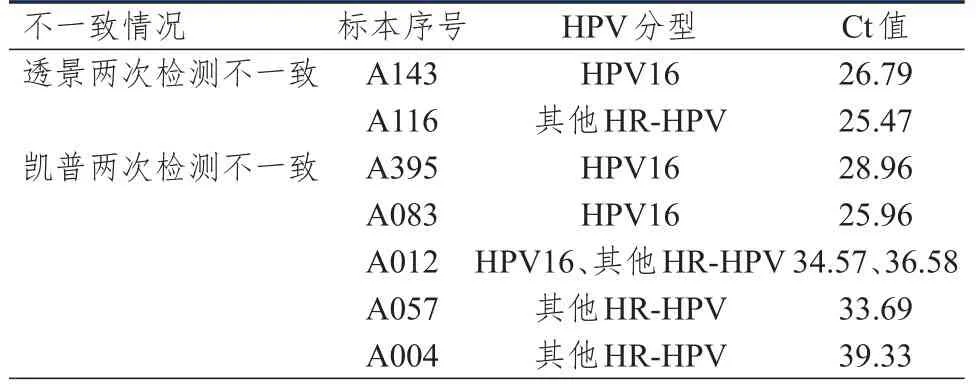
表3 两种检测技术在不同实验室间检测HPV的不一致结果
本研究初步评价了国内两种实时荧光PCR方法在不同实验室间检测HPV的可靠性。透景和凯普试剂检测HR-HPV、HPV16、HPV18以及其他HR-HPV在不同实验室间的重复性均超过98%,甚至两种方法检测HPV18的重复性均达到了100%,表明中国透景和凯普HPV试剂的检测结果稳定可靠,但仍有低于2%的样本不一致。本研究结果显示,不一致的样本中有71.4%(5/7)Ct值较高,接近这两种检测方法设定的cut-off值,表明有较低水平的HPV载量,即HPV弱阳性。比利时的一项研究评估了Xpert HPV检测技术在不同实验室间的重复性,结果证实大部分不一致样本的Ct值均接近其检测方法的cut-off值[16]。挪威的一项研究也证实了这一结果[17]。本研究认为HPV检测技术在不同实验室间的微小差异主要来自HPV弱阳性结果。虽然HPV弱阳性结果在筛查中的发生率并不高,但仅凭单次HPV检测结果将弱阳性结果判定为阳性是不严谨的做法[18]。因此,建议对HPV检测中出现的弱阳性结果予以重视,可考虑对其重新取样或进行重复性检测,使用更为精准的检测手段予以证实,避免漏诊和误诊,以保证宫颈癌筛查质量。
综上所述,透景HPV和凯普HPV检测方法在不同实验室间检测HPV的重复性和Kappa值远超过国际法规所要求的一致率≥87%,Kappa≥0.5,是可靠的HPV检测技术,在未来可能用于宫颈癌筛查。但本研究样本量较少,结果可能存在一定的偏倚。因此,为准确评价两种实时荧光PCR方法在不同实验室间检测HPV的可靠性,尚需要在大规模筛查中进一步验证,以提供更为可靠的证据。

