三七总皂苷抑制缺氧缺糖/复氧复糖诱导的SH-SY5Y细胞焦亡*
唐 标, 唐文静, 戴姿薇, 佘 旭, 邓常清
(湖南中医药大学医学院,长沙湖南410028)
脑缺血再灌注损伤作为缺血性脑卒中的重要环节,其损伤机制与线粒体功能障碍、氧化应激、兴奋性毒性、凋亡、炎症等多因素有关[1-2]。细胞焦亡(pyroptosis)作为一种炎症相关的细胞死亡方式,参与了脑缺血再灌注中的炎症反应。当细胞焦亡启动后,gasdermin D(GSDMD)作为细胞焦亡的执行分子,其被活化后的GSDMD N 端片段(GSDMD N-terminal fragment,GSDMD-N)会形成聚合物并与细胞膜上的脂质分子形成孔道,导致细胞肿胀破裂,释放大量促炎因子,加重炎症反应[3]。已有研究表明,脑缺血再灌注诱导细胞焦亡,抑制细胞焦亡能减轻脑缺血再灌注损伤,细胞焦亡成为脑缺血再灌注损伤干预的重要靶点[4-6]。
三七是治疗心脑血管疾病的名贵中药,三七总皂苷(Panax notoginsengsaponins,PNS)是三七的主要有效成分,含多种单体皂苷,其制剂如血栓通注射液、血塞通注射液等在心脑血管疾病的防治中被广泛应用[7-8]。已有大量的研究揭示PNS及其有效成分具有抗炎、抗血栓、抗氧化、抗动脉粥样硬化、抑制脑神经细胞凋亡、促进血管新生、减轻脑缺血损伤等多方面的作用,但是其对细胞焦亡的调控作用和机制还不明确[9-11]。因此,本研究采用缺氧缺糖/复氧复糖(oxygen-glucose deprivation/reoxygenation,OGD/R)构建体外脑缺血再灌注SH-SY5Y 细胞模型,观察PNS对OGD/R 诱导的SH-SY5Y 细胞焦亡的影响,探讨PNS 对OGD/R 诱导的SH-SY5Y 细胞焦亡的调控机制。
材 料 和 方 法
1 材料
1.1 细胞株 人神经母细胞瘤细胞系SH-SY5Y 购于中国科学院上海细胞生物学研究所。
1.2 药物及主要试剂 PNS(中国成都曼斯特生物科技有限公司,批号MUST-14122912,纯度≥98%);高糖 DMEM 和无糖DMEM 培养液(Gibco);CCK-8 试剂盒(大连美仑生物技术有限公司);兔抗人caspase-1、caspase-4 和 GSDMD 单克隆抗体(Cell Signaling Technology);鼠抗人β-actin 单克隆抗体(Sigma);山羊抗兔II 抗和山羊抗鼠II 抗(Merck Millipore);人白细胞介素 1β(interleukin-1β,IL-1β)ELISA 检测试剂盒、细胞凋亡与坏死检测试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒(上海碧云天生物技术有限公司);人IL-18 ELISA 检测试剂盒(上海岚派生物科技有限公司);兔抗人caspase-1 前体(procaspase-1)多克隆抗体和鼠抗人caspase-4前体(procaspase-4)单克隆抗体(Proteintech)。
1.3 主要仪器 CO2培养箱(长沙奇美仪器有限公司);自动酶标仪(BioTek);电泳仪、转膜仪和凝胶成像系统(Bio-Rad);缺氧培养气室MC-101 和混合气阀(Billups-Rothenberg)。
2 方法
2.1 细胞培养 细胞用含10%胎牛血清和双抗的高糖DMEM 培养液,放置于37℃、5% CO2培养箱中培养。根据细胞生长状况,待细胞汇合度为90%左右时,用0.25%的胰蛋白酶消化收集细胞并传代,取对数生长期的细胞用于实验。
2.2 SH-SY5Y 细胞OGD/R 模型的建立 参照文献[12],各组 OGD/R 预处理的细胞,以无糖 DMEM 培养液轻轻冲洗一遍,每孔加入37℃预热的无糖DMEM 培养液,放入缺氧培养气室中,持续通入95%N2和5% CO2的混合气体,1.5 L/min,持续6 min,以保证缺氧培养气室内缺氧环境的稳定和完全,通气结束后,关闭缺氧培养气室,放于培养箱中培养2 h;OGD处理结束后,各组细胞换回高糖DMEM培养液,并于37℃、5%CO2培养箱中继续培养,进行复氧复糖24 h。
2.3 细胞活力检测 取生长状态良好、汇合度为90% 的 SH-SY5Y 细胞,接种于 96 孔板,每孔 1×104个细胞,在37℃、5%CO2培养箱中,用含10%胎牛血清的高糖DMEM 培养液培养4 h。待细胞贴壁后,弃去原培,加入无血清培养液,培养24 h。同步化后,再弃原液,加入含药培养液100 μL(PNS浓度参照文献选择40、80、160、320、640 和1 280 mg/L[10-11]),同时设置不含药物、含培养液和细胞的空白对照(control)组,干预24 h。24 h 之后弃去原培养液,加含10%CCK-8 的培养液100 μL,另设空白孔(不含细胞,只含10%CCK-8的培养液)。在37℃、5%CO2培养箱中孵育1 h 后,用酶标仪检测其在450 nm 处的吸光度(absorbance,A)。实验每组设置6 个复孔,重复3次。细胞相对活力(%)=(样品平均A值-空白孔平均A值)/(空白对照组平均A值-空白孔平均A值)×100%。
另一实验设空白对照组、OGD/R 处理组及PNS干预组,亦进行细胞活力检测。各组细胞经接种培养、同步化后,空白对照组不做处理继续正常培养,OGD/R 处理组及PNS 干预组进行OGD 处理。OGD处理2 h后,OGD/R 处理组换以高糖DMEM 培养液进行复氧复糖24 h;PNS 干预组换以含PNS(根据细胞活力检测部分结果选择无显著细胞毒性的浓度:40、80、160和320 mg/L)的高糖DMEM 培养液进行复氧复糖24 h。各组中任何一组的任何一次换液,空白对照组也均平行换液,以排除换液对细胞损伤的影响。复氧复糖结束后进行CCK-8 实验,检测方法和分析同上。实验重复3次。
2.4 LDH 漏出率检测 各组细胞接种于96 孔板中,试验设空白对照组、OGD/R 处理组及PNS 干预组,同时设空白孔(不接种细胞,只加培养液),空白对照组设6 个复孔,其他组每组设置3 个复孔,各组处理方式同前。处理结束后,选取空白对照组中的3个复孔加入10 μL LDH 释放试剂,作为样品细胞最大酶活性对照孔,其他组每孔加入10 μL 培养液,继续于培养箱中培养1 h后,将细胞培养板用多孔板离心机400×g离心5 min。分别取各孔的上清液60 μL,加入到新的96 孔板相应孔中,各孔再分别加入60 μL LDH 检测工作液,轻轻混匀后,室温避光孵育30 min,在490 nm处测定A值。LDH漏出率(%)=(样品平均A值-空白孔平均A值)/(细胞最大酶活性孔平均A值-空白孔平均A值)×100%。实验重复3次。
2.5 Hoechst 33342/碘化丙啶(propidium iodide,PI)染色检测 Hoechst 33342是一种可以穿透细胞膜并结合DNA 的蓝色荧光染料,可通过完整的细胞膜而使细胞核显蓝光;PI是一种可以嵌合到双链DNA 和RNA 的碱基对中并与之结合的荧光染料,无碱基特异性,仅能通过受损的细胞膜而使细胞核显红光。各组细胞接种于24 孔板,每孔1×105个细胞,分组和处理同前。处理后各孔加入5 μL Hoechst 33342 染色液和5 μL PI染色液,混匀,于4℃染色20 min,荧光显微镜下观察,随机选取3 个非重叠的视野,计数每个视野中的细胞总数及红色荧光细胞数,参照文献计算PI 阳性细胞比例[13]。PI 阳性细胞比例(%)=红色荧光细胞数/细胞总数×100%。每组设置3 个复孔,实验重复3次。
2.6 Western blot 检测焦亡相关蛋白 各组细胞接种于6 孔板内,每孔5×105个细胞,分组和处理同前。处理结束后去上清,用预冷PBS 洗1 次,每孔加含蛋白酶抑制剂和磷酸酶抑制剂的裂解液50 μL,冰上裂解30 min,边裂解并用移液枪轻柔吹打,促进细胞裂解。裂解后,4℃、2 400×g离心10 min,取出含有组织总蛋白的上清液。加上样缓冲液后于沸水浴加热10 min,以使蛋白充分变性。经电泳、转膜、封闭,将膜与 I 抗[GSDMD(1∶1 000)、caspase-1(1∶1 000)、caspase-4(1∶1 000)、procaspase-1(1∶500)、procaspase-4(1∶500)和β-actin(1∶5 000)抗体]置于4℃孵育过夜,用 TBST 缓冲液洗膜后,将II 抗(1∶10 000 稀释)与膜于室温摇床上孵育60 min。ECL 显色曝光,用Quantity One 灰度分析软件进行图像定量分析,计算目的蛋白积分吸光度(integrated absorbance,IA)与内参照蛋白IA的比值,以此表示蛋白相对含量。每组设置3个复孔,实验重复3次。
2.7 ELISA 法检测细胞培养上清 IL-1β 和 IL-18 含量 细胞接种于24 孔板,分组和处理同前。处理结束后,细胞培养上清100×g离心5 min,取上清,按照试剂盒说明书进行检测。试剂盒于室温下平衡20 min后,将样品或稀释好的不同浓度标准品按照每孔100 μL 加入相应孔中,每孔设置1 个复孔。同时设置本底校正孔,即空白孔,设置方法为该孔只加TMB溶液和终止液。用封板膜封住反应孔,室温孵育120 min后,洗板5次,且最后一次置于厚吸水纸上拍干;每孔加入生物素化抗体100 μL,封孔后室温孵育60 min,洗板5 次;每孔加入辣根过氧化物酶标记的链霉亲和素100 μL,室温避光孵育20 min,洗板5次;每孔加入TMB显色液100 μL,室温避光孵育20 min;每孔加入终止液50 μL,混匀后立即在450 nm 处测定A值。根据标准品浓度和A值绘制标准曲线,通过样品A值和标准曲线计算样品浓度。
3 统计学处理
使用SPSS 22.0 软件进行统计分析。所有数据为计量资料,均以均数±标准差(mean±SD)表示。服从正态分布的多组间均数比较采用单因素方差分析,两两比较方差齐时采用最小显著差异(least significant difference,LSD)法,方差不齐时采用Dunnett法;若不服从正态分布,则采用秩和检验。以P<0.05为差异具有统计学意义。
结 果
1 PNS提高OGD/R诱导的SH-SY5Y细胞活力
CCK-8 结果显示,40、80、160 及320 mg/L 的PNS对细胞活力无明显影响(P>0.05),说明该浓度范围的 PNS 无细胞毒性,640 及 1 280 mg/L 的 PNS 显著降低细胞活力(P<0.01),因此选择≤320 mg/L 的浓度进行后续实验;此外,OGD/R处理后的SH-SY5Y细胞活力显著降低(P<0.01),而80、160 及320 mg/L 的PNS显著提高OGD/R 处理后的SH-SY5Y 细胞活力(P<0.05或P<0.01),40 mg/L的PNS对OGD/R处理后的SH-SY5Y 细胞活力无明显影响(P>0.05),因此选择80、160及320 mg/L的PNS进行后续实验,见图1。
2 PNS 降低 OGD/R 诱导的 SH-SY5Y 细胞 LDH 漏出率
OGD/R 处理后的 SH-SY5Y 细胞 LDH 漏出率显著升高(P<0.01),而 80、160 及320 mg/L 的PNS 干预能显著降低OGD/R 处理后的SH-SY5Y 细胞LDH 漏出率(P<0.05或P<0.01),见图2。
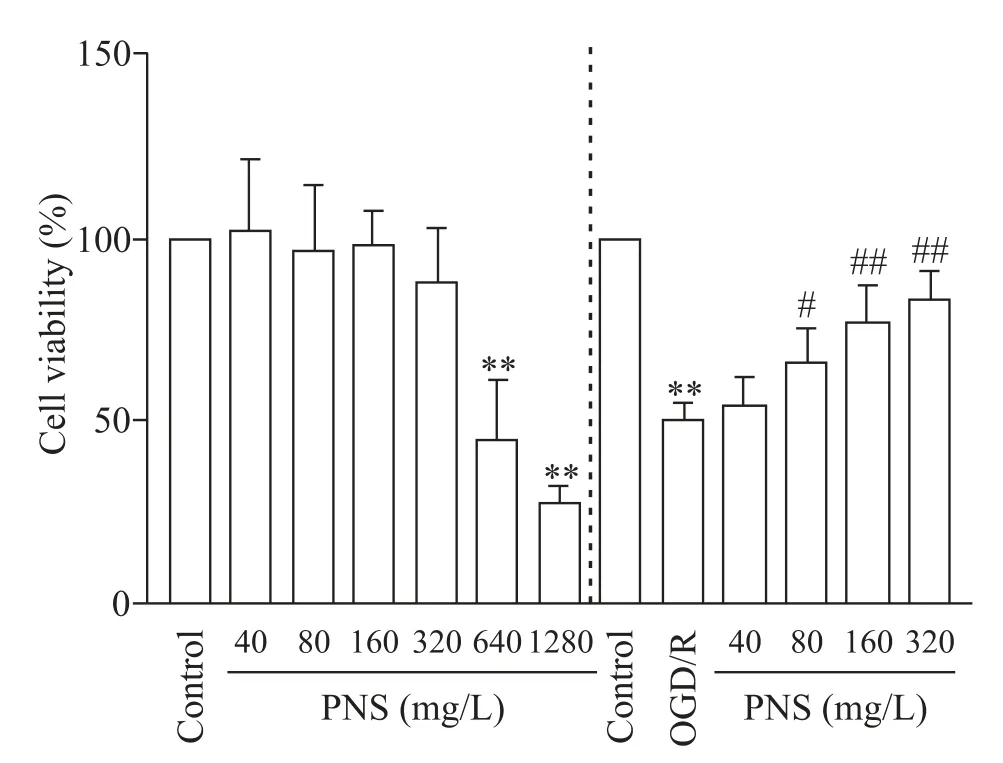
Figure 1.The effect of PNS on the viability of SH-SY5Y cells.Mean±SD. n=3.**P<0.01 vs control group; #P<0.05,##P<0.01 vs OGD/R group.图1 PNS对SH-SY5Y细胞活力的影响
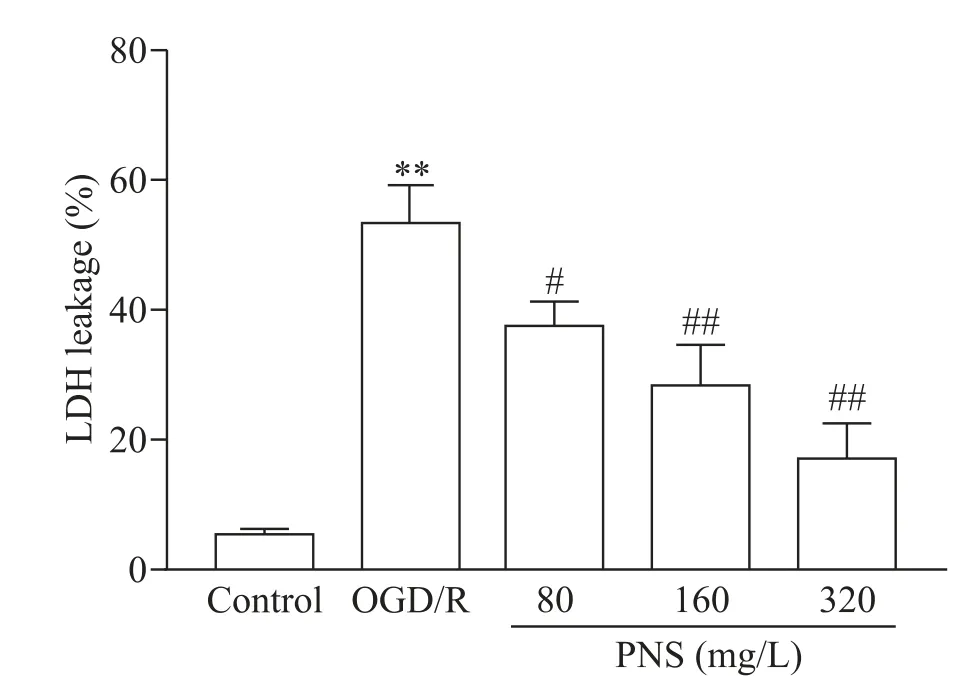
Figure 2.The effect of PNS on the LDH leakage of SH-SY5Y cells.Mean±SD. n=3.**P<0.01 vs control group;#P<0.05,##P<0.01 vs OGD/R group.图2 PNS对SH-SY5Y细胞LDH漏出率的影响
3 PNS 降低 OGD/R 诱导的 SH-SY5Y 细胞 PI 染色阳性细胞比例
Hoechst 33342/PI 染色结果显示,control 组少见红色荧光,OGD/R 处理后的SH-SY5Y 细胞红色荧光增加,PI 阳性细胞显著增加(P<0.01);与OGD/R 组比较,PNS 组细胞红色荧光减少,PI 阳性细胞显著减少(P<0.01),见图3。
4 PNS降低OGD/R诱导的SH-SY5Y细胞GSDMD和GSDMD-N蛋白表达
Western blot 结果显示,与 control 组比较,OGD/R组细胞GSDMD 和GSDMD-N 蛋白表达显著增加(P<0.01);与 OGD/R 组比较,PNS 组 GSDMD 和 GSDMDN蛋白表达显著降低(P<0.01),见图4。
5 PNS 降低 OGD/R 诱导的 SH-SY5Y 细胞 caspase-1和caspase-4蛋白表达
Western blot 结果显示,与 control 组比较,OGD/R处理后的 SH-SY5Y 细胞 procaspase-1、procaspase-4、caspase-1 和caspase-4 蛋白表达显著增加(P<0.01);与 OGD/R 组比较,PNS 组细胞 caspase-1 和 caspase-4蛋白表达显著降低(P<0.05 或P<0.01),但procaspase-1 和procaspase-4 蛋白的表达无显著变化(P>0.05),见图5。
6 PNS抑制OGD/R诱导的SH-SY5Y细胞IL-1β和IL-18分泌
ELISA 结果显示,与 control 组比较,OGD/R 组细胞培养上清中 IL-1β 和 IL-18 含量显著增加(P<0.01);与 OGD/R 组比较,PNS 组细胞培养上清中IL-1β和IL-18含量显著降低(P<0.05 或P<0.01),见图6。
讨 论
OGD/R 是构建脑缺血再灌注体外模型的常用方法[14-15]。本研究以 OGD/R 诱导的 SH-SY5Y 细胞构建脑缺血再灌注体外模型,探讨PNS 对OGD/R 诱导的细胞焦亡的调控作用和机制,结果显示,OGD/R 诱导的SH-SY5Y 细胞活力明显降低,而PNS 干预能显著提高OGD/R 诱导SH-SY5Y 细胞活力。前期有大量体内、体外研究探讨PNS 在脑缺血再灌注中的保护作用,其结果均表明PNS 能减轻脑缺血再灌注损伤[9-11]。
细胞焦亡是一种炎症相关的细胞死亡方式,介导了脑缺血再灌注损伤的发生和发展过程[16],因此本研究从细胞焦亡途径探讨PNS 抗脑缺血再灌注损伤机制。细胞焦亡的主要特征为细胞膜穿孔,通透性变大,细胞焦亡执行蛋白GSDMD 被活化[3]。本研究结果显示OGD/R 诱导的SH-SY5Y 细胞LDH 漏出率明显升高,PI染色红色荧光增强,PI阳性细胞比例明显升高,表明细胞膜通透性增加,同时结果显示OGD/R 诱导的SH-SY5Y 细胞GSDMD 蛋白及其主要活化产物GSDMD-N 的表达明显增加,这与已有研究结果一致[4],再结合OGD/R 可诱导原代星形胶质细胞和 PC12 细胞焦亡的报道[5,17],表明 OGD/R 可诱导SH-SY5Y细胞焦亡。而PNS干预后LDH漏出率明显降低,PI染色红色荧光减弱,PI阳性细胞比例显著降低,细胞GSDMD 蛋白及其主要活化产物GSDMD-N的表达明显减少,结合抑制GSDMD 可以抑制细胞焦亡、减轻脑缺血再灌注损伤的报道[4-5],提示PNS可能通过抑制细胞焦亡减轻OGD/R 诱导的SH-SY5Y 细胞损伤。
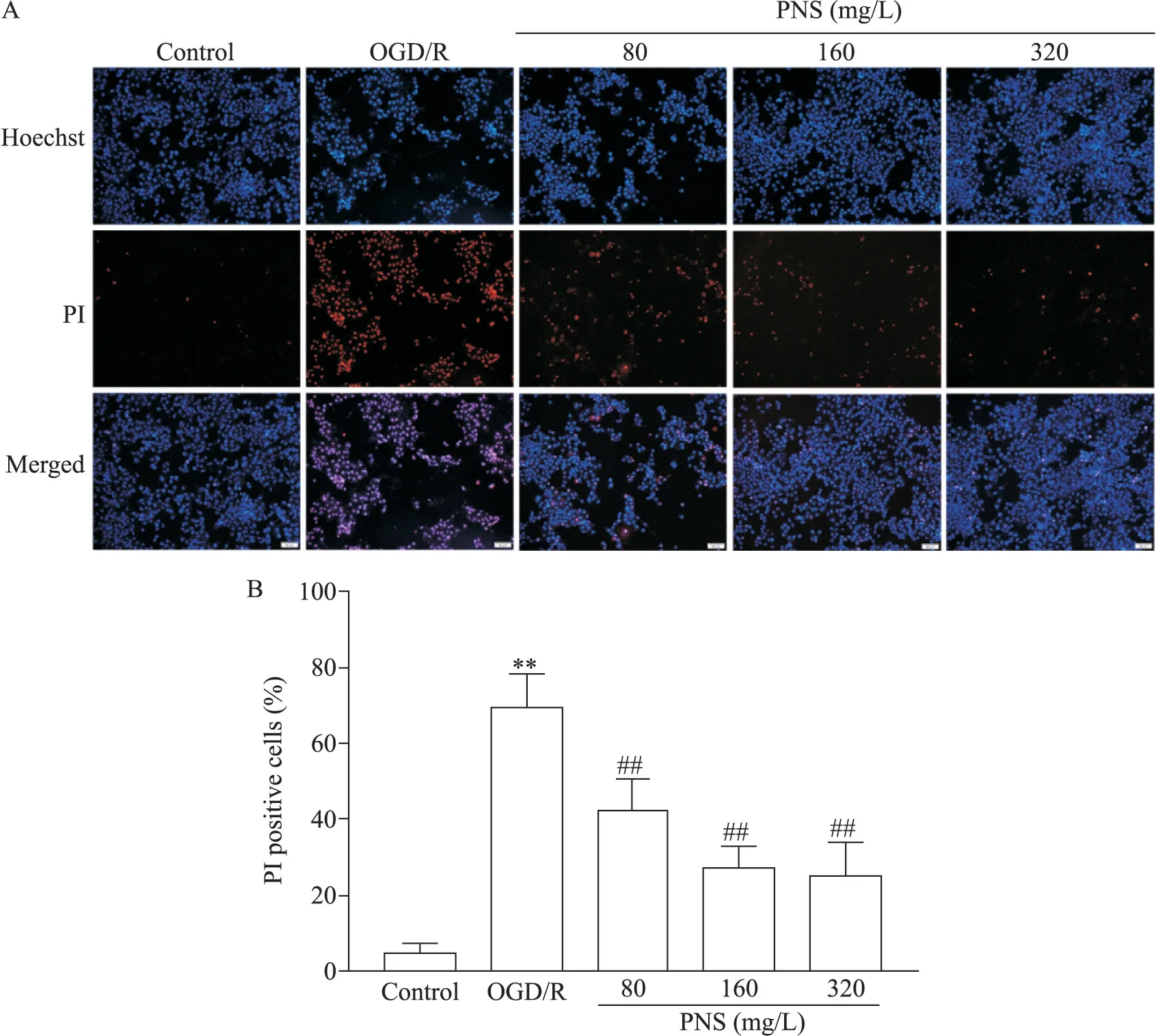
Figure 3.The effect of PNS on SH-SY5Y cells with Hoechst 33342/PI staining.A:Hoechst 33342/PI staining in SH-SY5Y cells of each group(scale bar=50 μm);B:the percentage of the PI positive cells to total cells.Mean±SD. n=3.**P<0.01 vs control group;##P<0.01 vs OGD/R group.图3 PNS对SH-SY5Y细胞Hoechst 33342/PI染色的影响

Figure 4.The effect of PNS on protein expression of GSDMD and GSDMD-N in SH-SY5Y cells.Mean±SD. n=3.**P<0.01 vs control group;##P<0.01 vs OGD/R group.图4 PNS对SH-SY5Y细胞GSDMD和GSDMD-N蛋白表达水平的影响
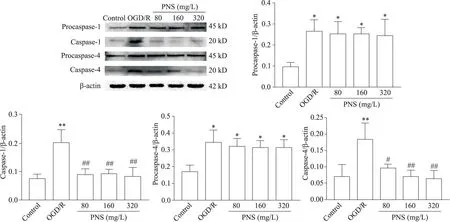
Figure 5.The effect of PNS on protein expression of caspase-1 and caspase-4 in SH-SY5Y cells.The protein levels of procaspase-1,caspase-1,procaspase-4 and caspase-4 in each group were detected by Western blot.Mean±SD. n=3.**P<0.01 vs control group;#P<0.05,##P<0.01 vs OGD/R group.图5 PNS对SH-SY5Y细胞caspase-1和caspase-4蛋白表达水平的影响

Figure 6.The effect of PNS on the levels of IL-1β(A)and IL-18(B)in the supernatants.Mean±SD. n=3.**P<0.01 vs control group;#P<0.05,##P<0.01 vs OGD/R group.图6 PNS对SH-SY5Y细胞培养上清中IL-1β和IL-18含量的影响
GSDMD 的 活 化 由 caspase-1/4/5/11 介 导 ,caspase-4/5 为小鼠 caspase-11 在人体中的同源蛋白[18]。本研究进一步观察了PNS对OGD/R 诱导的SH-SY5Y细胞 caspase-1、caspase-4、procaspase-1 和 procaspase-4 表达的影响,结果显示 OGD/R 诱导的 SH-SY5Y 细胞 caspase-1、caspase-4、procaspase-1 和 procaspase-4的表达明显增加,这与已有研究报道一致[19],表明OGD/R 可诱导 caspase-1 和 caspase-4 活化。而 PNS干预对procaspase-1 和procaspase-4 的表达无显著影响,但显著降低caspase-1 和caspase-4 的表达,提示PNS 干预能抑制OGD/R 诱导的SH-SY5Y 细胞caspase-1 和caspase-4 活化。已有研究证实,在小鼠脑缺血再灌注中存在caspase-1 和caspase-11 的活化,抑制其活化可减轻脑缺血再灌注损伤[19-20],提示PNS可能通过抑制caspase-1 和caspase-4 的活化而抑制OGD/R诱导的SH-SY5Y细胞焦亡。
此外,caspase-1 和caspase-11 的活化将剪切IL-1β 和 IL-18 的前体,生成 IL-1β 和 IL-18,细胞焦亡发生导致细胞膜损伤,IL-1β和IL-18被释放[3]。本研究结果显示OGD/R 处理后的SH-SY5Y 细胞培养上清中 IL-1β 和 IL-18 含量显著增加,而 PNS 干预后细胞细胞培养上清中IL-1β 和IL-18 含量显著降低,表明PNS 能抑制 OGD/R 诱导的 SH-SY5Y 细胞 IL-1β 和 IL-18的释放。
已有研究报道,OGD/R 能诱导细胞焦亡[4]。本研究结果揭示OGD/R 诱导SH-SY5Y 细胞焦亡,并且PNS 能抑制 caspase-1、caspase-4 和 GSDMD 的剪切活化,从而抑制OGD/R诱导的SH-SY5Y细胞焦亡。
综上所述,OGD/R 可诱导SH-SY5Y 细胞焦亡,PNS 能减轻 OGD/R 诱导的 SH-SY5Y 细胞损伤,其机制与抑制细胞焦亡以及IL-1β和IL-18的释放有关。

