白藜芦醇通过调节miR-223-3p/NLRP3通路发挥对幼年大鼠脑膜炎模型皮质神经元的保护作用*
高 蒙, 黄 娟
(重庆医科大学基础医学院人体解剖学教研室,重庆400016)
新生儿细菌性脑膜炎(bacterial meningitis,BM)是新生儿期严重的急性感染性疾病,其发病率约占新生儿总数的0.2%~1.0%,在早产儿中则高达3%[1]。B 族溶血性链球菌(group B hemolyticStreptococcus,GBS)是新生儿脑膜炎的常见致病菌之一,GBS 感染引起的细菌性脑膜炎可导致约10%的患儿死亡,25%~35%的患儿留下严重的神经系统后遗症[2]。细菌性脑膜炎的不良预后与炎症因子释放导致的神经元损伤密切相关[3]。神经元损伤的表现形式有凋亡、坏死、焦亡等[4-6]。细胞焦亡(pyroptosis)又称为细胞炎性坏死,它是近年来发现的一种程序性细胞死亡方式,其特征为依赖于胱天蛋白酶1(caspase-1),并伴有白细胞介素 1β(interlukin-1β,IL-1β)和 IL-18 等炎症因子的释放[7]。有研究显示细胞焦亡与细胞凋亡的发生密切相关[8]。目前,关于在新生儿细菌性脑膜炎模型中是否发生神经元焦亡的研究较少,针对此模型中神经元焦亡的作用,以及抑制焦亡对神经元凋亡的影响等问题,仍有待探讨。
白藜芦醇(resveratrol,Res)是一类存在于虎杖、葡萄、花生、桑葚等多种植物内的多酚类化合物[9]。目前有文献报道白藜芦醇具有广泛的生物和药理活性,对心血管、呼吸、神经等多个系统中的器官和细胞发挥抗氧化、抗凋亡、抗肿瘤等重要作用[10-12]。有研究显示,在肺炎链球菌性大鼠脑膜炎模型中白藜芦醇可抑制小胶质细胞的活化,在海马区发挥抗炎和神经保护作用[13-14]。但白藜芦醇对脑膜炎模型中皮质功能区的神经元是否具有保护作用则未见报道。
微小RNA(microRNA,miRNA,miR)是一类长度约为22 个核苷酸的非编码小分子单链RNA,可通过与靶基因mRNA 互补结合而抑制靶基因的表达,从而发挥调控细胞增殖、分化、迁移等功能[15-16]。有文献显示在中枢神经系统中白藜芦醇可通过调控miRNA 的表达水平发挥神经保护作用[13,17]。在细菌性脑膜炎模型中,白藜芦醇能否通过调控miRNA 的表达水平发挥抗神经元焦亡和凋亡的作用值得研究。在本研究中,我们利用GBS 建立幼年大鼠脑膜炎模型,并针对此模型中白藜芦醇是否通过调控miR-223-3p发挥神经保护作用进行了研究和探讨。
材 料 和 方 法
1 实验动物与分组
3周龄健康SD 大鼠64只(其中术中死亡4只,实验中予以排除),雌雄不限,体重约50 g,由重庆医科大学实验动物中心供应,动物合格证号为SCXK(渝)2018-0003。大鼠饲养于安静,通风和空气过滤系统的环境中,自由摄食和饮水,室温控制在(25±0.5)℃,相对湿度60%~70%,12 h 昼夜节律。动物实验符合重庆医科大学实验动物伦理委员会制定的动物实验标准。
为明确白藜芦醇对大鼠脑膜炎损伤模型的最佳治疗剂量,按照随机数字表法,将大鼠随机分为假手术(sham)组,模型(BM)组,以及白藜芦醇低剂量(0.03 mg/kg)、中剂量(0.06 mg/kg)和高剂量(0.12 mg/kg)组;为确定最佳治疗剂量的白藜芦醇对大鼠脑膜炎模型神经功能、脑内炎症反应及miR-223-3p表达的影响,按照随机数字表法,将大鼠随机分为sham 组、BM 组和白藜芦醇治疗(BM+Res)组;为明确miR-223-3p 与核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)之间的相互作用,按照随机数字表法,将大鼠随机分为BM+Res+antagomir 对照(BM+Res+antagomir control)组和 BM+Res+miR-223-3p antagomir组。
2 主要仪器与试剂
脑立体定位仪(深圳瑞沃德生命技术有限公司);酶标仪(Thermo);荧光定量PCR 仪、蛋白电泳仪和凝胶成像系统(Bio-Rad);荧光显微镜(Olympus)。白藜芦醇(Sigma);miR-223-3p antagomir和antagomir阴性对照(RiboBio);兔抗NLRP3 多克隆抗体、鼠抗NeuN 单克隆抗体、兔抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体、兔抗离子钙结合衔接分子1(ionized calcium-binding adapter molecule 1,Iba1)单克隆抗体、兔抗IL-1β 多克隆抗体及兔抗IL-18 多克隆抗体(Abcam);兔抗cleaved caspase-1(CC-1)多克隆抗体(Novus Biologicals);兔抗β-actin单克隆抗体(武汉三鹰生物技术有限公司);RIPA 裂解液、蛋白酶抑制剂、BCA 蛋白浓度测定试剂盒、TUNEL 细胞凋亡检测试剂盒及HE染色试剂盒(碧云天生物技术有限公司);FITC 标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司);HRP AffiniPure goat anti-rabbit IgG(H+L)和HRP AffiniPure goat anti-mouse IgG(H+L)购自 EarthOx Life Science;RNAIso Plus 试剂、PrimeScriptTMRT reagent Kit 和 SYBR Green 试剂(TaKaRa);其他均为国产分析纯。
3 方法
3.1 细菌培养 GBS 由重庆市九龙坡医院检验科细菌培养室提供。将细菌接种到血琼脂糖培养基中培养16~24 h(37℃,5% CO2),生长至对数生长中期,用生理盐水清洗2 次,紫外分光光度仪检测菌液的浊度,稀释菌液至1×108CFU/L。
3.2 BM 模型的制备 用1%的戊巴比妥钠(10 mL/kg)对大鼠进行腹腔注射,将动物俯卧位固定于脑立体定位仪,采用微量注射器从小脑延髓池穿刺进针,回抽50 μL脑脊液舍去,模型组注入B族溶血性链球菌悬液50 μL,假手术组采用同样方法注入等量生理盐水[1]。
3.3 白藜芦醇给药 用1%的戊巴比妥钠(10 mL/kg)对大鼠进行腹腔注射,在接种B 族溶血性链球菌后1 h,采用移液枪将白藜芦醇(DMSO 溶液稀释,每只5 μL)缓慢滴加入双侧鼻腔中,5 min 之内滴注完毕[14]。
3.4 侧脑室注射 用1%的戊巴比妥钠(10 mL/kg)对大鼠进行深度麻醉,将其俯卧位固定于脑立体定位仪;备皮,消毒后沿颅脑中线作一个纵向切口,在前囟前方1.0 mm,右侧1.5 mm 处钻一个深度2.5 mm 的孔;在大鼠BM 模型建立前48 h,利用微量注射器将 miR-223-3p antagomir(1 nmol/L,无菌生理盐水稀释,每只5 μL)或antagomir 阴性对照(1 nmol/L,无菌生理盐水稀释,每只5 μL)缓慢注入同侧侧脑室中。5 min 之内注射完毕后,将针停留10 min 以防止泄露,而后将针缓慢取出。骨蜡封闭钻孔,缝合切口。
3.5 Loeffler 神经行为学评分 参照Loeffler 神经行为学评分方法[18],在细菌接种48 h 后进行神经功能评分。具体评分标准为:抓住背部时正常活动,在5 s 内翻身成功为5 分;自主活动减少,在5 s 能翻身为4 分;翻身可以成功,但时间超过5 s 为3 分;不能翻身为2分;不能运动为1分;死亡为0分。
3.6 脑组织处理及HE 染色 在术后48 h,每组随机取6 只大鼠,用1%戊巴比妥钠腹腔注射麻醉,经左心室快速灌注生理盐水后断头取脑,置于4%多聚甲醛溶液中固定24~48 h,梯度(10%、20%、30%)蔗糖脱水至沉底,OCT包埋,在冰冻切片机中行连续冠状切片(10 μm),-20℃保存待用。取各组切片进行HE常规染色。
3.7 免疫荧光检测 切片37 ℃复温1 h,用0.01 mol/L PBST 洗3 次,4%马血清37 ℃封闭1 h,滴加 I抗[NeuN(1∶200)、IL-1β(1∶200)、IL-18(1∶100)、GFAP(1∶200)和 Iba1(1∶100)]4 ℃孵育过夜。37 ℃复温1 h,PBST 洗 3 次,加入相应的荧光II 抗37 ℃避光孵育 1 h,PBST 洗 3 次,DAPI 孵育 5 min,PBST 洗 3次,抗荧光淬灭封片剂封片,荧光显微镜下观察拍照,并用Image Pro Plus 6.0 图像分析软件进行分析。若检测神经元凋亡则需在封片前进行TUNEL染色。
3.8 TUNEL 染色 将切片用 PBS 清洗 2 次,0.5%Triton X-100室温孵育5 min,加入50 μL TUNEL检测液(TdT 酶∶荧光标记液=1∶9)于37℃避光孵育60 min,PBS 洗3 次,用抗荧光淬灭封片剂封片后于荧光显微镜下观察,用ImageJ 图像分析软件进行定量统计分析。
3.9 Western blot 检测NLRP3、cleaved caspase-1、IL-1β 和IL-18 蛋白的水平 在术后48 h,每组随机取6只大鼠通过腹腔注射1%戊巴比妥钠后,左心室灌注生理盐水,迅速断头取脑,分离保留脑皮质,-80 ℃保存待用。用蛋白裂解液和蛋白酶抑制剂混合液于冰上充分匀浆,14 000 r/min 离心20 min 后收集上清液,使用BCA 法测定蛋白浓度。采用SDS-PAGE 分离蛋白,恒流电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,加入抗β-actin(1∶5 000)、NLRP3(1∶1 000)、caspase-1(1∶1 000)、IL-1β(1∶1 000)和IL-18(1∶1 000)等 I 抗 4℃孵育过夜。PBST 洗 3 次,加入相应II 抗(1∶10 000)于37℃孵育1 h,ECL 发光液进行显色,凝胶成像系统采集图像,使用Quantity One软件测量各条带灰度值,并将目标条带与内参照条带灰度值的比值做统计分析。
3.10 RT-qPCR检测脑组织中miR-223-3p的表达取冻存于-80℃的各组脑组织,根据Trizol 法,加入RNAiso Plus 后冰上充分匀浆,14 000 r/min 离心5 min收集上清液,依次加入氯仿和异丙醇后分别离心10 min,加入75%乙醇后保留沉淀干燥处理,溶于DEPC水中。根据PrimeScriptTMRT reagent Kit逆转录合成cDNA。取1 μL cDNA 进行RT-qPCR,按照说明书加入引物,序列见表1。反应条件为:95℃30 s;95℃10 s,60℃30 s,40个循环。检测每个反应管内的循环阈值(cycle threshold,Ct),利用标准曲线进行定量测定。
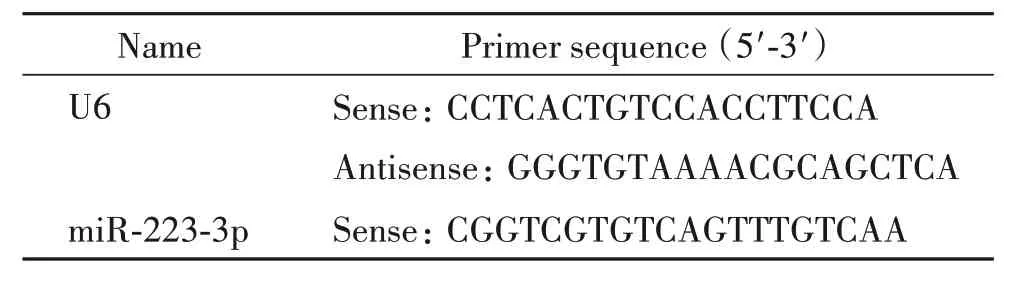
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
3.11 生物信息学查询 利用在线miRNA 预测软件 TargetScan(http://www.targetscan.org)查询 miR-223-3p与NLRP3 mRNA中互补的核苷酸序列。
4 统计学处理
采用SPSS 23.0 软件对所有数据进行统计学分析。数据结果以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 大鼠脑组织的病理改变
假手术组大鼠脑膜结构正常,脑内细胞排列规则,无血管充血及炎症细胞浸润;脑膜炎模型组大鼠脑膜增厚,脑内细胞排列紊乱,蛛网膜下腔扩张,充血明显并伴有少量炎症细胞浸润,见图1。
2 不同剂量白藜芦醇干预对大鼠皮质TUNEL阳性神经元数量的影响
与假手术对照组比较,脑膜炎模型组大鼠脑皮质内TUNEL 阳性神经元数量明显增加(P<0.05);与模型组相比,不同剂量白藜芦醇干预均可使大鼠脑皮质内TUNEL 阳性神经元明显减少(P<0.05);与0.03 mg/kg 和0.12 mg/kg 白藜芦醇治疗组相比,0.06 mg/kg 白藜芦醇治疗组大鼠脑皮质内TUNEL 阳性神经元减少最为明显,因此我们选择0.06 mg/kg白藜芦醇治疗组作为最佳剂量组行进一步的实验,见图2。
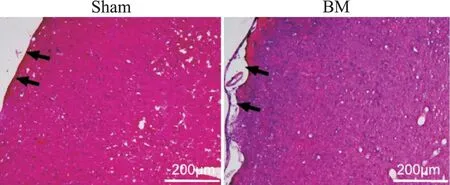
Figure 1.Representative images of HE staining in sham group and BM group.The black arrows indicate the meninges.图1 各组大鼠脑组织HE染色
3 白藜芦醇改善神经功能
与假手术对照组比较,脑膜炎模型组大鼠的Loeffler 神经功能评分显著降低(P<0.05);与脑膜炎模型组比较,白藜芦醇治疗组的Loeffler 神经功能评分明显增加(P<0.05),见图3。
4 白藜芦醇下调脑膜炎皮质组织中NLRP3、CC-1、IL-1β和IL-18的表达
免疫荧光结果显示,在脑膜炎模型组中,大鼠脑皮质中IL-1β 和IL-18 分别与神经元标志物NeuN 共表达,见图4A、B。与假手术对照组比较,脑膜炎模型组大鼠脑皮质内IL-1β 和IL-18荧光强度显著增强(P<0.05);与脑膜炎模型组相比,白藜芦醇治疗组大鼠脑皮质内IL-1β 和IL-18 荧光强度显著减弱(P<0.05),见图4C、D。
Western blot结果显示,与假手术对照组相比,脑膜炎模型组脑皮质内NLRP3、CC-1、IL-1β 和IL-18 蛋白的相对表达量明显增高(P<0.05);与脑膜炎模型组相比,白藜芦醇治疗组 NLRP3、CC-1、IL-1β 和IL-18蛋白的相对表达量明显减少(P<0.05),见图4E。
5 白藜芦醇减轻脑膜炎模型脑内星形胶质细胞和小胶质细胞的炎症反应
假手术对照组表达GFAP 的星形胶质细胞数量较少,分布稀疏,胞体小,突起细而少,表达Iba1的小胶质细胞胞体较小,突起多而细,且表达较少,提示星形胶质细胞和小胶质细胞未被激活。与假手术对照组比较,脑膜炎模型组大鼠脑皮质内表达GFAP的星形胶质细胞明显增加,胞体显著增大,突起增长、增粗和增多,表达Iba1的小胶质细胞胞体变大,突起回缩变粗,且表达增多,提示星形胶质细胞和小胶质细胞被激活;与脑膜炎模型组相比,白藜芦醇治疗组大鼠脑皮质内表达GFAP 的星形胶质细胞数量明显减少,胞体减小,突起减少变细,表达Iba1 的小胶质细胞胞体减小,突起增多、变细,且表达减少,提示星形胶质细胞和小胶质细胞炎症反应被抑制,见图5A、B。
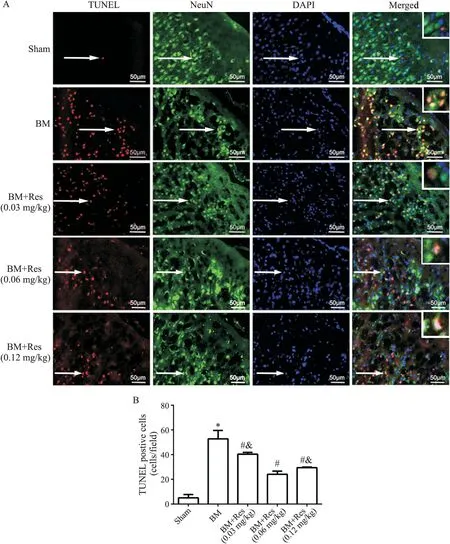
Figure 2.The results of TUNEL staining and NeuN immunofluorescence staining in the brain tissues of the rats in each group.A:the representative images of TUNEL staining and NeuN immunofluorescence staining(the images in the white boxs were the magnifications of the areas indicated by the arrows);B:the statistical analysis of TUNEL positive neurons in each group.Mean±SD. n=6.*P<0.05 vs sham group;#P<0.05 vs BM group;&P<0.05 vs BM+Res(0.06 mg/kg)group.图2 各组大鼠脑内TUNEL染色及NeuN免疫荧光染色情况的比较
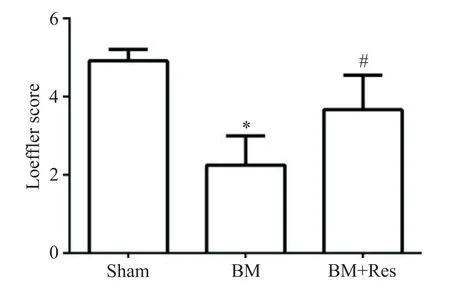
Figure 3.The Loeffler neurological score in each group of the rats.Mean±SD.n=12.*P<0.05 vs sham group;#P<0.05 vs BM group.图3 各组大鼠Loeffler神经功能评分的比较
6 白藜芦醇上调脑膜炎模型大鼠皮质组织中miR-223-3p的表达
与假手术对照组相比,脑膜炎模型组大鼠脑皮质内miR-223-3p 的相对表达量明显增高(P<0.05);与脑膜炎模型组相比,白藜芦醇治疗组大鼠脑皮质内miR-223-3p 相对表达量明显进一步增高(P<0.05),见图5C。
7 抑制miR-223-3p 减少白藜芦醇治疗的脑膜炎大鼠皮质组织中NLRP3蛋白的表达
利用在线microRNA(miRNA)预测软件TargetScan 查询发现miR-223-3p 的部分核苷酸序列与NLRP3 mRNA 3’-URT 的核苷酸序列互补,见图6A。通过侧脑室注射miR-223-3p antagomir,再用Western blot 检测NLRP3 的蛋白表达变化,结果显示,与antagomir 对 照 组相比,miR-223-3p antagomir 处 理 组NLRP3 蛋白的相对表达量明显增加(P<0.05),见图6B。
讨 论
炎症反应是组织受到病原体感染、缺血缺氧和外伤等刺激后发生的病理生理反应。一般情况下,炎症反应是机体免疫系统对外界刺激和损伤的正常应答,发挥清除有害物质和促进组织修复再生的功能;但过度的炎症反应则对机体细胞造成严重损伤[19]。Li 等[20]的研究结果显示,在鲍氏不动杆菌感染引起的细菌性脑膜炎的发生过程中,炎症小体(inflammasome)活化诱导的神经细胞焦亡即是神经细胞损伤的形式之一。炎症小体是一种细胞内调控活性炎症因子产生的多蛋白复合体,主要由受体蛋白、衔接蛋白和胱天蛋白酶1前体(pro-caspase-1)三部分共同组成[21]。核苷酸结合寡聚化结构域(nucleotidebinding oligomerization domain,NOD)样受体(NOD-like receptors,NLRs)蛋白家族是受体蛋白中的一类,包括 NLRP1、NLRP2、NLRP3、NLRP6、NLRP7、NLRP12、NLRC4 和 NLRC5 等[22],其中 NLRP3 炎症小体被研究得最为深入、广泛,它通过NLRP3识别感染和氧化应激等刺激,招募和激活蛋白水解酶caspase-1,进而剪切 IL-1β 和 IL-18 的前体(pro-IL-1β 和 pro-IL-18),产生相应的炎症因子,启动细胞的炎性死亡,即为焦亡[23-24]。本研究的 Western blot 结果显示,在GBS 感染引起的大鼠脑膜炎模型中,NLRP3、cleaved caspase-1、IL-1β 和 IL-18 的表达均较假手术对照组增高;免疫荧光结果显示,IL-1β 和IL-18 在BM 模型组神经元中的荧光强度增加,星形胶质细胞和小胶质细胞被激活。这些结果表明大鼠脑膜炎模型中存在由NLRP3炎症小体介导的神经细胞炎性死亡(即焦亡)发生,与前人的结果一致。
近年来发现白藜芦醇有抗炎作用,大量文献表明白藜芦醇可通过 PI3K/Akt[7]、Src 激酶[25]和 TRAF6/NF-κB[26]等多种信号途径在骨关节炎[7]、肺损伤[26]和脊髓损伤[26]等疾病中发挥对抗过敏反应和过度炎症反应的作用。关于白藜芦醇用于脑膜炎治疗的研究主要集中于它对海马区的抗炎和神经元保护作用[13-14]。本研究中我们发现白藜芦醇治疗后,动物的神经行为学评分明显提升,脑皮质区炎症因子IL-1β和IL-18 的释放和细胞凋亡数目明显减少,星形胶质细胞和小胶质细胞炎症反应被抑制,表明在脑膜炎的抗感染治疗中,白藜芦醇可作为一个潜在有效的辅助治疗药物。另外,我们还发现白藜芦醇可同时下调脑膜炎模型中脑皮质区NLRP3 和CC-1 的蛋白水平,表明白藜芦醇可通过调节NLRP3 炎症小体的活性在脑皮质区发挥抗神经细胞焦亡的作用。
在脑缺血和帕金森病等多种神经系统疾病中,白藜芦醇可通过调控miRNAs 的表达发挥神经保护作用[17,28]。miR-223 是一种存在于斑马鱼、小鼠、家禽、人类等多种物种中的高度保守的miRNA。在哺乳动物中,miR-223 广泛表达于血液、肝脏、心脏、肺、脑等各种组织中,参与调节体内脂质代谢、血细胞增殖、抑制成骨细胞分化等作用[28-29]。白藜芦醇对miR-223的调控作用尚未见报道。在本实验中,我们在幼年大鼠脑膜炎模型发现脑皮质中miRNA-223-3p水平较对照组显著升高,白藜芦醇治疗后miRNA-223-3p 进一步升高,可见白藜芦醇在细菌性脑膜炎模型中可发挥调节miRNA-223-3p 表达水平的作用。另外,我们运用在线软件TargetScan 查询发现mi-RNA-223-3p 与NLRP3 mRNA 3'端部分核苷酸序列互补结合;实验进一步证实,在白藜芦醇治疗的细菌性脑膜炎动物模型中,抑制miR-223-3p 可使NLRP3蛋白的相对表达量明显增加。由此我们认为白藜芦醇可通过上调miRNA-223-3p 的表达发挥抑制NLRP3 炎症小体的功能,进一步抑制下游的caspase-1激活和炎症因子IL-1β 和IL-18 剪切活化,从而达到抑制神经元焦亡和凋亡的作用。
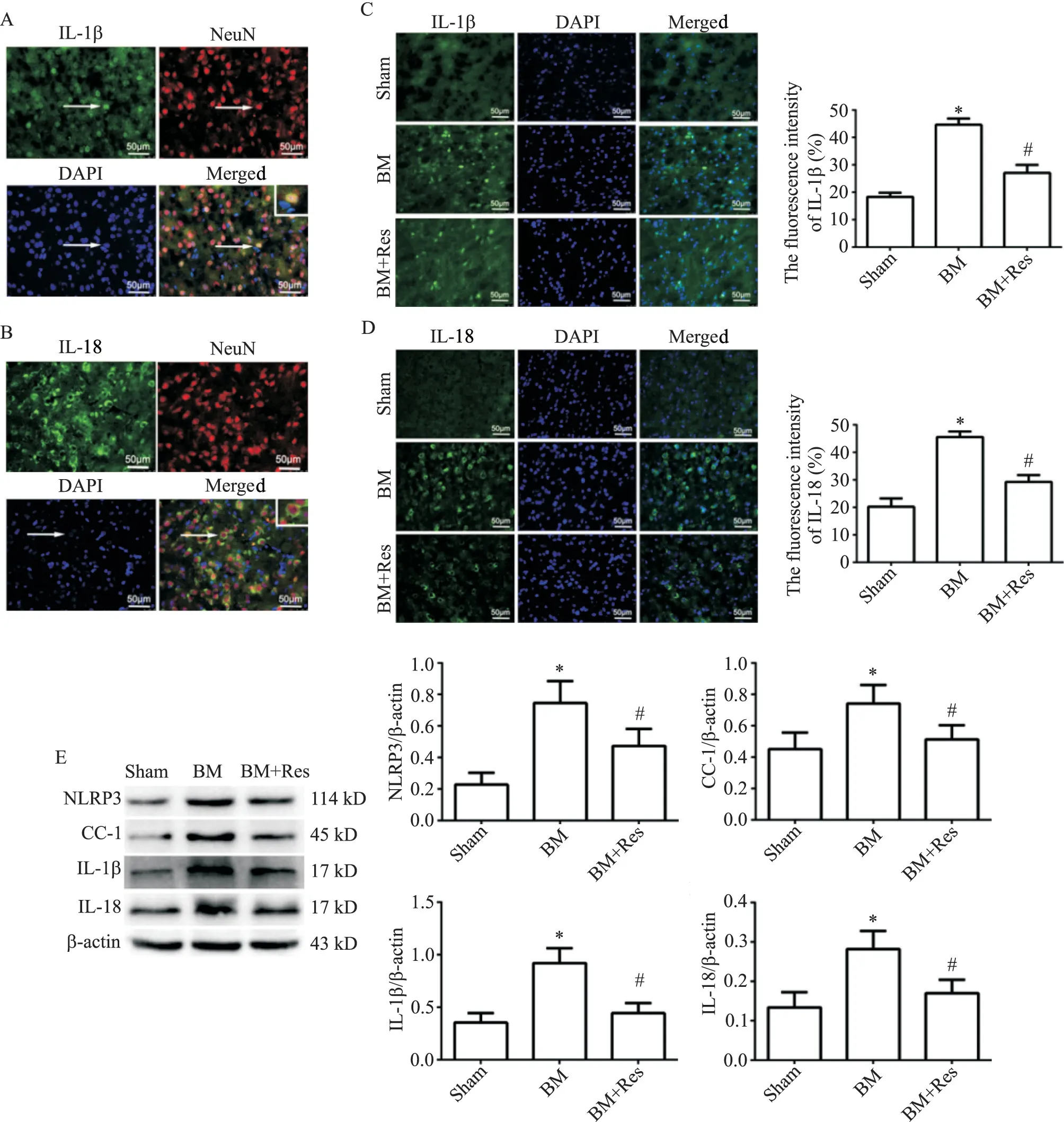
Figure 4.The expression levels of NLRP3,CC-1,IL-1β and IL-18 in rat brain tissues of each group.A,B:both IL-1β and IL-18 were co-expressed with NeuN in the brain of BM group,respectively(the images in the white boxs were the magnifications of the areas indicated by the arrows);C,D:the expression of IL-1β and IL-18 detected by immunofluorescence staining in the brain of each group;E:Western blot for determining the protein levels of NLRP3,CC-1,IL-1β and IL-18 in the brain of each group.Mean±SD.n=6.*P<0.05 vs sham group;#P<0.05 vs BM group.图4 各组大鼠脑内NLRP3、CC-1、IL-1β和IL-18表达水平的比较
总之,本研究发现在GBS 感染引起的细菌性脑膜炎模型中神经元发生焦亡和凋亡;白藜芦醇可能通过调控miRNA-223/NLRP3 通路减轻神经元焦亡和凋亡的发生,从而发挥神经保护作用。
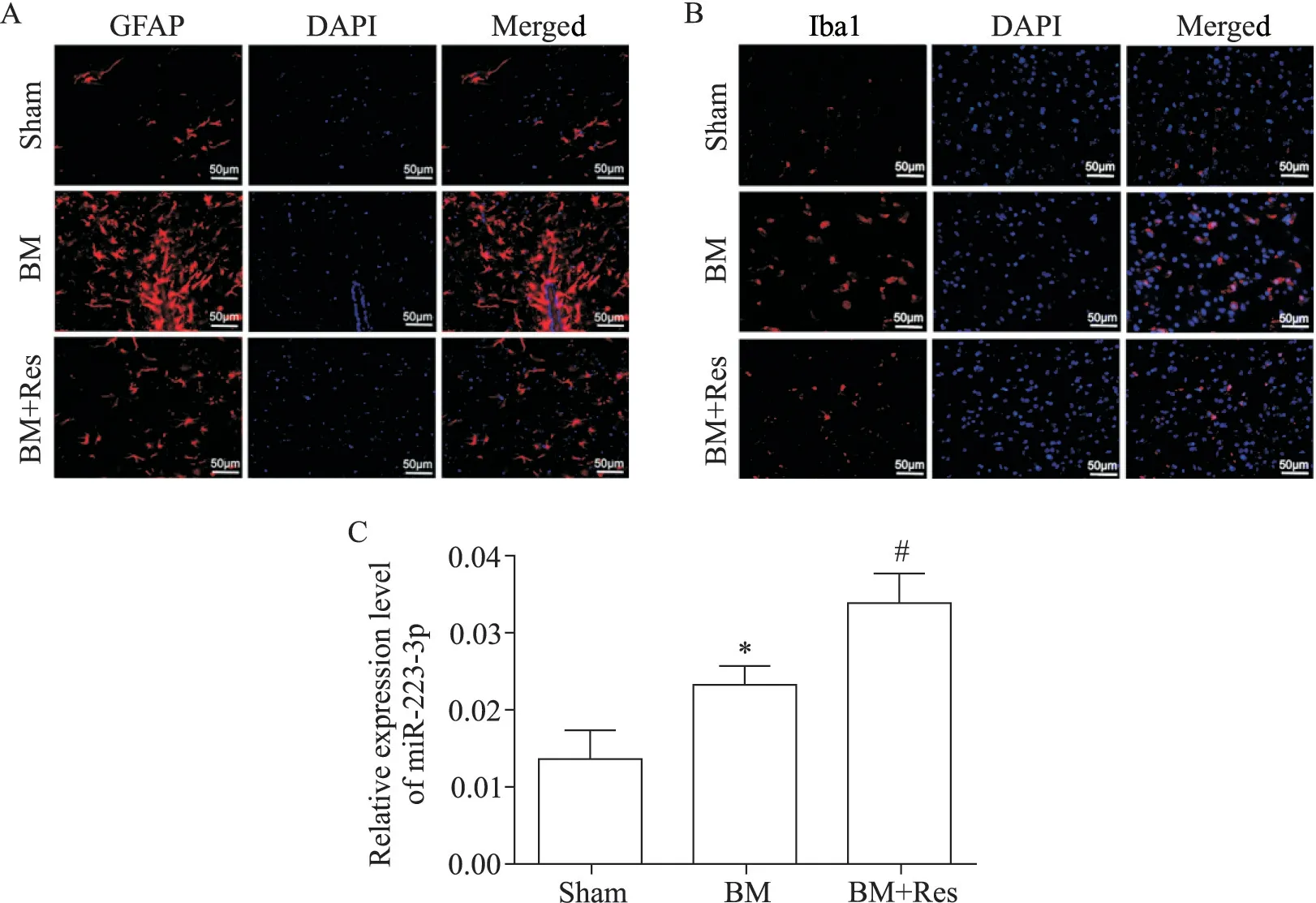
Figure 5.The expression of GFAP and Iba1 was detected by immunofluorescence staining and the expression level of miR-223-3p was detected by RT-qPCR in the rat brain tissues of each group.A,B:the representative images of GFAP and Iba1 expression detected by immunofluorescence staining(scale bar=50 μm);C:the expression of miR-223-3p.Mean±SD.n=6.*P<0.05 vs sham group;#P<0.05 vs BM group.图5 各组大鼠脑内GFAP和Iba1免疫荧光染色情况及miR-223-3p表达水平的比较

