大鼠DRG内ClC-3敲减导致的TNF-α/IL-10失衡对电压门控性钠通道表达和机械痛敏的影响*
汪小芳, 何苏月, 马卓琳, 杨 杰, 庞瑞萍△
(1中山大学中山医学院生理学教研室,中山大学疼痛研究中心,广东广州510080;2暨南大学基础医学院生理学系,广东广州510632)
神经病理性疼痛(neuropathic pain)是由神经系统原发性损害或功能障碍引起的疼痛,以触诱发痛、痛觉过敏及自发性疼痛为特征。外周感觉传入神经元兴奋性异常增强导致的外周敏感化是神经病理性疼痛的重要发病机制[1-2]。但外周敏感化的分子机制目前尚不完全清楚。
ClC-3 是电压门控性氯通道ClC 家族中的一员,当它表达在细胞膜上时可作为离子通道,表达在溶酶体膜上时可作为Cl-/H+反向转运体[3-6],在调控细胞兴奋性、跨上皮离子转运、细胞容积和胞内细胞器的酸化中具有重要作用[7-8]。我们前期的研究显示,ClC-3 在大鼠背根神经节(dorsal root ganglion,DRG)神经元中高表达,当外周神经损伤后,DRG 神经元的ClC-3 表达显著下调,敲除小鼠ClC-3可引起DRG神经元兴奋性异常增高,动物出现机械痛敏(mechanical allodynia),恢复ClC-3 表达可逆转机械痛敏[9]。上述结果表明,ClC-3参与调控DRG神经元的兴奋性,从而参与神经病理性疼痛的发生,但ClC-3调控DRG神经元兴奋性的具体机制尚不明确。
神经元上的电压门控性钠通道(voltage-gated sodium channels,VGSC)是决定神经元兴奋性的重要因素。迄今发现的VGSC 至少有10 种(Nav1.1~Nav 1.9和Nax),其中至少8个亚型分布于DRG。Nav1.3主要表达于胚胎期DRG,但在受损的DRG 可出现高表达;Nav1.7、Nav1.8 和 Nav1.9 表达于外周初级感觉传入神经元[10]。根据细胞分布不同,各种Nav 通道的功能也不尽相同:Nav1.1和Nav1.3主要分布于树突,通过突触后电位整合控制神经元兴奋阈值;Nav1.7主要与感觉神经元外周末梢初始动作电位的生成有关;Nav1.8 主要参与动作电位的生电作用;Nav1.9则可能与静息电位调节有关[11]。
大量研究表明,外周神经损伤可上调致炎细胞因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)表达,而上调的TNF-α可增加DRG神经元Nav1.3、Nav1.7和Nav1.8表达[12-14],抗炎细胞因子白细胞介素10(interleukin-10,IL-10)可逆转TNF-α 的作用[15]。以上研究表明,DRG 局部细胞因子的失衡可直接调控神经元钠通道的表达,从而导致DRG 神经元兴奋性异常增高,产生自发放电和异位放电,导致神经病理性疼痛的发生[16]。
在本研究中,我们发现鞘内注射ClC-3shRNA腺相关病毒(adeno-associated virus carryingClC-3shRNA,AAV-ClC-3shRNA)可明显降低 ClC-3 的mRNA 和蛋白表达,大鼠出现机械痛敏;免疫荧光及Western blot 结果表明DRG 组织中致炎细胞因子TNF-α 的表达增加,抗炎细胞因子IL-10 的表达降低,DRG 组织 Nav1.3、Nav1.7、Nav1.8 和 Nav1.9 的表达上调,提示细胞因子的失衡可能是ClC-3下调导致VGSC表达增加进而触发机械痛敏的重要机制。
材 料 和 方 法
1 实验动物
SPF 级雄性 Sprague-Dawley(SD)大鼠,4~5 周龄,体质量100~120 g,由中山大学动物实验中心提供,许可证号为SCXK(粤)2016-0029。
2 主要试剂
AAV-ClC-3shRNA 和 AAV-scrambled shRNA 购自上海吉凯基因化学技术有限公司;兔抗大鼠ClC-3(ACL-001)、Nav1.3(ASC-004)、Nav1.7(ASC-008)和Nav1.9(ASC-017)多克隆抗体均购自Alomone Labs;兔抗大鼠Nav1.8(ab63331)和IL-10(ab9969)多克隆抗体、辣根过氧化物酶标记的羊抗兔II 抗及RT-qPCR 试剂盒购自 Abcam;兔抗 TNF-α 多克隆抗体(BS1857)购自Bioworld;由捷瑞公司设计并合成引物;其余生化试剂均为进口分装或国产。
3 主要方法
3.1 AAV 介导 shRNA 的构建 用 AAV9 载体构建ClC-3shRNA 和scrambled shRNA,其元件顺序为U6-MCS-CAG-eGFP(增强型绿色荧光蛋白)。ClC-3shRNA 的序列为 5'-CACAGACGGATCAACAGTAAA-3';scrambled shRNA 的序列为5'-CGCTGAGTACTTCGAAATGTC-3'。
3.2 建立敲减ClC-3表达的大鼠模型与实验分组实验前对大鼠进行痛行为学检测,痛阈正常者纳入实验,具体实验设计见图1A。参照文献[15],对大鼠进行鞘内置管术,异氟烷吸入麻醉后,将大鼠俯卧位固定于手术台上,腰部剃毛消毒,选择第4、5 腰椎间隙作为手术部位,逐层剪开皮肤,充分暴露间隙位置,用1 mL 无菌注射器的针头刺破筋膜和韧带,见脑脊液流出,将提前准备好的无菌聚乙烯管轻柔置入。取肢体无运动障碍的大鼠,从导管内注射2%利多卡因7 μL,立即(15 s 内)出现双后肢瘫痪并持续20~30 min 的动物纳入实验。实验动物随机分为AAV-ClC-3shRNA 组、AAV-scrambled shRNA 组和溶剂对照组,每组24 只,从管内分别注射10 μL 阳性病毒、阴性病毒或溶剂+10 μL生理盐水。
3.3 疼痛行为学的检测 采用von Frey hair 检测不同处理组不同时点大鼠双后爪撤足阈值(paw withdrawal threshold,PWT)的变化。检测前将大鼠放置在动物专用测试室内适应环境20~30 min,使用up-down 方法选用8 根强度呈对数递增的von Frey hair检测大鼠50%的PWT。强度由小到大,测试时hair垂直放置于大鼠足底,微弯,在大鼠足心部保持8~9 s,出现快速撤足为阳性反应,若反应缺失则选择下一个更强的刺激,直至最大值。
3.4 免疫荧光观察 各组大鼠腹腔注射20%乌拉坦(8 mL/kg)麻醉后,开胸暴露心脏,经左心室插管进入升主动脉,灌注4℃生理盐水500 mL 冲净血液,再用4%多聚甲醛固定液(pH 7.4)灌注500 mL。取双侧L4~6 节段的DRG,放入4%多聚甲醛后固定1 h,转入30%蔗糖脱水7 d。进行冠状冰冻切片,DRG切片厚 16 μm。PBS 洗 3 遍,室温下封闭 1 h,加入 I抗4℃轻摇孵育过夜。次日复温至室温后,PBS 洗3遍。加入兔抗Cy3 标记的 II 抗(1∶400;Jackson Immuno Research),室温下避光孵育 1 h,PBS 洗 3 次。贴片封片后,使用荧光显微镜(Olympus IX71)观察及拍照,利用ImageJ 对各组中图片的免疫荧光强度进行半定量分析。
3.5 Western blot 实验 各组动物腹腔注射20%乌拉坦(8 mL/kg)麻醉后,于冰上取双侧L4~6 DRG 放入液氮中冷冻,加入SDS 裂解液(10 μL/mg)和蛋白磷酸酶抑制剂匀浆并超声破碎再低温离心后取上清液-80℃保存待用,上清SDS-PAGE进行分离,后蛋白湿转入PVDF 膜上。经1%BSA 室温封闭1 h,然后再在4℃环境下与I 抗一起轻摇孵育过夜。第2 天取出在室温复温1 h,用TBST 洗4 遍,与对应的辣根过氧化物酶标记的 II 抗(1∶10 000;Abcam)孵育1 h 后,TBST洗4遍,ECL显色曝光,再经CCD摄像头拍摄显影条带,使用Image-Pro Plus 软件对图像进行灰度分析。对每个目的条带进行总灰度值的分析,并用βactin的总灰度值进行标准化。
3.6 RT-qPCR 实验 各组大鼠腹腔注射20%乌拉坦(8 mL/kg)麻醉,取双侧DRG 分别放置不同RNasefree 的 EP 管中,每管内加入 500 μL TRIzol 轻柔吹打约20 次,用事先DEPC 处理且高压灭菌过的研磨棒将组织研磨碎,加入100 μL 氯仿用力摇1 min,静置3 min后于4℃、12 000 r/min 离心15 min,吸出200 μL上清转移到新RNase-free EP 管中,加入200 μL异丙醇,上下轻摇30 次左右,静置10 min 后于4℃、12 000 r/min 离心 10 min,弃上清,加入 1 mL DEPC水配制的75%乙醇溶液,4℃、7 500 r/min 离心5 min,将液体吸干,待残余液体挥发后,加入适量DEPC 水溶解RNA 沉淀,使用超微量分光光度计(NanoDrop 2000)测定RNA 浓度和质量,A260/A280比值在1.8~2.0之间的样品方可进行后续步骤。将RNA 浓度调至统一后,使用PrimeScript RT Master Mix 试剂盒和S1000™ PCR 仪(Bio-Rad)将RNA 逆转录为cDNA,使用 TB Green Premix Ex Taq 试剂盒和 CFX96 Touch 实时荧光定量PCR 系统(Bio-Rad)测定ClC-3 的mRNA表达。ClC-3和内参照β-actin的引物序列见表1。采用 2-ΔΔCt法计算,先将各组 ClC-3 mRNA 与 β-actin mRNA 相比,再以空白对照组为1 进行标准化,其他各组ClC-3 mRNA 表达量是与对照组相比的相对值。
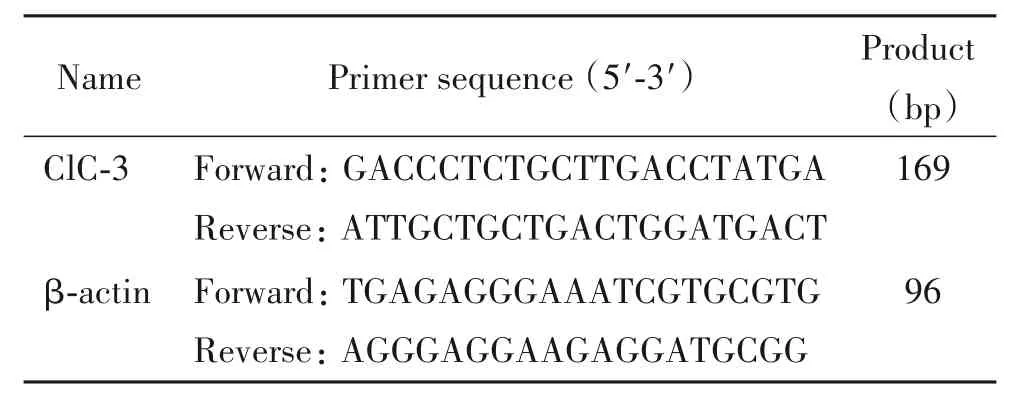
表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
4 统计学处理
通过SPSS 10.0软件进行统计学分析,实验结果以均数±标准误(mean±SEM)表示。行为学数据组间比较用两因素重复测量方差分析(two-way repeated measures ANOVA),其它数据组间比较用单因素方差分析(one-way ANOVA)继以 Tukey 检验。以P<0.05为差异有统计学意义。
结 果
1 鞘内注射AAV-ClC-3 shRNA 降低DRG 中ClC-3 mRNA和蛋白表达水平
AAV 转染28 d 后取DRG 组织切片,荧光显微镜观察到病毒转染组神经元细胞出现明显绿色荧光(eGFP 表达),表明转染效率较高,且荧光强度在两组间无显著差异,见图1B。RT-qPCR、免疫荧光染色及Western blot 结果表明,与溶剂组相比,AAV-ClC-3shRNA组ClC-3的mRNA和蛋白表达均显著降低(P<0.01),而 scrambled shRNA 组无明显变化,见图1C~E。
2 大鼠鞘内注射AAV-ClC-3 shRNA 诱导双侧机械触诱发痛
大鼠基础(baseline,BL)机械撤足阈值测量后,鞘内注射 AAV-ClC-3shRNA、scrambled shRNA 或溶剂,14 d 后AAV-ClC-3shRNA 组双侧后爪机械撤足阈值下降,至21 d 接近谷底,并持续至少2 周以上,见图2。
3 敲减ClC-3 表达上调DRG 神经元VGSC 亚型Nav1.3、Nav1.7、Nav1.8和Nav1.9的表达
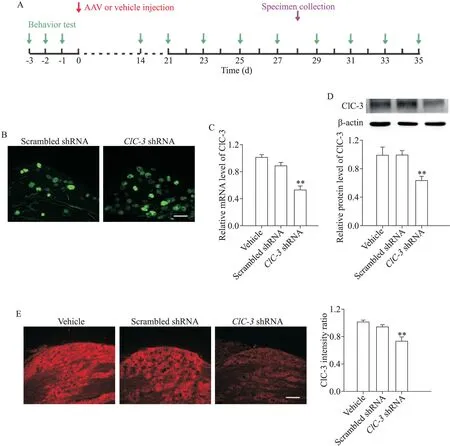
Figure 1.The mRNA and protein levels of ClC-3 in rat DRG tissues after intrathecal injection of AAV-ClC-3 shRNA.A:experiment design was showed;B:green fluorescence in L5 DRG was observed on day 28 after AAV-scrambled shRNA-eGFP or AAVClC-3 shRNA-eGFP injection;C,D:the mRNA and protein levels of ClC-3 in the DRG tissues were decreased in ClC-3 shRNA group but not in scrambled shRNA group;E:ClC-3 fluorescence signaling in DRG neurons treated with ClC-3 shRNA,scrambled shRNA and vehicle.Scale bar=50 μm.Mean±SEM. n=6.**P<0.01 vs vehicle group.图1 鞘内注射AAV-ClC-3 shRNA可减少DRG组织中ClC-3的mRNA和蛋白表达
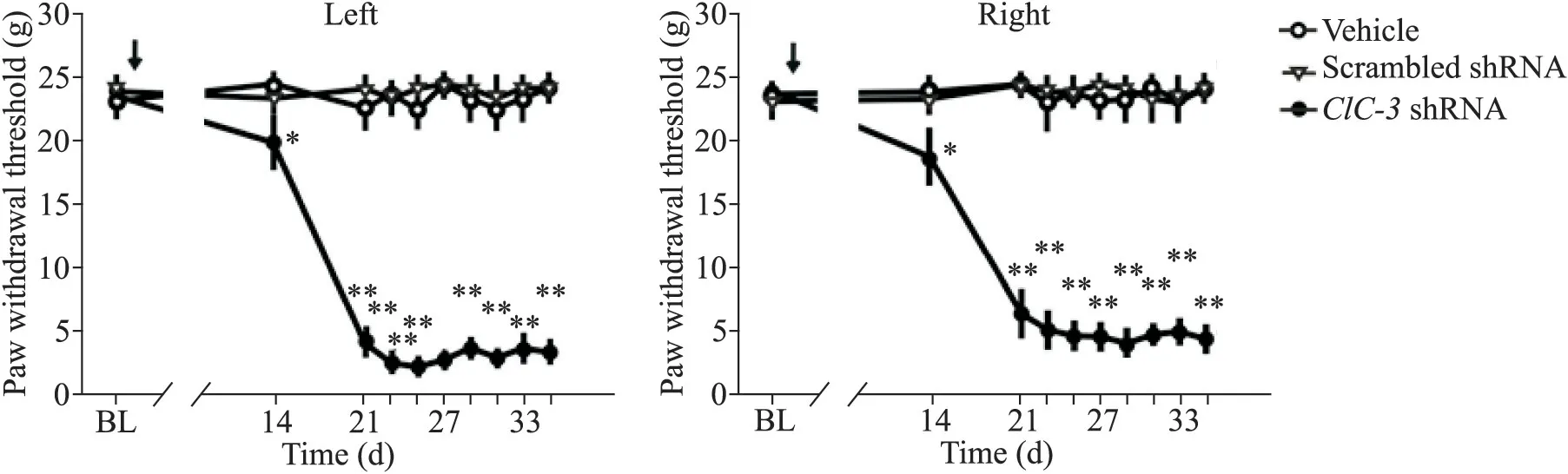
Figure 2.Intrathecal injection of AAV-ClC-3 shRNA induced mechanical allodynia in the rats.The changes of bilateral paw withdrawal thresholds in the rats treated with ClC-3 shRNA,scrambled shRNA and vehicle were showed.BL:baseline.The arrows indicate the intrathecal injection time.Mean±SEM. n=6.*P<0.05,**P<0.01 vs vehicle group.图2 鞘内注射AAV-ClC-3 shRNA可诱导大鼠出现机械痛敏
鞘内注射AAV 病毒后28 d 取DRG 组织,做免疫荧光染色及Western blot 检测,结果表明AAV-ClC-3shRNA 组 VGSC 亚 型 Nav1.3、Nav1.7、Nav1.8 和Nav1.9 表达较溶剂组显著增加(P<0.01),而scrambled shRNA组的变化不明显,见图3、4。
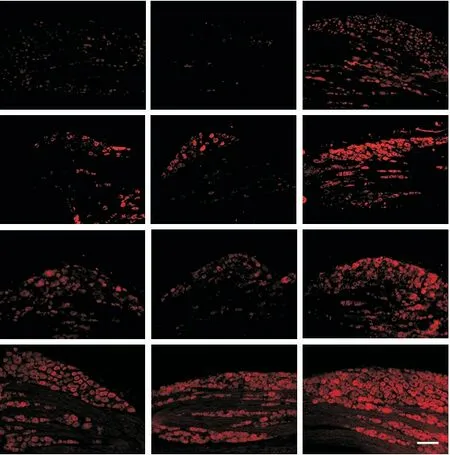
Figure 3.Nav1.3,Nav1.7,Nav1.8 and Nav1.9 were up-regulated in the DRG tissues after knockdown of ClC-3 expression(immunofluorescence staining,scale bar=50 μm).Mean±SEM. n=6.*P<0.05,**P<0.01 vs vehicle group.图3 敲减DRG组织ClC-3表达可增加Nav1.3、Nav1.7、Nav1.8和Nav1.9的表达
4 敲减 ClC-3 的表达增加 DRG 神经元 TNF-α 表达,减少IL-10表达
鞘内注射AAV 后28 d 取DRG 组织,免疫荧光染色及Western blot 结果表明,AAV-ClC-3shRNA 组的致炎细胞因子TNF-α 表达明显增加,而抗炎细胞因子IL-10 表达明显减少(P<0.01),这2 种细胞因子在scrambled shRNA 组的变化均不显著,见图5。
讨 论
我们前期的研究发现,外周神经损伤(保留性神经损伤,spared nerve injury,SNI)大鼠DRG 的ClC-3表达下调,且这种下调与机械痛阈值降低正相关,因此我们猜测ClC-3 表达下调可能是导致神经病理性疼痛的重要机制。进一步研究发现,敲除小鼠ClC-3可使DRG 神经元动作电位阈值降低,重复放电频率增加,兴奋性异常增高,动物出现明显的机械触诱发痛;恢复神经损伤模型大鼠DRG 神经元ClC-3 表达可显著减轻触诱发痛,表明ClC-3通过调控外周感觉神经元的兴奋性参与神经病理性疼痛的发生[9]。但ClC-3 调控背根神经节神经元兴奋性的机制尚不清楚。
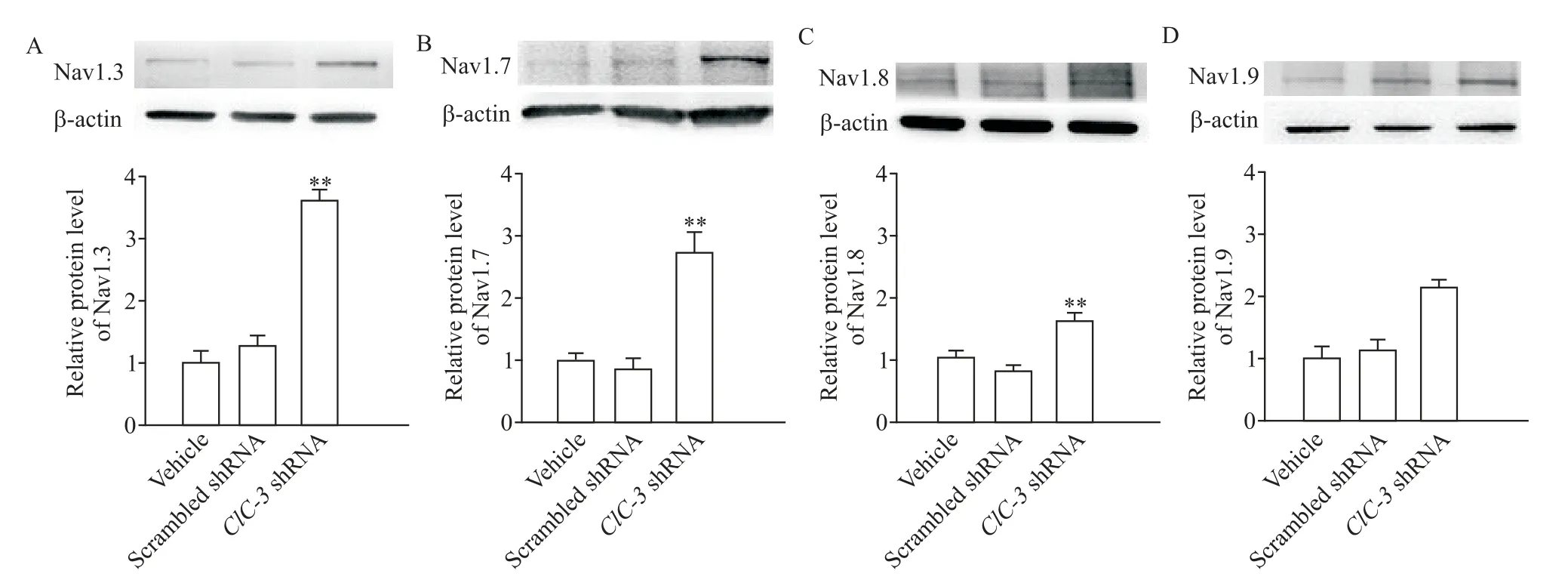
Figure 4.The protein levels of Nav1.3(A),Nav1.7(B),Nav1.8(C)and Nav1.9(D)in the DRG tissues after knockdown of ClC-3 expression were determined by Western blot.Mean±SEM. n=6.**P<0.01 vs vehicle group.图4 敲减DRG组织ClC-3表达可提高Nav1.3、Nav1.7、Nav1.8和Nav1.9蛋白的表达水平
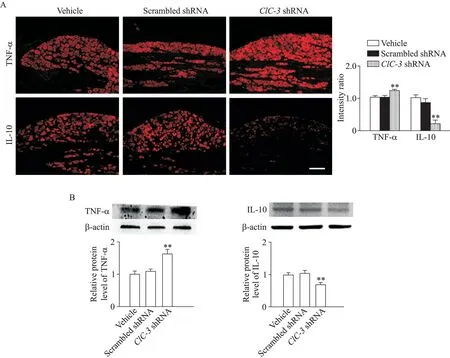
Figure 5.TNF-α was up-regulated while IL-10 was down-regulated in the DRG tissues after knockdown of ClC-3 expression.A:immunofluorescence staining for TNF-α and IL-10 in the DRG tissues treated with ClC-3 shRNA,scrambled shRNA and vehicle(scale bar=50 μm);B:the results of Western blot for determining the protein levels of TNF-α and IL-10 in the DRG tissues treated with ClC-3 shRNA,scrambled shRNA and vehicle.Mean±SEM. n=6.**P<0.01 vs vehicle group.图5 敲减DRG组织ClC-3表达可提高TNF-α、降低IL-10的蛋白表达水平
虽然我们前期采用ClC-3全身性敲除发现ClC-3是调控神经病理性疼痛发生的关键分子,但全身性敲除ClC-3影响范围广泛,作用机制复杂。为揭示ClC-3下调导致机械痛敏的DRG机制,本研究采用鞘内注射AAV-ClC-3shRNA 的方法,特异性敲减DRG组织ClC-3的表达,再进行相关实验。结果表明DRG组织ClC-3 下调的大鼠在基础状态下即出现明显的机械触诱发痛,并持续至少2 周以上,说明DRG 的ClC-3 下调即可导致神经组织兴奋性增加,进而导致外周敏感化,引起机械痛敏。
外周神经损伤时,初级感觉传入特别是未受损DRG 神经元的兴奋性增高引起的异位放电是触诱发痛的重要原因[12,17]。决定神经元兴奋性最重要的因素是神经元上VGSC 的激活。在已经发现的VGSC中,Nav1.3、Nav1.7、Nav1.8 和 Nav1.9 被认为是与痛信号最相关的因素[18],这几种VGSC亚型以不同的方式调控DRG 神经元电生理特性[19]。在轴突切断或其他形式的神经损伤后,原本主要表达于中枢神经系统的 Nav1.3 可以在 DRG 中高表达[20]。对慢性缩窄性损伤(chronic constriction injury,CCI)大鼠鞘内注射Nav1.3 反义寡核苷酸可显著降低脊髓背角神经元的高兴奋性,减轻痛相关行为[21]。许多研究表明,Nav1.7与痛觉异常密切相关,其功能缺失性突变可导致先天性痛觉缺失,功能获得性突变则导致DRG 神经元兴奋性异常增高,出现红斑性肢痛症等[22-23]。Nav1.8 主要表达于 DRG 小神经元,参与动作电位超射和重复发放。神经损伤时在未受损神经元Nav1.8 表达上调[12-13],参与神经元高兴奋性的形成。小分子干扰RNA 敲减Nav1.8可以逆转CCI 大鼠的机械触诱发痛[24],选择性Nav1.8 阻断剂可抑制多种痛行为[25-26]。Nav1.9 多表达于 DRG 小神经元,可能参与静息电位的形成,一般认为在炎性痛中具有重要作用[27]。由于多种亚型钠通道均参与了神经病理性疼痛的形成,因此针对某一种钠通道的抑制剂的防治效果有限。本研究中,我们发现敲减ClC-3明 显 上 调 VGSC 亚 型 Nav1.3、Nav1.7、Nav1.8 和Nav1.9 的蛋白表达,提示ClC-3 是调控多种VGSC 亚型表达的共同上游调控分子,可能成为防治神经病理性疼痛的重要靶点。
尽管我们的研究结果显示敲减ClC-3表达可增加Nav1.3、Nav1.7、Nav1.8和Nav1.9的表达,但ClC-3 调控上述VGSC 表达的机制还不清楚。已有研究表明,在外周神经损伤时,DRG 局部致炎细胞因子增加、抗炎细胞因子减少可使多种VGSC亚型的表达增加,DRG 神经元兴奋性增高,导致外周传入信号异常增多,是引起触诱发痛的重要机制[12-15]。为明确DRG 局部炎症微环境是否是ClC-3 下调导致各种VGSC 亚型表达增加的原因,我们进一步分析了敲减ClC-3表达对致炎细胞因子TNF-α 和抗炎细胞因子IL-10 表达的影响,结果发现敲减DRG 组织ClC-3表达可以明显增加TNF-α 表达,但减少IL-10 表达,表明促炎和抗炎细胞因子的失衡是DRG 组织ClC-3 下调促进不同亚型VGSC表达增加的重要机制。
综上所述,DRG组织ClC-3表达下调是导致神经病理性疼痛的关键机制。ClC-3 表达下调通过促进致炎细胞因子表达、降低抗炎细胞因子表达而上调Nav1.3、Nav1.7、Nav1.8 和Nav1.9 的表达,增强神经元兴奋性,最终引起机械痛敏。这些结果提示维持ClC-3表达水平是防治神经病理性疼痛的重要策略。

