黄芩苷在胶原蛋白诱发性关节炎小鼠中抑制BLyS介导的Th17细胞分化和炎症反应*
蔡志波, 林 艳, 陈英虎
(浙江大学医学院附属儿童医院/国家儿童健康与疾病临床医学研究中心 1药剂科,2感染科,浙江杭州310052)
类风湿关节炎(rheumatoid arthritis,RA)不仅是一种以慢性破坏性关节病变为特征的自身免疫性疾病[1],也是世界范围内导致人们残疾的主要病因[2],同时还给患者家庭和社会带来巨大的经济负担。由于人们对RA 发病和进展机制尚不完全清楚,因此,目前尚无特异性治疗RA 的策略,且许多常用的RA非特异性治疗药物具有众多副作用[3]。因此,对RA的发病和进展机制以及抗RA 药物的筛选仍需持续研究。
黄芩苷(baicalin,Bai)是从黄芩苷根中提取的黄酮类单体之一,可用于支气管炎、上呼吸道感染、风湿痛和关节痛的治疗。近年来研究[4-6]报道,黄芩苷可通过维持辅助性T 细胞17(T helper 17 cells,Th17)/调节性T 细胞(regulatory T cells,Treg)反应平衡来减轻过敏性哮喘、佐剂诱导性关节炎和实验性自身免疫性脑脊髓炎模型小鼠的免疫炎症反应。胶原蛋白诱发性关节炎(collagen-induced arthritis,CIA)小鼠模型与人RA 在病因和病理学改变相似[7]。而黄芩苷对CIA 的具体作用和机制尚不完全清楚,仍需进一步研究。因此,本研究通过观察黄芩苷对CIA 小鼠炎症反应和Th17 细胞比例的影响,并分析其潜在的机制。
材 料 和 方 法
1 试剂
黄芩苷(纯度>98%)购自上海纯优生物科技有限公司;鸡源II 型胶原蛋白(chick collagen type II,CII)、完全弗氏佐剂(complete Freund's adjuvant,CFA)、不完全弗氏佐剂(incomplete Freund's adjuvant,IFA)、佛波酯(phorbol 12-myristate 13-acetate,PMA)和离子霉素购自Sigma-Aldrich;小鼠白细胞介素 1β(interleukin-1β,IL-1β)、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)、免疫球蛋白G(immunoglobulin G,IgG)和 IgG2a 的 ELISA 试剂盒购自深圳市达科为生物技术股份有限公司;小鼠IL-17A ELISA试剂盒购自北京索莱宝科技有限公司;抗B淋巴细胞刺激物(B-lymphocyte stimulator,BLyS)抗体购自Santa Cruz;莫能霉素、小鼠白细胞分化抗原4(cluster of differentiation 4,CD4)和IL-17A 抗体购自BD Biosciences;小鼠CD4+T 细胞分离试剂盒购自Miltenyi Biotec;小鼠可溶性BLyS购自Peprotech。
2 实验动物
40 只 7 周龄 SPF 级雄性 DBA/1 小鼠(18~20 g)购自北京维通利华实验动物技术有限公司。将小鼠饲养在22~24℃、50%~60%湿度和12 h/12 h 明暗循环的SPF 动物房中,小鼠可自由饮食饮水。小鼠适应饲养1周后进行CIA造模。
3 方法
3.1 CIA 造模与分组 小鼠分为正常小鼠组(n=8)和关节炎小鼠组(n=32)。通过CII 诱导法构建关节炎小鼠模型[8],首先将CII溶于0.1 mol/L 的冰醋酸制成浓度为1 g/L 的溶液,并与等量的CFA 或IFA 混合成乳剂,然后在第1天取0.2 mL CII与CFA混合的乳剂于小鼠背部皮下分4 个部位注射致敏,第21 天取0.2 mL CII与IFA 混合的乳剂于小鼠尾根部皮下分4个部位注射强化免疫。关节炎小鼠分为4 个亚组,分别是CIA 亚组及黄芩苷低、中和高剂量处理亚组,每个亚组包含8 只小鼠;其中黄芩苷低、中和高剂量处理亚组小鼠在第28 天起通过灌胃方式分别给予50、100 和 200 mg·kg-1·d-1黄芩苷,持续 14 d[5-6];CIA亚组在第28 天起通过灌胃方式给予等体积生理盐水,持续14 d。正常小鼠第1 天和21 天注射0.2 mL 0.1 mol/L 的冰醋酸(方式同CIA 造模方式),并在第28 天起通过灌胃方式给予等体积生理盐水,持续14 d。
3.2 各组小鼠关节炎指数(arthritis index,AI)的评估 采用AI 积分评价第42 天时各组小鼠关节炎症程度。根据踝关节和趾之间病变程度分别对小鼠每只爪进行打分:0 分,无红肿现象;1 分,趾关节或踝关节呈现红斑和轻度肿胀;2 分,踝关节蔓延至足跖中段均呈现红斑和轻度肿胀;3 分,踝关节、足爪和趾均呈现红斑和中度肿胀;4 分,踝关节、足爪和趾均呈现红斑和重度肿胀。4 只爪的AI 分数之和为每只小鼠的总AI积分。
3.3 血液和组织样本收集 在第42 天,麻醉各组小鼠并脱颈处死,每只小鼠收集2 mL 颈动脉血,并收集小鼠后腿膝关节、脾脏和肠系膜淋巴结(mesenteric lymph nodes,MLN)组织样本。
3.4 ELISA 检测 取各组小鼠血液样品至于4℃冰箱中呈45度角静置1 h,然后3 000×g离心5 min收集血清。取各组小鼠后腿膝关节组织,用RIPA 裂解液进行匀浆,并收集组织匀浆液。分别取血清和组织匀浆液按照ELISA 试剂盒说明书步骤进行ELISA 反应。显色后,使用全自动酶标仪(Thermo Scientific)检测波长540 nm(用于IL-1β 和TNF-α 测定)和450 nm(用于IgG、IgG2a 和IL-17A 测定)处的吸光度(A),然后根据标准曲线计算血清中IL-1β、TNF-α、IL-17A、IgG 和 IgG2a 的含量和膝关节组织中 IL-17A 的含量。
3.5 后腿膝关节HE 染色 取各组小鼠后腿膝关节组织并用4%甲醛固定48 h,5%硝酸脱钙2 h,在二甲苯浸泡后将组织包埋在石蜡中,制作5 μm 厚度的石蜡切片,并行常规HE 染色。HE 染色后,用DP73显微镜(Olympus)观察组织形态变化,并随机获取4个不同视野的图像。HE 染色组织病理学图像使用炎症细胞浸润、滑膜成纤维细胞增生和关节腔损伤的参数积分计算软骨评分。每个参数的评分范围为0~4,其中0代表正常表型,4代表最严重的变化,3个参数的评分之和为软骨评分。
3.6 流式细胞术分析CD4+IL-17A+T细胞比例 从各组小鼠的脾脏组织和MLN 组织中分离出单核细胞悬液,用PMA(100 μg/L)、离子霉素(500 μg/L)和莫能霉素(2 μmol/L)刺激4 h 后,在4°C 的暗室下分别孵育1:1 000 稀释比例的抗CD4(PE)和抗IL-17A(FITC)单克隆抗体30 min。用FACS CantoTMII 流式细胞仪(BD)通过CD4+门控圈出Th 细胞,然后生成流式散点图,并使用FlowJo 7.6.1 软件分析CD4+IL-17A+T细胞比例。
3.7 Western blot检测 取各组小鼠后腿膝关节、脾脏和MLN组织样品,并分别用RIPA裂解液提取总蛋白。蛋白经BCA 法定量后,用常规Western blot 法检测组织中BLyS蛋白表达。BLyS和GAPDH 抗体的稀释比例分别为 1∶2 000 和1∶8 000。用ECL 发光液将目的条带曝光于胶片,并用ImageJ 软件量化目的条带灰度值。
3.8 细胞学实验 取正常小鼠的脾脏,按照小鼠CD4+T 细胞分离试剂盒说明书步骤,通过磁珠法分离CD4+T 细胞亚群。CD4+T 细胞亚群接种于含10%胎牛血清的RPMI-1640 培养基中,并分为对照(control,Con)组(常规培养 48 h)、BLyS 组(添加 2 μg/L BLyS 处理 48 h)和 BLyS+Bai 组(添加 2 μg/L BLyS 和20 μmol/L黄芩苷处理48 h)。处理结束后,收集细胞上清液用于检测上清液中IL-1β 和TNF-α 水平(检测方法同3.4);收集细胞用于分析CD4+IL-17A+T细胞比例(检测方法同3.6)。
4 统计学处理
数据表示为均数±标准差(mean±SD),使用SPSS 17.0 软件对数据进行统计分析。多组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 黄芩苷减轻CIA小鼠的关节肿胀和病理学改变
如图1A 所示,正常组小鼠关节、足爪和趾均正常,CIA组小鼠关节(膝、踝和趾关节)、足爪和趾表现为严重肿胀、红斑和关节僵硬等症状;黄芩苷处理组炎症状得到减轻,表现为关节、足爪和趾的肿胀和红斑消退。AI积分结果显示,与正常组对比,CIA 组小鼠AI 积分显著升高(P<0.01);与CIA 组比较,黄芩苷剂量依赖性降低AI积分(P<0.05),见图1C。膝关节HE染色组织学分析显示,正常组小鼠关节未见病理学改变,CIA 组小鼠关节表现为滑膜增生、炎症细胞浸润和骨破坏的现象,黄芩苷处理组显示关节病理学改变有减轻,见图1B;软骨评分结果显示,与正常组对比,CIA 组小鼠软骨评分显著升高(P<0.01);与CIA 组比较,黄芩苷剂量依赖性降低软骨评分(P<0.05),见图1D。
2 黄芩苷抑制促CIA进展相关因子的生成
ELISA 结果显示,与正常组对比,CIA 组血清中IL-1β、TNF-α、总IgG、同种型特异性IgG2a 和IL-17A的水平及关节组织中IL-17A 的水平均显著升高(P<0.01);与CIA 组比较,黄芩苷以剂量依赖性方式降低上述指标的水平(P<0.05),见图2。
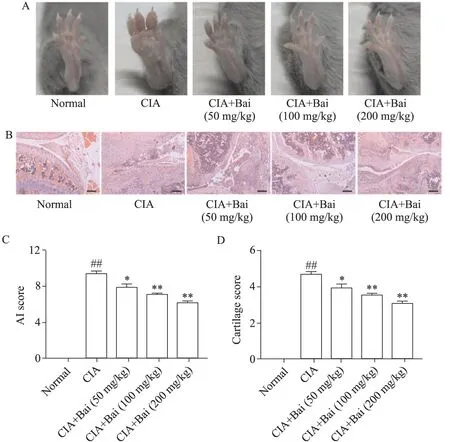
Figure 1.Effects of baicalin(Bai)on joint swelling and pathological changes in CIA mice.A:representative images of the hind paws in different groups;B:representative HE staining images of the hind leg knee joints in different groups(scale bar=500 μm);C:arthritis index(AI)scores in different groups;D:cartilage scores in different groups.Mean±SD. n=8.##P<0.01 vs normal group;*P<0.05,**P<0.01 vs CIA group.图1 黄芩苷对CIA小鼠关节的肿胀程度和病理学改变的影响
3 黄芩苷降低CIA小鼠的Th17细胞比例
流式细胞结果显示,与正常组比较,CIA 组脾脏和MLN 中的CD4+IL-17A+T 细胞的比例均显著升高(P<0.01);与CIA 组比较,黄芩苷剂量依赖性降低脾脏和MLN 中CD4+IL-17A+T 细胞的比例(P<0.05),见图3。
4 黄芩苷抑制CIA小鼠BLyS的表达
Western blot 结果显示,与正常组比较,CIA 组关节、脾脏和MLN 组织中BLyS 表达显著增加(P<0.01);黄芩苷剂量依赖性降低关节、脾脏和MLN 组织中BLyS表达(P<0.05),见图4。
5 黄芩苷抑制BLyS 诱导的Th17 细胞分化及促炎因子IL-1β和TNF-α的生成
流式细胞结果显示,与对照组比较,BLyS 组中CD4+IL-17A+T 细胞的比例显著升高(P<0.01);与BLyS 组比较,BLyS+Bai 组中 CD4+IL-17A+T 细胞的比例显著降低(P<0.01),见图5A。ELISA结果显示,与对照组比较,BLyS 组中 IL-1β 和 TNF-α 的水平显著升高(P<0.01);与BLyS 组比较,BLyS+Bai 组中IL-1β和TNF-α的水平显著降低(P<0.01),见图5B。
讨 论
目前,尽管对RA 的确切发病机制尚不清楚,但T 细胞介导的异常免疫反应被认为是关节发炎和骨破坏的主要诱因[9]。在CIA 小鼠模型中T 细胞特异性免疫异常反应可导致炎症细胞浸润、滑膜增生、软骨降解和骨侵蚀[10-11];并伴有非特异性促炎因子(如IL-1β、IL-6 和 TNF-α 等)和自身抗体(IgG 和 IgG2a等)的过量生成,且其过量生成又能进一步激化免疫异常反应和活化炎症细胞,最终能加剧CIA 的滑膜炎、软骨损伤和骨吸收[12]。本实验结果显示,黄芩苷可有效减轻CIA 小鼠的关节肿胀症状以及病理学改变,并降低血清中 IL-1β、TNF-α、IgG 和 IgG2a 的水平,提示黄芩苷具有抗RA的作用。

Figure 2.Effects of baicalin(Bai)on inflammatory indexes and immune markers in CIA mice.Meas±SD. n=8,##P<0.01 vs normal group;*P<0.05,**P<0.01 vs CIA group.图2 黄芩苷对CIA小鼠的炎症指标和免疫指标的影响
Th17 细胞在RA 免疫性炎症启动过程中发挥重要作用。在CIA小鼠模型中,Th17细胞分泌的IL-17能募集滑膜炎性巨噬细胞、中性粒细胞和T 细胞沉积于关节处滑膜并能上调IL-1β、IL-6 和 TNF-α 等促炎因子分泌,最终加剧滑膜炎、软骨损伤和骨吸收[8-11]。抑制 IL-17 可缓解 CIA 小鼠关节病变部分的炎症反应[13]。因此,抑制Th17 细胞分化可减轻RA的炎症反应。本实验结果显示,黄芩苷可降低CIA小鼠脾脏和MLN 中Th17细胞比例,并降低血清和关节处的IL-17A 水平,提示黄芩苷可通过降低Th17 细胞生成来减轻CIA。
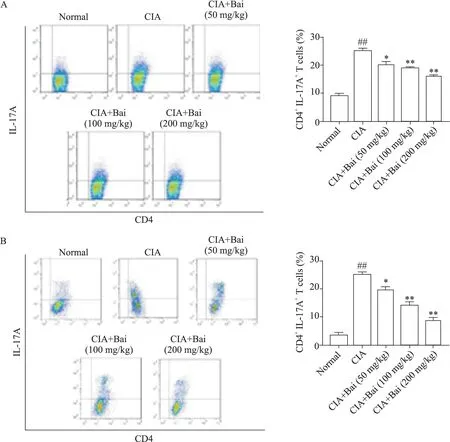
Figure 3.Effect of baicalin(Bai)on the the proportion of Th17 cells in spleen(A)and MLN(B)of CIA mice.Meas±SD. n=8.##P<0.01 vs normal group;*P<0.05,**P<0.01 vs CIA group.图3 黄芩苷对CIA小鼠Th17细胞比例的影响
本实验进一步探究了黄芩苷降低Th17 细胞生成的潜在调控分子机制。研究显示,BLyS 可通过跨膜激活剂、钙调节剂和亲环蛋白配体相互作用物(transmembrane activator and calcium modulator and cyclophilin ligand interactor,TACI)等受体参与调节Th17 细胞分化和 T 细胞介导的免疫炎症反应[14-15]。BLyS 在包括RA 在内的多种自身免疫性疾病患者中高表达,且基因靶向抑制BLyS 可减轻RA 和系统性红斑狼疮损伤[16-17]。因此,本实验进一步检测黄芩苷对CIA 小鼠中BLyS 表达的影响,结果显示,黄芩苷可降低CIA 小鼠病变关节、脾脏和MLN 中BLyS的表达。另外,本实验还发现黄芩苷可降低BLyS 刺激的 CD4+T 细胞群中 Th 细胞的比例、IL-1β 和 TNF-α 水平。这些结果提示,在CIA 小鼠中,黄芩苷能抑制BLyS 介导的Th17 细胞分化和Th17 细胞介导的免疫反应。
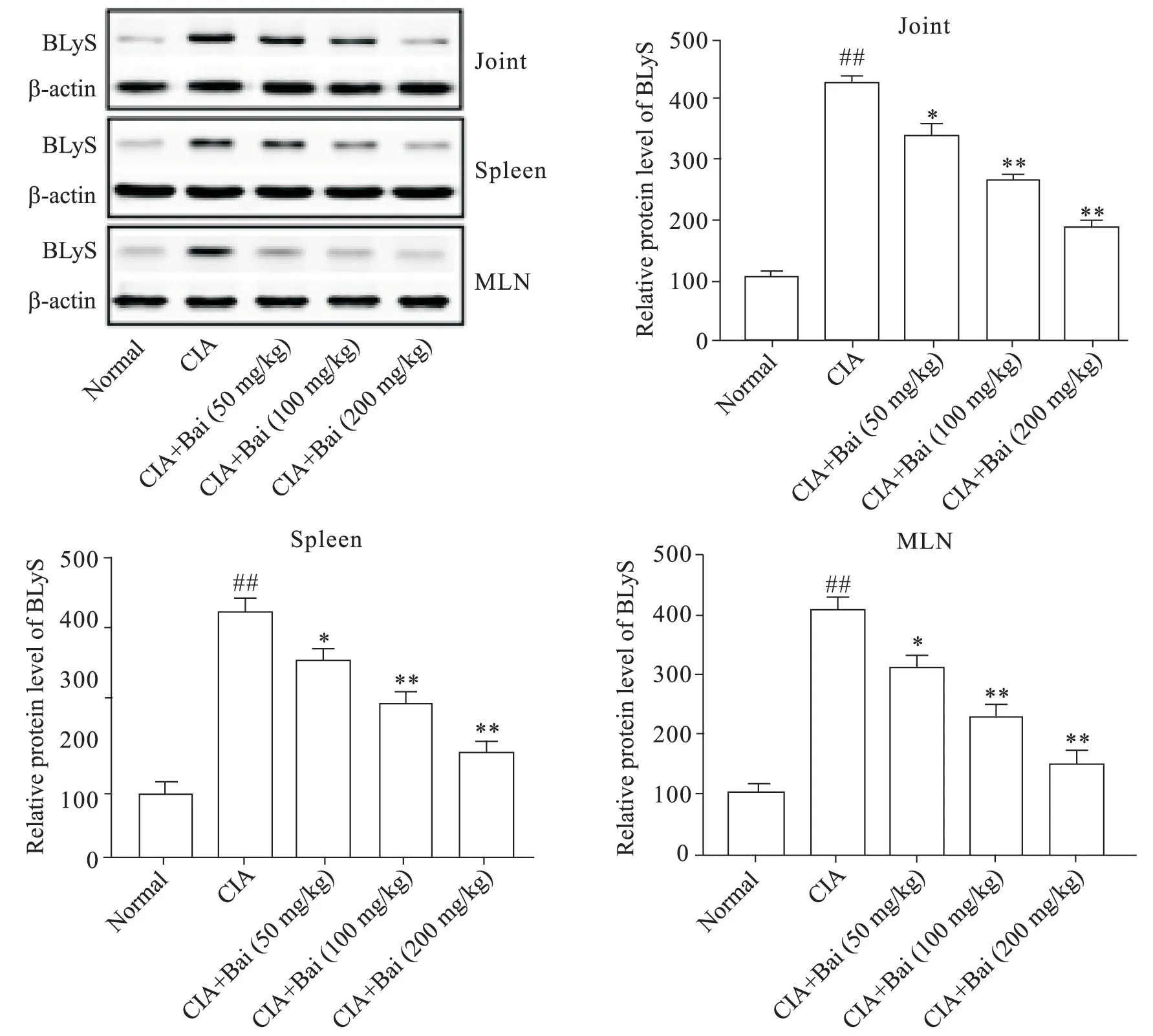
Figure 4.Effect of baicalin(Bai)on the expressions of BLyS in joint,spleen and MLN tissues of CIA mice.Meas±SD. n=8.##P<0.01 vs normal group;*P<0.05,**P<0.01 vs CIA group.图4 黄芩苷对CIA小鼠膝关节、脾脏和MLN中BLyS表达的影响
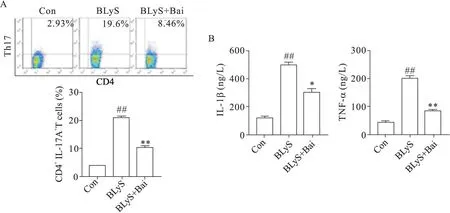
Figure 5.Baicalin(Bai)inhibits Th17 cell differentiation and the levels of proinflammatory factors IL-1β and TNF-α in CD4+ T cell population induced by BLyS.A:the proportion of CD4+ IL-17A+ T cells in each group was detected by flow cytometry;B:the levels of IL-1β and TNF-α in each group were detected by ELISA.Meas±SD. n=8.##P<0.01 vs Con group;*P<0.05,**P<0.01 vs BLyS+Bai group.图5 黄芩苷抑制BLyS诱导的CD4+T细胞群中的Th17细胞分化及促炎因子IL-1β和TNF-α的水平
综上所述,黄芩苷能通过抑制促炎因子IL-1β、IL-6 和 TNF-α 的生成和 BLyS 介导的 Th17 细胞分化来发挥抗RA的作用。

