Rip2诱导人胰腺癌细胞自噬和凋亡的交互作用及机制研究*
周 晗, 杨文欣, 王华东, 胡巢凤△
(1暨南大学基础医学院病理生理学系,国家中医药管理局病理生理学实验室,广东广州510632;2佛山市禅城区中心医院,广东佛山528031)
自噬是一种存在于真核细胞中的保守、常见的代谢过程。在营养缺乏、损伤、高温、低氧和氧化应激等外界刺激以及病原体感染等情况下可诱导自噬[1]。细胞中单层或双层膜包绕待降解物,从而形成分隔膜,当分隔膜延伸并完全包绕待降解物(如细胞器和蛋白质)则形成自噬体[2-5]。越来越多的研究表明,自噬在肿瘤的发生、发展过程中具有重要作用,并且与凋亡存在密切的联系;但是,自噬在肿瘤中所起的作用及其与凋亡的确切关系仍存在较多的争议。
受体相互作用蛋白2(receptor-interacting protein 2,Rip2)属于Rip 家族成员,广泛表达于人体组织(如心脏、脑组织、胎盘、肺、脾脏、胰腺、淋巴结等),定位于胞浆[6]。NOD 样受体家族是胞质蛋白,其主要成员NOD1 可识别革兰阴性杆菌肽聚糖,通过与Rip2 结合诱导自噬和炎症反应的发生,Rip2 对于NOD1 诱导白细胞介素8(interleukin-8,IL-8)的产生和自噬体的形成是必不可少的,但未对其作用机制进行研究[7]。研究发现,在肠上皮细胞中,NOD2可通过Rip2 的酪氨酸激酶活性激活p38 MAPK 信号通路,同时抑制蛋白磷酸酶发生磷酸化,诱导自噬的发生[8]。然而,一项关于克罗恩病的研究表明,NOD1 和NOD2 在细菌入侵细胞的位点募集自噬相关蛋白ATG16L1至细胞膜,诱发自噬,抑制炎症因子的释放,该过程却没有NF-κB和Rip2的参与[9]。
本课题组前期研究证实,Rip2可通过激活内、外源性凋亡途径诱导人胰腺癌Panc-1 细胞凋亡[10];Rip2 还能引起Panc-1 细胞自噬,其机制可能与抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB/Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的活化有关[11]。Rip2诱导的自噬和凋亡是否具有交互作用,有待进一步研究。因此,本研究主要探讨Rip2 导致的Panc-1 细胞自噬和凋亡是否具有交互作用及其作用机制。
材 料 和 方 法
1 材料
Panc-1 细胞由中山大学中山医学院赠予。pEGFP-Rip2 质粒由本实验室前期构建;jetPRIME 转染试剂购自 Polyplus;抗 Rip2 抗体购自 Santa Cruz;抗LC3、beclin-1、mTOR、p-mTOR、Akt、p-Akt、Bax、Bcl-2、Fas、细胞色素c(cytochrome c,Cyt-c)和GAPDH抗体均购自Cell Signaling Technology;caspase-3、-8、-9活性检测试剂盒购自BioVision;自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)购自大连美仑生物技术有限公司;凋亡抑制剂Z-VAD-FMK 购自Med-Chem Express。
2 方法
2.1 自噬抑制剂3-MA 对Rip2 诱导Panc-1 细胞凋亡的影响
2.1.1 质粒转染 用jetPRIME 分别转染pEGFP-C2空质粒和pEGFP-Rip2 重组质粒至Panc-1 细胞,6 h后更换新鲜的DMEM培养基,继续培养42 h。
2.1.2 实验分组 (1)对照组:仅培养细胞,不做任何处理;(2)pEGFP-C2 组:转染pEGFP-C2 质粒入细胞;(3)3-MA组:细胞培养6 h,加入含自噬抑制剂3-MA的DMEM 培养基培养细胞42 h;(4)pEGFP-Rip2组:转染pEGFP-Rip2 重组质粒至细胞;(5)pEGFPRip2+3-MA 组:转染pEGFP-Rip2 重组质粒至细胞6h,更换新鲜DMEM 培养基,同时加入3-MA,继续培养42 h。实验中所用的3-MA 剂量要求对细胞活力没有显著影响,且能抑制Rip2诱导的细胞自噬。
2.1.3 MTT 法检测细胞活力 将细胞以每孔0.5×104的密度接种于96 孔板内,培养6 h,再分别加入不同浓度(0.25、0.5、1、2、4 和8 mmol/L)自噬抑制剂3-MA处理42 h,每组6个复孔。吸弃孔内培养液,每孔加入 180μL 不含血清的 DMEM 培养基和 MTT 溶液20 μL,震荡混匀后在细胞培养箱内孵育4 h。去上清后,每孔加入DMSO 150 μL,37℃低速震荡5 min,多功能酶标仪于490 nm 检测各孔吸光度(absorbance,A),计算细胞活力。
2.1.4 流式细胞术检测细胞凋亡率 将细胞以每孔3×105的密度接种于6 孔板内,对细胞进行相应处理后,收集细胞,加 1× binding buffer 及 Annexin VPE,混匀后避光孵育15 min,然后再加入7-氨基放线菌素D(7-aminoactinomycin D,7-AAD),混匀后立即上机检测。
2.1.5 Western blot 检测蛋白表达 用胰酶消化并收集细胞。加入RIPA 裂解液和PMSF 蛋白酶抑制剂,提取细胞胞浆蛋白并检测蛋白的浓度。分离蛋白,将蛋白转移至硝酸纤维薄膜上,放置于封闭液中封闭1 h。加入Ⅰ抗,4℃孵育12~16 h,再加入Ⅱ抗,用GAPDH作为内参照[10]。
2.1.6 caspase-8、-9、-3活性的检测 首先收集细胞置于离心管内,每管细胞数量最好为(2~5)×106。用相应的试剂盒,按照所需的剂量将2×Reaction Buffer和 DTT 以 100∶1 的体积比混合均匀;每管加入 50 μL冰上预冷的Cell Lysis Buffer 重悬细胞沉淀,冰上孵育10 min;10 000×g离心1 min;吸取上清液转移至另一离心管内,每管吸取5 μL 细胞裂解液进行BCA蛋白定量;取 100~200 μg 蛋白和 50 μL Cell Lysis Buffer,混合后加入96孔板内;再加入50 μL 2× Reaction Buffer(含DTT),并分别加入 5 μL IETD-pNA、LEHD-pNA 和 DEVD-pNA(分别为 caspase-8、-9、-3的底物)。震荡混匀后,置于细胞培养箱避光孵育2 h;用多功能酶标仪在405 nm 处测定各孔A值。将各组A值的平均值与对照组A值的平均值相比,根据蛋白浓度计算各组细胞样品caspase-8、-9、-3的活性。
2.2 凋亡抑制剂Z-VAD-FMK对Rip2诱导Panc-1细胞自噬的影响
2.2.1 实验分组 (1)对照组:仅培养细胞,不做任何处理;(2)pEGFP-C2 组:转染pEGFP-C2 质粒入细胞;(3)Z-VAD-FMK 组:细胞培养 6 h,加入含 caspases 抑制剂 Z-VAD-FMK 的 DMEM 完全培养基培养细胞 42 h;(4)pEGFP-Rip2 组:转染 pEGFP-Rip2 重组质粒至细胞;(5)pEGFP-Rip2+Z-VAD-FMK 组:将pEGFP-Rip2 质粒转染至细胞,6 h 后更换培养基,再加入Z-VAD-FMK 继续培养42 h。实验中所用的ZVAD-FMK 剂量要求对细胞活力没有显著影响,且能抑制Rip2诱导的细胞凋亡。
2.2.2 蛋白表达检测 参见2.1.5。
2.2.3 透射电镜观察细胞内自噬体的数量及形态 将细胞以每孔3×105的密度接种于6 孔板,具体方法见参考文献[11]。
3 统计学处理
用SPSS 20.0软件对实验数据进行分析,数据用均数±标准差(mean±SD)表示。多组间均数比较用单因素方差分析,组间两两比较则采用Bonferroni法。以P<0.05表示差异有统计学意义。
结 果
1 3-MA促进Rip2诱导的细胞凋亡
1.1 转染pEGFP-Rip2质粒后细胞Rip2蛋白表达的变化 Western blot 结果显示,与对照组和pEGFP-C2组比较,pEGFP-Rip2 组细胞Rip2 蛋白表达显著增加(P<0.01),见图1。以上结果说明pEGFP-Rip2 质粒被成功转入细胞。

Figure 1.The protein level of Rip2 in Panc-1 cells.Mean±SD.n=3.**P<0.01 vs control group or pEGFP-C2 group.图1 Panc-1细胞Rip2蛋白水平
1.2 MTT 法检测不同剂量3-MA 对Panc-1细胞活力的影响 用不同浓度(0.25、0.5、1、2、4 和8 mmol/L)的自噬抑制剂3-MA 处理Panc-1细胞,MTT 法检测结果显示,与对照组相比,0.25、0.5、1 和 2 mmol/L 3-MA对细胞活力没有显著影响,而4和8 mmol/L 3-MA可显著降低细胞活力(P<0.05,P<0.01),见图2。我们在预实验中发现,2 mmol/L 3-MA 可抑制过表达Rip2 导致的细胞自噬,因此确定后续实验中所用3-MA 剂量为2 mmol/L,该剂量既不影响细胞活力,又可以抑制Rip2诱导的细胞自噬。
1.3 3 -MA 促进Rip2诱导的细胞凋亡 流式细胞术结果分析的散点图中,Q2 区表示早期凋亡细胞,Q4区表示晚期凋亡细胞。流式细胞术结果显示,与对照组和pEGFP-C2 组相比,pEGFP-Rip2 组细胞凋亡率显著升高(P<0.05);而与 pEGFP-Rip2 组比较,pEGFP-Rip2+3-MA 组细胞凋亡率进一步升高(P<0.05),见图3。
1.4 3 -MA 对过表达Rip2细胞凋亡相关蛋白表达的影响 pEGFP-Rip2 组细胞 Fas、Bax 及胞浆 Cyt-c 蛋白水平显著高于对照组和pEGFP-C2组(P<0.05),而pEGFP-Rip2+3-MA 组细胞 Fas、Bax 蛋白及胞浆 Cyt-c蛋白水平进一步升高(P<0.05);此外,pEGFP-Rip2组细胞Bcl-2 蛋白水平显著低于对照组和pEGFP-C2组(P<0.05),而 pEGFP-Rip2+3-MA 组细胞 Bcl-2 蛋白水平进一步下降(P<0.05),见图4。

Figure 2.The effect of different doses of 3-MA on the viability of Panc-1 cells.Mean±SD. n=6.*P<0.05,**P<0.01 vs control group.图2 不同剂量3-MA对Panc-1细胞活力的影响

Figure 3.The effect of 3-MA on the apoptosis of Panc-1 cells induced by Rip2.Mean±SD. n=3.*P<0.05,**P<0.01 vs control group or pEGFP-C2 group;#P<0.05 vs pEGFP-Rip2 group.图3 3-MA对Rip2诱导的Panc-1细胞凋亡的影响
1.5 3 -MA 增强过表达 Rip2 细胞 caspase-8、-9、-3 的活性 pEGFP-Rip2 组细胞 caspase-8、-9、-3 的活性显著高于对照组和pEGFP-C2 组(P<0.05);与pEGFPRip2 组比较,pEGFP-Rip2+3-MA 组细胞 caspase-8、-9、-3的活性进一步升高(P<0.05),见图5。

Figure 4.The effect of 3-MA on the protein levels of Fas,Bax,Bcl-2 and cytoplasmic Cyt-c in the Panc-1 cells with Rip2 overexpression.Mean±SD. n=3.*P<0.05 vs control group or pEGFP-C2 group;#P<0.05 vs pEGFP-Rip2 group.图4 3-MA对过表达Rip2的Panc-1细胞Fas、Bax、Bcl-2及胞浆Cyt-c蛋白水平的影响

Figure 5.The effect of 3-MA on caspase-8,-9 and -3 activity in the Panc-1 cells with Rip2 overexpression.Mean±SD. n=3. *P<0.05 vs control group and pEGFP-C2 group;#P<0.05 vs pEGFP-Rip2 group.图5 3-MA对过表达Rip2的Panc-1细胞caspase-8、-9、-3活性的影响
2 Z-VAD-FMK促进Rip2诱导的细胞自噬
2.1 MTT 法检测不同剂量 Z-VAD-FMK 对 Panc-1 细胞活力的影响 用不同浓度(5、10、20 和40 μmol/L)的 caspases 抑制剂 Z-VAD-FMK 处理 Panc-1 细胞,MTT 法检测细胞活力结果显示,与对照组比较,5、10 和 20 μmol/L Z-VAD-FMK 对细胞活力没有显著的影响,而40 μmol/L Z-VAD-FMK 可显著降低细胞活力(P<0.05),见图6。我们在预实验中发现,10 μmol/L Z-VAD-FMK 可抑制过表达Rip2 导致的细胞凋亡,因此选择10 μmol/L 为后续实验中Z-VADFMK的剂量。
2.2 Z-VAD-FMK 对过表达Rip2 细胞自噬相关蛋白表达的影响 Western blot结果显示,pEGFP-Rip2组细胞beclin-1 和LC3-Ⅱ蛋白表达显著多于对照组和pEGFP-C2组(P<0.01);与pEGFP-Rip2组比较,pEGFP-Rip2+Z-VAD-FMK 组细胞 beclin-1 和 LC3-Ⅱ蛋白表达水平进一步升高(P<0.01),见图7。
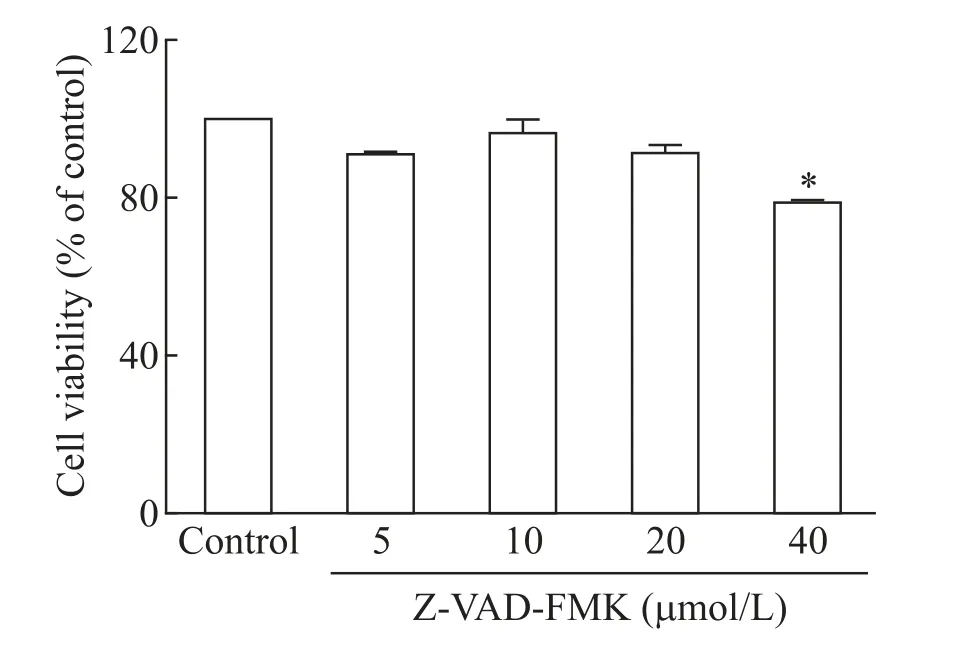
Figure 6.The effect of different doses of Z-VAD-FMK on the viability of Panc-1 cells.Mean±SD. n=6.*P<0.05 vs control group.图6 不同剂量Z-VAD-FMK对Panc-1细胞活力的影响
2.3 Z-VAD-FMK 对过表达Rip2 细胞内自噬体数量的影响 pEGFP-Rip2 组细胞内自噬体的数量显著多于对照组和pEGFP-C2 组;pEGFP-Rip2+Z-VAD-FMK 组细胞内自噬体数量则显著多于pEGFP-Rip2组,见图8。

Figure 7.The effect of Z-VAD-FMK on the protein expression levels of beclin-1 and LC3-Ⅱin the Panc-1 cells of different groups.Mean±SD. n=3.**P<0.01 vs control group or pEGFP-C2 group;##P<0.01 vs pEGFP-Rip2 group.图7 Z-VAD-FMK对各组Panc-1细胞beclin-1和LC3-Ⅱ蛋白表达水平的影响

Figure 8.Changes of the autophagosomes in Panc-1 cells observed under transmission electron microscope(scale bar=2 μm).A:control group;B:pEGFP-C2 group;C:Z-VAD-FMK group;D:pEGFP-Rip2 group;E:pEGFP-Rip2+Z-VAD-FMK group.M:mitochondrion;N:nucleus.Arrows indicate autophagosomes.图8 透射电镜下观察细胞自噬体的变化
2.4 Z-VAD-FMK抑制过表达Rip2细胞Akt 和mTOR 蛋白磷酸化 Western blot 结果显示,与对照组和pEGFP-C2组相比,pEGFP-Rip2组细胞p-Akt和p-mTOR 蛋白水平显著降低(P<0.01),而总 Akt 和mTOR 蛋白表达变化不显著;与pEGFP-Rip2 组比较 ,pEGFP-Rip2+Z-VAD-FMK 组 细 胞 p-Akt 和 pmTOR 蛋白水平进一步下降(P<0.01,P<0.05),总Akt 和mTOR 蛋白表达则无显著变化,见图9。上述结果说明Z-VAD-FMK 可抑制过表达Rip2 细胞Akt和mTOR蛋白磷酸化。
讨 论
目前普遍认为,细胞自噬的保护性和抑制性作用与多种因素相关,并且具有组织特异性。保护性自噬可帮助肿瘤细胞逃避各种刺激因素所诱导的凋亡,而抑制性自噬可促进肿瘤细胞凋亡。因此,我们应用3-MA抑制细胞自噬,观察过表达Rip2诱导的细胞凋亡的变化情况;应用caspases 抑制剂Z-VADFMK 抑制细胞凋亡,观察过表达Rip2 诱导的细胞自噬的变化情况,从而探究自噬与凋亡的相互作用及其机制。
外源性途径和内源性途径是介导细胞凋亡信号的2 条主要通路。在外源性凋亡途径中,胞外的死亡配体结合于细胞表面的死亡受体,并使其活化,从而诱导凋亡的发生。例如,三聚体FasL与其受体Fas结合后,使Fas的死亡结构域活化,募集接头蛋白Fas相关死亡结构域蛋白(Fas-associated death domain protein,FADD),FADD 可引起 procaspase-8 自我剪切活化,进而启动凋亡。内源性凋亡通路是由线粒体损伤导致Cyt-c 释放及caspases 活化的信号通路。当线粒体受损时,线粒体膜通透性转换孔开放,水分进入,大量Cyt-c 释放进入胞浆,Cyt-c 作用于凋亡酶激活因子,使caspase-9 活化,从而激活caspase-3,导致凋亡[12-13]。Bcl-2 家族可调节线粒体外膜的完整性和通透性,参与调节线粒体凋亡通路,按其功能特点,可分为抗凋亡蛋白亚家族(Bcl-2、Bcl-xL 等)和促凋亡蛋白亚家族(Bax、Bak等)[14]。
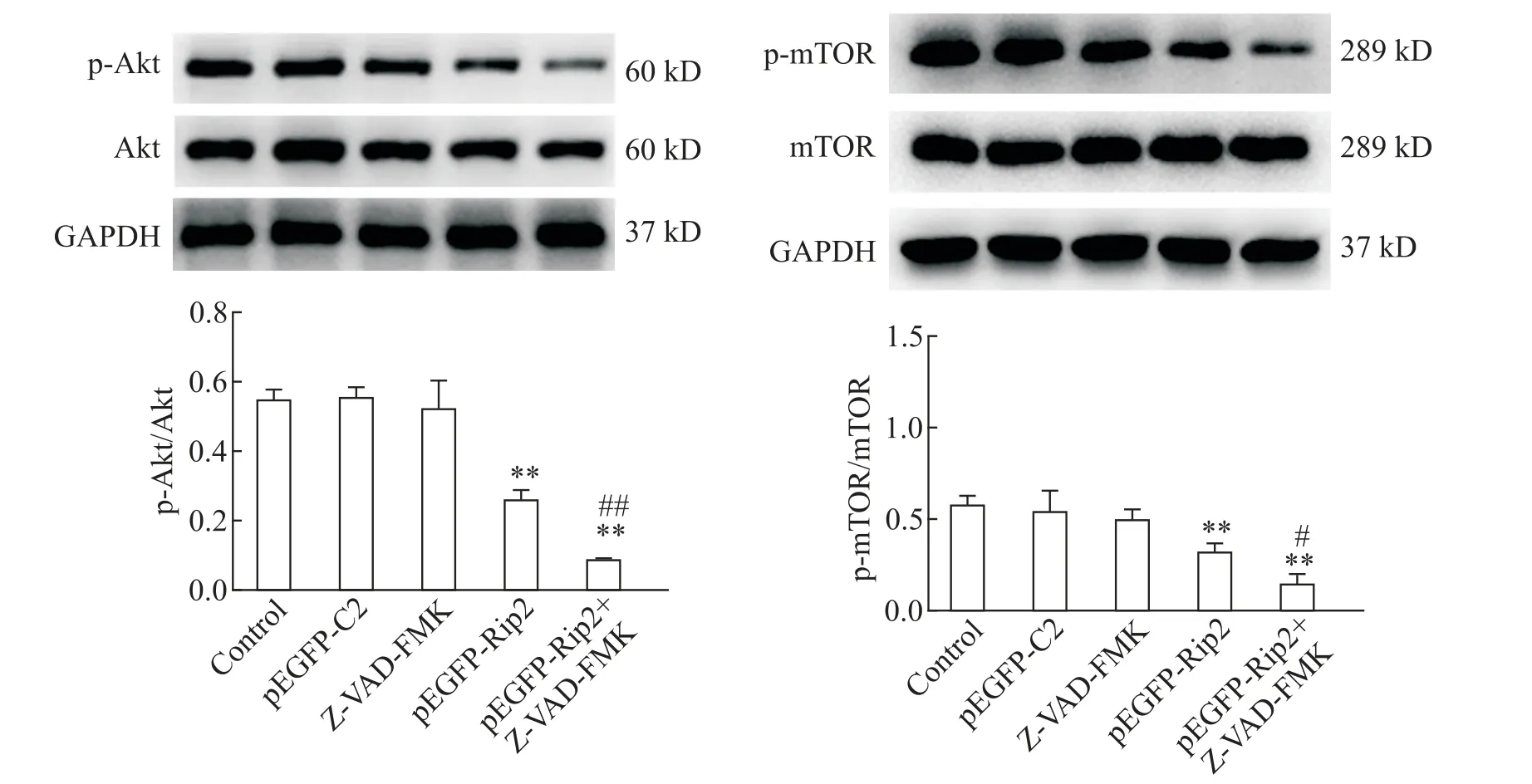
Figure 9.The ratios of p-Akt/Akt and p-mTOR/mTOR in the Panc-1 cells of different groups.Mean±SD. n=3.**P<0.01 vs control group or pEGFP-C2 group;#P<0.05,##P<0.01 vs pEGFP-Rip2 group.图9 各组Panc-1细胞p-Akt/Akt和p-mTOR/mTOR比值
本研究发现,pEGFP-Rip2 组细胞凋亡率显著高于对照组和 pEGFP-C2 组,而 pEGFP-Rip2+3-MA 细胞凋亡率进一步升高,说明抑制细胞自噬可促进Rip2 诱导的细胞凋亡。为了探究其作用机制,我们检测了凋亡相关蛋白的表达水平,结果显示,pEGFPRip2组细胞Fas、Bax 和胞浆Cyt-c蛋白水平显著高于对照组和pEGFP-C2 组,Bcl-2 蛋白表达则显著减少,而pEGFP-Rip2+3-MA组细胞Fas、Bax和胞浆Cyt-c蛋白水平进一步升高,Bcl-2 蛋白表达水平进一步下降。同时,检测各组细胞caspase-8、9、-3 的活性,结果显示,pEGFP-Rip2 组细胞caspase-8、-9、-3 的活性显著高于对照组和pEGFP-C2 组,而pEGFP-Rip2+3-MA 组细胞 caspase-8、-9、-3 的活性进一步升高。以上结果证实,抑制细胞自噬可促进Rip2 诱导的细胞凋亡,其机制可能与进一步激活内、外源性凋亡途径有关。
众所周知,自噬发生时beclin-1 蛋白表达通常会增多,这种蛋白是诱发细胞自噬的关键蛋白之一[15]。此外,LC3有LC3-Ⅰ和LC3-Ⅱ两种形式,LC3-Ⅰ分布于胞浆中,Atg7 激活LC3-Ⅰ,使LC3-Ⅰ与磷脂酰乙醇胺结合而成为LC3-Ⅱ,LC3-Ⅱ定位于自噬体膜上,LC3-Ⅱ的表达水平可以在一定程度上反映自噬体的数量[16]。目前透射电镜被认为是检测自噬的金标准。本研究结果显示,pEGFP-Rip2组细胞beclin-1和LC3-Ⅱ蛋白水平显著高于对照组和pEGFP-C2 组;而pEGFP-Rip2+Z-VAD-FMK 组细胞 beclin-1 和 LC3-Ⅱ蛋白水平进一步升高。同时,在透射电镜下观察到,pEGFP-Rip2 组细胞内自噬体的数量显著增多;而pEGFP-Rip2+Z-VAD-FMK 组细胞内自噬体数量较pEGFP-Rip2 组进一步增多。以上结果说明,用ZVAD-FMK 抑制细胞凋亡可促进Rip2 诱导的细胞自噬。
PI3K/Akt/mTOR 通路是目前唯一已知的自噬抑制信号通路。PI3K是一种广泛存在于多种细胞中的脂质激酶。在受到来自酪氨酸激酶等信号刺激后,PI3K 将磷脂酰肌醇4,5-二磷酸(phosphatidylinositol 4,5-bisphosphate,PIP2)转化为磷脂酰肌醇3,4,5-三磷酸(phosphatidylinositol 3,4,5-trisphosphate,PIP3),PI3K 可以与 Akt 的 N 端 PH 结构域结合,在 3-磷酸肌醇依赖性激酶1(3-phosphoinositide-dependent kinase-1,PDK-1)的辅助下使Akt 活化。mTOR 是活化后的Akt 底物,活化的 Akt 可以使 mTOR 磷酸化,激活mTOR,从而抑制自噬[17-18]。本研究结果显示,pEGFPRip2 组细胞p-Akt 和p-mTOR 蛋白水平显著低于对照组和pEGFP-C2 组,而总Akt 和mTOR 蛋白表达变化却不显著;pEGFP-Rip2+Z-VAD-FMK组细胞p-Akt和p-mTOR 蛋白水平则进一步下降,但总mTOR 和Akt 蛋白表达未见显著变化。以上结果说明,Z-VAD-FMK抑制凋亡可促进Rip2诱导的自噬,其作用机制可能与进一步抑制PI3K/Akt/mTOR 通路的活性有关。
综上所述,在人胰腺癌细胞中,抑制自噬可增强Rip2诱导的细胞凋亡,同时进一步激活内、外源性凋亡途径;而抑制凋亡可促进Rip2诱导的细胞自噬,并进一步下调PI3K/Akt/mTOR 通路的活性。因此,本研究证实了Rip2诱导的细胞自噬和凋亡具有交互拮抗作用。这些结果为寻找治疗胰腺癌的新靶点提供了实验依据。
——一道江苏高考题的奥秘解读和拓展

