miR-30a-5p和NUAK1在非小细胞肺癌中的表达及对A549细胞增殖、迁移和侵袭的影响
李爱明,刘 克,王园园,王 乾
非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的85%[1, 2]。尽管近年来在癌症研究和治疗方面取得了较大进展,但NSCLC的预后仍然很差,其5年生存率仅为15%[3]。因此,了解NSCLC的发病机制并确定新的治疗靶点非常重要[4]。最近研究发现,miRNA与肺癌的发展密切相关,且有用miRNA阵列实验发现miR-30a-5p在NSCLC组织中的表达显著下调[5-7]。然而,miR-30a-5p在非小细胞肺癌中的作用和分子机制仍未完全阐明。新式激酶家族1[Novel (nua) kinase family 1,NUAK1],也称为KIAA0537/ARK5,已被确定为单磷酸腺苷激活蛋白激酶相关激酶(adenosine monophosphate-activated protein kinase related kinase,ARK)家族的第5个成员[8]。NUAK1可以被Akt直接激活,活化的NUAK1可以在葡萄糖饥饿和死亡受体刺激过程中促进细胞存活[8]。最近有研究表明,NUAK1的高表达与结肠癌的肿瘤进展有关,并且可以通过与p53的直接相互作用来调节细胞增殖[9]。此外,NUAK1高表达与预后不良相关,并参与NSCLC细胞的迁移和侵袭[8]。然而,NUAK1在NSCLC中的调控机制仍不清楚。本研究将通过研究miR-30a-5p、NUAK1在NSCLC中的表达及miR-30a-5p靶向NUAK1对NSCLC细胞A549增殖、迁移和侵袭的影响,以揭示NSCLC发生发展的分子机制,为临床诊断治疗提供新思路。
1 资料与方法
1.1 一般资料 收集2016-09至2019-03我院行手术切除治疗的NSCLC患者癌组织和癌旁组织标本各64例,其中男37例,女27例,年龄37~76岁,平均(47.3±10.8)岁;高分化26例,中低分化38例;TNM分期Ⅰ/Ⅱ期24例,Ⅲ/Ⅳ例40例。所有样本组织均经至少2名病理医师诊断为NSCLC,且患者术前未接受任何治疗。本研究方案经医院伦理学委员会审核批准,受试患者或其家属均签署知情同意书。
1.2 细胞 人正常肺上皮细胞BEAS-2B和非小细胞肺癌细胞系H460、H1299和A549购自美国模式培养物保藏所(american type culture collection,ATCC),保存于我院中心实验室的液氮罐中。
1.3 主要试剂与仪器 DMEM培养液、F-12K培养液、RPMI-1640培养液、胎牛血清、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、青-链霉素、胰蛋白酶溶液购自美国Hyclone公司;Lipofectmine 2000转染试剂购自美国Invitrogen公司;RNAiso plus、PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTM购自大连TaKaRa公司;放射免疫沉淀法(radio-immunoprecipitation assay,RIPA)裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、辣根过氧化物酶偶联二抗、购自上海碧云天生物技术有限公司;pmiRGLO载体、Dual Luciferase®Reporter Assay System试剂盒购自美国Promega公司;miR-NC、miR-30a-5p、pcDNA3.1 载体和pcDNA3.1-NUAK1载体购自广州锐博生物技术有限公司;噻唑蓝(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)购自美国Sigma公司;Transwell小室购自美国Corning公司;NUAK1、GAPDH抗体购自美国abcam公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF) 膜、增强化学发光(enhanced chemiluminescence,ECL)试剂盒购自德国Merck Millipore公司。
1.4 方法
1.4.1 细胞培养 BEAS-2B和H1299用含10%胎牛血清的DMEM培养液培养,A549用含10%胎牛血清的F-12k培养液培养,H460用含10%胎牛血清的RPMI 1640培养液培养,并置于37 ℃、5%CO2细胞培养箱中。
1.4.2 细胞转染 取2×105个对数生长期A549细胞接种于6孔板中,随机分为4组,每组3个复孔,待细胞融合度达60%时,用Lipofectmine 2000转染试剂分别将miR-NC、miR-30a-5p、miR-30a-5p联合pcDNA 3.1载体或pcDNA 3.1-NUAK1载体转入A549细胞中,分别记为miR-NC组、miR-30a-5p组、miR-30a-5p+Vector组和miR-30a-5p+NUAK1组,培养48 h后,提取RNA和蛋白进行后续实验研究。
1.4.3 qPCR检测 利用RNAiso plus试剂盒提取非小细胞肺癌样本和细胞中总RNA,用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒进行逆转录,SYBR®Premix Ex TaqTM试剂盒上机检测各个样本中miR-30a-5p和NUAK1的表达,分别以U6和GAPDH为内参。miR-30a-5p正向引物:5′-CAC TCT CAT GTA AAC ATC CTC GAC-3′,反向引物:5′-TAT GGT TGT TCT GCT CTC TGT GTC-3′;U6正向引物:5′-ATT GGA ACG ATA CAG AGA AGA TT-3′,反向引物:5′-GGA ACG CTT CAC GAA TTT G-3′。NUAK1正向引物:5′-ATG CTA AGT ACC CTC TGA ATG-3′ ,反向引物:5′-GCA ACA AGC AGT CAG TCG ATC-3′;GAPDH正向引物:5′-AAG GTG AAG GTC GGA GTC A-3′,反向引物5′-GAA GAT GGT GAT GGG ATT T-3′。
1.4.4 Western blot检测 用RIPA裂解液提取非小细胞肺癌样本和细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,12%十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate -polyacrylamide gel-electrophoresis,SDS-PAGE)电泳分离蛋白样品,后转至PVDF膜上,5%脱脂牛奶封闭2 h,分别用NUAK1和GAPDH抗体于4 ℃孵育过夜,后用Tris缓冲液吐温20(Tris-Buffered Saline Tween-20,TBST)洗涤3次,每次10 min,辣根过氧化物酶偶联二抗室温孵育2 h,TBST洗涤3次,每次10 min,后用ECL发光液孵育条带并置于化学发光成像系统中进行曝光显影,Image J软件相应蛋白的相对表达水平。
1.4.5 双荧光素酶报告实验 用RNAiso plus提取A549细胞总RNA,PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒进行反转录得cDNA,后扩增NUAK1的3′UTR并将其克隆至pmirGLO载体中构建pmirGLO-NUAK1-Wt重组载体。根据TakaRa点突变试剂盒将pmirGLO-NUAK1-Wt中miR-30a-5p的结合位点进行突变,构建pmiRGLO-NUAK1-Mut重组质粒。用Lipofectmine 2000将pmirGLO-NUAK1-Wt/Mut报告载体分别与miR-NC或miR-30a-5p共转至A549细胞中,48 h后用Dual Luciferase®Reporter Assay System试剂盒检测各组细胞荧光素酶活性。
1.4.6 细胞增殖检测 取对数生长期的miR-NC组、miR-30a-5p组、miR-30a-5p+Vector组和miR-30a-5p+NUAK1组细胞分别接种于96孔板中,每孔接种4000个细胞,每组设3个复孔,分别于24 h、48 h和72 h时,每孔加入20 μl的5 mg/ml的MTT溶液,培养箱中孵育4 h,后弃去上清液,每孔加入150 μl 二甲基亚砜,用酶标仪震荡10 min以溶解结晶并检测490 nm处各孔吸光值。
1.4.7 细胞迁移侵袭检测 取预铺基质胶和无预铺基质胶的Transwell小室置于24孔板中,其中预铺基质胶的小室每孔加入50 μl无血清培养液润化30 min,无预铺基质胶的小室不做任何处理。取1×105个对数生长期的miR-NC组、miR-30a-5p组、miR-30a-5p+Vector组和miR-30a-5p+NUAK1组细胞接种至Transwell小室中,添加无血清培养液至200 μl,下室中加600 μl完全培养液,每组设置3个复孔。培养48 h后,PBS洗涤2次,100%甲醇固定10 min,晾干,0.1%结晶紫染色10 min,去离子水洗去残留染液,显微镜下观察并拍照,计数各组迁移侵袭细胞数。

2 结 果
2.1 miR-30a-5p和NUAK1在NSCLC组织中的表达 与癌旁组织相比,NSCLC组织中miR-30a-5p的表达降低,差异有统计学意义(P<0.05);NUAK1 mRNA和蛋白表达高于癌旁组织,差异有统计学意义(P<0.05,图1,表1)。
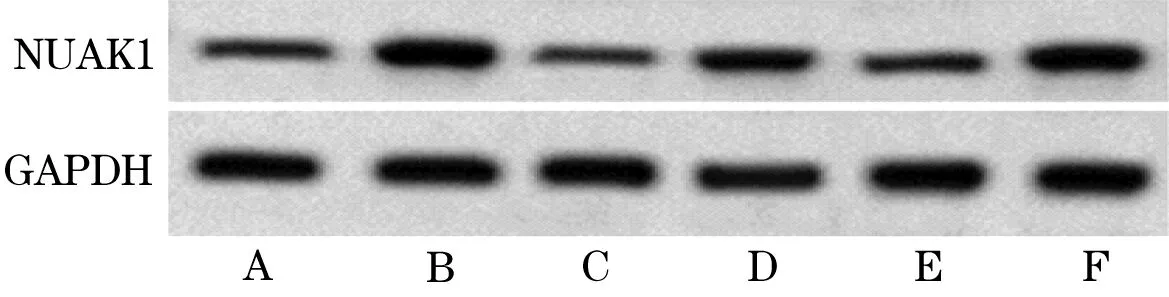
图1 非小细胞肺癌组织中NUAK1蛋白表达

表1 非小细胞肺癌组织和癌旁组织中miR-30a-5p和NUAK1的表达量
2.2 miR-30a-5p和NUAK1在NSCLC细胞中的表达 与人正常肺上皮细胞BEAS-2B相比,非小细胞肺癌细胞系H460、H1299和A549中miR-30a-5p相对表达量降低(P<0.05),NUAK1 mRNA和蛋白相对表达量增加(P<0.05,图2、表2)。
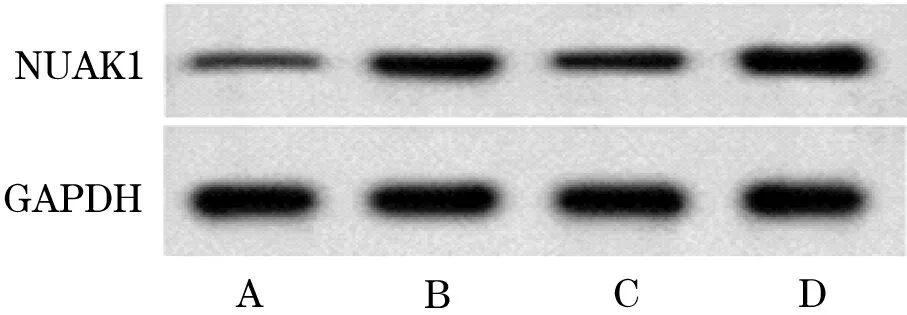
图2 非小细胞肺癌细胞中NUAK1蛋白表达A.BEAS-2B;B.H460;C.H1299;D.A549
表2 人正常肺上皮细胞BEAS-2B和非小细胞肺癌细胞系H460、H1299和A549中miR-30a-5p和NUAK1的表达
2.3 miR-30a-5p与NUAK1靶向结合 利用TargetScan网站预测发现NUAK1可能是miR-30a-5p的潜在靶基因(图3)。与miR-NC组(1.00±0.09)相比,miR-30a-5p组后A549细胞中miR-30a-5p表达量(4.23±0.42)显著升高,差异有统计学意义(t=13.025,P<0.05)。miR-30a-5p组A549细胞中NUAK1-Wt荧光素酶活性(0.45±0.05)较miR-NC组(1.00±0.09)显著降低(t=9.253,P<0.05),而miR-30a-5p组NUAK1-Mut荧光素酶活性(0.96±0.09)与miR-NC组(1.01±0.10)比较差异无统计学意义(t=0.644,P>0.05)。

图3 预测的miR-30a-5p与NUAK1 3′UTR结合位点
2.4 miR-30a-5p可抑制A549细胞中NUAK1蛋白表达 与miR-NC组(0.62±0.06)相比,miR-30a-5p组中NUAK1蛋白相对表达量(0.26±0.03)显著降低,差异有统计学意义(t=9.295,P<0.05)。miR-30a-5p+NUAK1组A549细胞中NUAK1蛋白相对表达量(1.08±0.11)明显高于miR-30a-5p+Vector组(0.24±0.02),差异有统计学意义(t=13.013,P<0.05,图4)。

图4 过表达miR-30a-5p及联合过表达NUAK1后A549细胞中NUAK1蛋白表达
2.5 miR-30a-5p对A549细胞增殖的影响 48 h和72 h时miR-30a-5p组吸光度值低于miR-NC组,差异有统计学意义(t=4.157、6.875,P<0.05),miR-30a-5p+NUAK1组吸光度值高于miR-30a-5p+Vector组,差异有统计学意义(t=3.118、6.245,P<0.05,表3)。
表3 过表达miR-30a-5p及联合过表达NUAK1后A549细胞的相对吸光度值
A.miR-NC组;B.miR-30a-5p组;C.miR-30a-5p+Vector组;D.miR-30a-5p+NUAK1组
2.6 miR-30a-5p对A549细胞迁移侵袭的影响 miR-NC组、miR-30a-5p组、miR-30a-5p+Vector组及miR-30a-5p+NUAK1组迁移细胞数分别为124±21、65±12、54±13和131±24(图5A),侵袭细胞数分别为103±17、43±11、46±10和96±15(图5B)。miR-30a-5p组迁移侵袭细胞数低于miR-NC组,差异有统计学意义(t=4.255、5.132,P<0.05),miR-30a-5p+NUAK1组迁移侵袭细胞数高于miR-30a-5p+Vector组,差异有统计学意义(t=4.886、4.804,P<0.05)。

图5 过表达miR-30a-5p及联合过表达NUAK1对A549细胞迁移侵袭能力的影响
3 讨 论
微小RNA(microRNAs,miRNAs)是小的非编码RNA,由19~25个核苷酸组成。 MiRNA可以通过与3′非翻译区(3′-untranslated region,3′-UTR)结合而负调控靶基因的表达[10]。大量研究表明,miRNA在肿瘤发生的所有步骤中都可以充当肿瘤抑制因子或致癌基因[11]。MiR-30a-5p位于6q.13号染色体上,由内含子转录产生两种成熟形式的miR-30a,分别为miR-30a-3p和miR-30a-5p[12]。MiR-30a-5p在多种恶性肿瘤中失调,例如乳腺癌[13]、肝细胞癌[14]、结肠癌[15]、鼻咽癌[16]、前列腺癌[17]、子宫内膜癌[18]及皮肤癌鳞状细胞癌[19]。在肺癌中,Tang等[12]研究发现,miR-30a的低表达与肺癌预后不良有关。Zhu等[3, 5]通过NSCLC组织中microRNAs的表达谱分析发现miR-30a-5p表达下调,过表达miR-30a-5p可通过靶向CD73/NT5E抑制NSCLC细胞增殖。上述研究表明,在非小细胞肺癌中miR-30a-5p是一个抑癌miRNA。本研究发现,miR-30a-5p在NSCLC样本和细胞中低表达,过表达miR-30a-5p可抑制NSCLC细胞增殖、迁移和侵袭,与Zhu等[3, 5]研究结果一致。
NUAK1也称为ARK5,是单磷酸腺苷(adenosine monophosphate,AMP)激活的蛋白激酶(AMP-activated protein kinase,AMPK)家族的成员[20]。最近的研究证据表明,NUAK1与肿瘤的进展密切相关。据报道,NUAK1是介导人胰腺癌细胞中癌细胞迁移活性的关键分子。 Gen-Ichi等[21]报道NUAK1的高表达在临床上参与了结肠癌的肿瘤进展。此外,NUAK1在乳腺癌、胃癌和卵巢癌等恶性肿瘤中高表达,且NUAK1高表达与肿瘤患者预后较差有关[22-24]。最近,Xu等[25]证明NUAK1通过诱导上皮-间充质转化赋予肝细胞癌多柔比星耐药性,Lu等[26]证明NUAK1的上调促进了神经胶质瘤的侵袭。尽管这些研究发现NUAK1在癌症进展中的重要性,但其在NSCLC中的作用仍有待研究。本研究发现,在NSCLC组织和细胞中NUAK1高表达,NUAK1是miR-30a-5p的靶基因,过表达NUAK1可逆转miR-30a-5p对非小细胞肺癌细胞A549增殖、迁移和侵袭的抑制作用。
综上所述,本研究证实在NSCLC组织和细胞中miR-30a-5p低表达,NUAK1高表达,miR-30a-5p可通过靶向NUAK1来抑制NSCLC细胞A549增殖、迁移和侵袭,进一步揭示了NSCLC发生发展的分子机制,可能为NSCLC的诊断和治疗提供新的靶点。

