大肠癌组织中乙醛脱氢酶1和分化簇133的表达及其临床意义
东 星,王 晶,聂玉辉
大肠癌是临床上常见的消化道肿瘤之一,近年来其发病率有逐年上升的趋势,其病因及发病机制尚不明确[1,2]。乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)是一种参与体内乙醛代谢、维甲酸合成等,具有降解细胞内有毒物质、保护细胞作用的蛋白质[3,4]。分化簇133(cluster of differentiation 133,CD133)被确认是较特异的肿瘤干细胞标志物[5]。研究发现,ALDH1及CD133在肿瘤干细胞的生长、分化、自我更新及保护中具有重要作用,与肿瘤的发生、发展密切相关[6,7]。目前,关于ALDH1及CD133在大肠癌中的作用研究尚不多。本研究检测了ALDH1及CD133在大肠癌、大肠腺瘤及正常大肠黏膜组织中的表达,探讨其与大肠癌发生、发展和预后的关系。
1 资料与方法
1.1 一般资料 收集2011-01至2013-12在解放军总医院第七医学中心普通外科手术切除的60例大肠癌标本作为研究组,另外随机选取25例大肠腺瘤、20例切缘正常的大肠黏膜标本作为对照组。纳入标准:(1)患者年龄18~70岁;(2)签署知情同意书,并具有完整的随访资料。排除标准:(1)妊娠或哺乳期;(2)糖尿病、高血压、慢性肾功能不全等慢性疾病;(3)合并其他恶性肿瘤。
1.2 试剂和方法 采用免疫组织化学SP法。兔抗人ALDH1抗体购自英国 Abcam 公司,抗体稀释浓度为1∶100。兔抗人CD133 单克隆抗体购自美国Abcam公司,抗体稀释度为1∶100。免疫组化试剂盒购自北京中杉金桥生物技术有限公司。
1.3 染色结果判断 在每例切片上随机选取10个高倍视野,每个视野中计数100个细胞,统计阳性细胞数和染色强度占肿瘤细胞总数的百分比,并作综合计分。染色阳性的细胞数评分:<5%计0分,5%~25%计1分,26%~50%计2分,>50%计3分。染色强度评分:无色计0分,淡黄色计1分,淡棕色计2分,棕褐色计3分。最终评分=阳性细胞数×染色强度得分,≥4分为阳性,0~3分为阴性。
1.4 统计学处理 应用SPSS 22.0软件进行统计学分析。组间比较采用χ2检验,相关分析应用Spearman相关分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 ALDH1的表达 ALDH1主要表达于细胞浆内。结果表明,ALDH1在大肠癌组织中的阳性表达率为78.3%,在腺瘤组织中的阳性表达率为54.5%,大肠癌组织中的表达率高于腺瘤组织 (P<0.05)。ALDH1在正常大肠黏膜组织中阳性表达率为15.0%,在腺瘤组织中的阳性表达率高于正常大肠黏膜组织(P<0.05,表1,图1)。
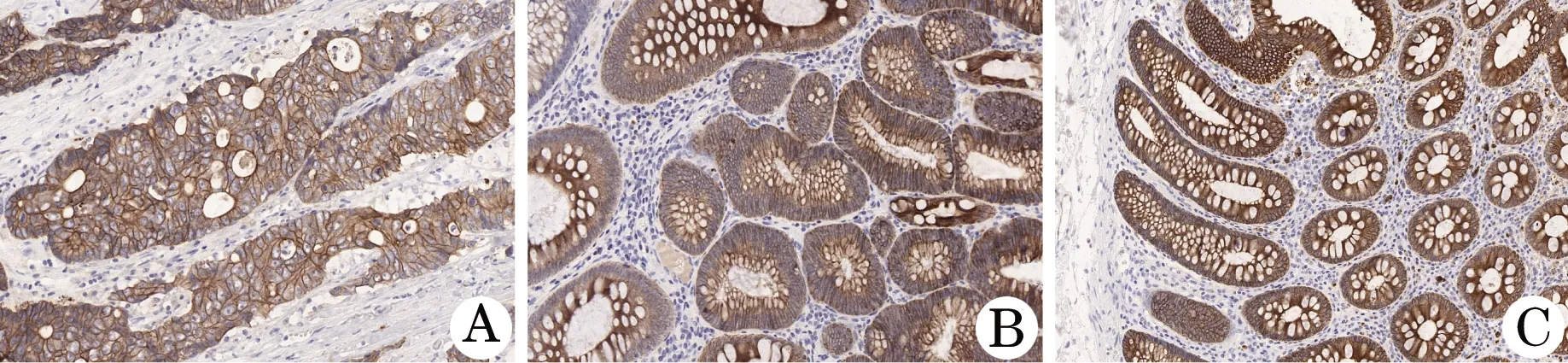
图1 ALDH1在人不同大肠组织中的表达(SP,×200)A.大肠癌;B.大肠腺瘤;C.正常大肠黏膜

表1 大肠癌、大肠腺瘤和正常大肠黏膜组织中ALDH1的表达 (n;%)
2.2 CD133的表达 CD133主要位于表达于细胞膜和胞浆内。结果表明,CD133在大肠癌组织中的阳性表达率为75.0%,在腺瘤组织中的阳性表达率
为48.0%,大肠癌组织中的表达率显著高于腺瘤组织(P<0.05)。CD133在正常大肠黏膜组织中阳性表达率为10.0%,腺瘤组织中的阳性表达率明显高于正常大肠黏膜组织(P<0.05,表2,图2)。

表2 大肠癌、大肠腺瘤和正常大肠黏膜组织中CD133的表达 (n;%)

图2 CD133在人不同大肠组织中的表达(SP,×200)A.大肠癌;B. 大肠腺瘤;C.正常大肠黏膜
2.3 大肠癌中ALDH1和CD133的表达与临床病理参数的关系 大肠癌组织中ALDH1的表达与患者浸润深度、TNM分期、淋巴结转移呈正相关(P<0.05),与分化程度呈负相关 (P<0.05),与年龄、肿瘤大小、性别无相关性。大肠癌组织中CD133的表达与患者浸润深度、淋巴结转移、TNM分期呈正相关(P<0.05),与年龄、肿瘤大小、性别、分化程度无相关性(表3)。
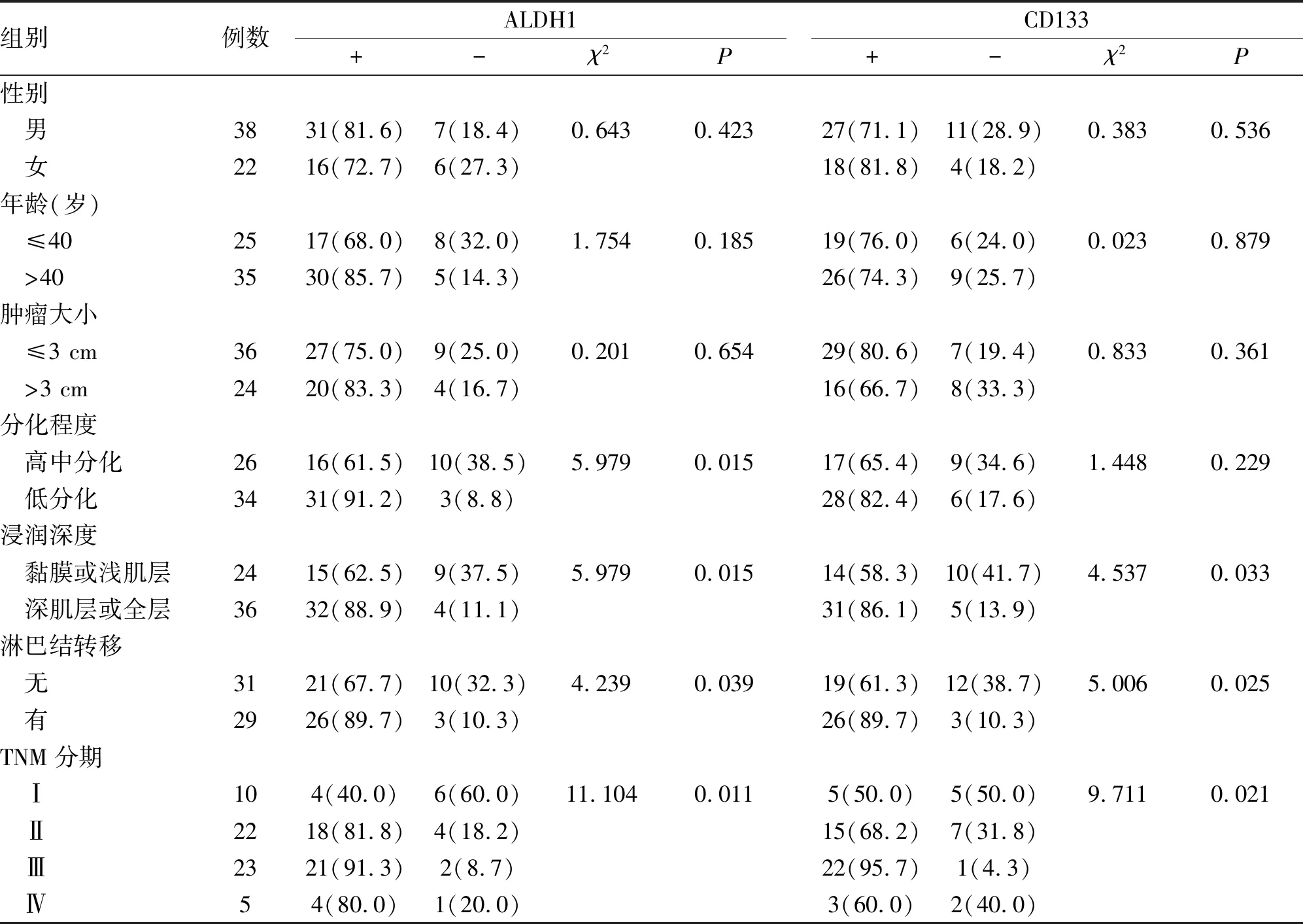
表3 大肠癌中ALDH1和CD133的表达与临床病理参数的关系 (n;%)
2.4 ALDH1与CD133在大肠癌中表达的相关性 ALDH1表达阳性的47例大肠癌患者中,有41例CD133表达亦呈阳性。ALDH1表达阴性的13例中,有9例CD133表达呈阴性,两者之间表达有显著的正相关性(r=0.436,P<0.05)。
2.5 ALDH1和CD133表达与大肠癌患者术后5年生存率的关系 ALDH1表达阳性者术后5年生存率为31.9%(15/47),低于表达阴性者69.2%(9/13)(χ2=4.456,P<0.05)。CD133表达阳性者术后5年生存率为26.7%(12/45),低于表达阴性者66.7%(10/15)(χ2=6.124,P<0.05)。
3 讨 论
ALDH1是ALDH的家族成员之一,广泛分布于人体,其基因位于染色体9q21,有13个外显子,由501个氨基酸组成。ALDH1 可调节乙醛及环磷酰胺的代谢,参与维甲酸的合成,在肿瘤干细胞的生长和分化过程中发挥重要的作用,是干细胞的标志物[8,9]。研究发现,ALDH1在许多肿瘤组织中均有不同水平的表达,如肝癌、肺癌、乳腺癌等[10,11]。Tsai等[12]研究表明,ALDH1与口腔鳞癌的治疗耐受及预后不良有关,放疗治疗后,ALDH1的表达有所降低,提示ALDH1参与了肿瘤的进展。Tian等[13]研究发现,ALDH1可激活丝氨酸蛋白激酶/细胞外信号调节激酶(mitogen-activated protein kinase/extracellular signal-regulated kinase,MEK/ERK)通路,进而使人肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)活性降低,抑制其触发的程序性细胞凋亡反应,导致非小细胞肺癌的发生、发展。Nishikawa等[14]认为,ALDH1 高表达可能通过增强Notch-l通路及音猬因子(Sonic hedgehog,SHH)信号通路表达,参与胃癌化疗耐药,进而为胃癌患者的治疗提供新的靶点。
本研究发现,大肠癌中ALDH1表达率为78.3%,明显高于腺瘤组织的54.5%和正常大肠黏膜组织的15.0%,各组之间比较差异均有统计学意义,与Zhu等[15]研究结论一致,提示ALDH1的高表达可能与大肠癌的发生有关。另外,本研究发现,ALDH1的表达与大肠癌浸润深度、TNM分期、淋巴结转移呈正相关,与分化程度呈负相关,说明ALDH1的异常表达参与了结肠癌的浸袭和转移。本研究还发现,ALDH1表达阳性者术后5年生存率低于表达阴性者,提示ALDH1可能作为判断大肠癌预后的指标之一。
CD133是一种具有干细胞特性的糖蛋白,其基因位于染色体4P15.32,由865个氨基酸组成。Chen等[16]发现,CD133在肝细胞癌中的表达明显高于正常肝组织,且高表达者生存率明显降低,推测其可能是判断肝细胞癌预后的一个独立因素。Weng等[17]在体外培养人胰腺导管腺癌细胞系AsPC-1,使之过表达CD133,结果发现,AsPC-1 CD133细胞具有促进细胞增殖、肿瘤发生、细胞周期进展、黏附、迁移和血管生成的作用;在化疗期间,AsPC-1 CD133细胞存活率增高;敲除CD133基因后,AsPC-1 CD133细胞的增殖和迁移均受到抑制。Liou等[18]认为CD133可通过激活癌基因Survivin,B细胞白血病-淋巴瘤-2基因(B-cell leukemia-iymphoma-2,Bcl-2)的表达,促进细胞的增殖、侵袭及转移。
本研究发现,CD133在正常大肠黏膜组织、大肠腺瘤、大肠癌中的阳性表达率逐渐升高,各组间比较有统计学意义,提示CD133的阳性表达与大肠癌的发生显著相关。另外,本研究显示CD133的阳性表达率越高,大肠癌患者浸润深度越深,越易发生淋巴结转移,恶性程度越高,而且术后5年生存率越低,提示CD133表达升高参与了大肠癌的浸润和转移,可能作为其发生、发展及预后的判定指标。
总之,ALDH1及CD133的表达升高与大肠癌的发生、发展显著相关,且有可能作为判定大肠癌预后的指标之一。但其具体机制尚不明确,有待于进一步的深入研究。

