酸性鞘磷脂酶活性调控及相关药物研究进展
刘思思,杨嘉辉,王 安
(中南大学湘雅公共卫生学院毒理学系,湖南 长沙 410078)
鞘磷脂是质膜的基本成分,涉及跨膜信号的调节。鞘磷脂酶是调节鞘磷脂代谢的关键酶,鞘磷脂可被5种不同的鞘磷脂酶水解为神经酰胺和磷酸胆碱。神经酰胺作为第二信使,可介导细胞炎症、分化、凋亡和衰老等多种生物效应[1-2]。各种鞘磷脂酶基于其最适pH被分为酸性鞘磷脂酶(acid sphingomyelinase,ASM)、中性鞘磷脂酶和碱性鞘磷脂酶,它们有不同的亚细胞分布[3]。其中,ASM占鞘磷脂酶总活性的90%[4],在细胞生物学中的作用也日益明确。近年来,越来越多研究表明,ASM参与神经系统、肺、肝、肾疾病和免疫系统疾病及肿瘤等的发生发展,引起一系列生理和病理改变[2-3,5]。事实上,ASM活性的改变几乎影响着人体所有重要器官的功能[5]。本文综述了ASM活性调控及相关药物研究进展,探讨其在疾病中的防治潜力。
1 ASM分子生物学特点
ASM是一种溶酶体糖蛋白,由位于11号染色体短臂上的鞘磷脂磷酸二酯酶1基因编码,由N端鞘脂激活蛋白结构域、富含脯氨酸的连接体和C端催化结构域3个主要结构域组成,其分子质量为72ku[6-7]。
根据前体蛋白转运途径的不同,将ASM分为溶酶体型ASM(lysosomal ASM,L-ASM)和分泌型ASM(secreted ASM,S-ASM)2种形式[8]。L-ASM主要通过溶酶体途径产生,而S-ASM主要通过组成型分泌途径产生。S-ASM与Zn2+分离,需要添加Zn2+才能被激活[9]。糖基化是ASM活化所必需的,ASM在6个潜在的N-糖基化位点被糖基化后促使酶活化[6]。有研究表明,至少有5个糖基化位点对蛋白质的折叠、输运和防止溶酶体内蛋白质水解有着重要的保护作用[10]。糖基化模式决定着酶的输运,ASM寡糖侧链中甘露糖-6-磷酸残基驱动其向溶酶体转运,体现了甘露糖-6-磷酸受体特异性识别ASM并将其转运至溶酶体的特点[10-11]。许多因素可诱导ASM从溶酶体转移到质膜外层,最后通过水解鞘磷脂分子生成神经酰胺,介导细胞生物学功能。
2 ASM活性变化与相关疾病
人们最初认识ASM是在20世纪60年代末,BRADY等[12]对尼曼-匹克病这种罕见病的研究发现,这是一种由ASM缺陷或过少引起溶酶体贮存障碍的疾病。该病的产生主要由于鞘磷脂磷酸二酯酶1基因突变引起常染色体隐性遗传,最终使鞘磷脂在肝、脾和肺等多个器官累积[13]。据估计,不同国家新生儿ASM缺陷疾病的发病率约为每100万4~6例[14]。临床上主要通过开发重组ASM作为替代进行治疗[15]。
大量文献报道,ASM活性增强与疾病的产生存在密切联系。BECKER等[16]制备自身免疫性脑脊髓炎小鼠模型,研究ASM在多发性硬化症中的作用。结果发现,自身免疫性脑脊髓炎模型小鼠血清中ASM活性增加,神经炎症反应明显。LEE等[17]在实验中发现,阿尔茨海默病模型小鼠的大脑中ASM活性显著增加,从大脑中分离神经元和小胶质细胞,检测到神经元中ASM活性增加程度明显大于小胶质细胞,提示阿尔茨海默病模型小鼠的大脑中ASM主要蓄积在神经元。LI等[18]使用棕榈酸处理大鼠主动脉内皮细胞,研究ASM是否调节2型糖尿病血管内皮细胞的胰岛素抵抗,发现ASM激活可使糖尿病大鼠血管内皮细胞胰岛素抵抗增强,诱发糖尿病血管并发症。此外,研究发现,ASM是肝细胞凋亡和肝星状细胞活化的重要调控因子,ASM激活易引发脓毒症肝功能障碍[19]。
ASM被认为是一种临床生物标志物[20]。近年来人群调查发现,急性冠状动脉综合征[21]、急性川崎病[22]、非酒精性脂肪肝[23]、先兆子痫[24]、抑郁症[25]和帕金森病患者[26]血清中ASM活性显著升高。不同的是,卵巢癌患者中ASM表达比非卵巢癌患者低[20]。表明ASM的活性变化可能与多种常见疾病有关,且越来越多的学者提出通过调控ASM的活性来治疗相关疾病。
3 激活ASM活性的因素
ASM的激活促使大量神经酰胺在细胞膜堆积,引起机体代谢紊乱、炎症反应或细胞凋亡,最终导致疾病发生[10]。综合近年来体内外实验和临床资料,ASM激活诱导神经酰胺累积,促使肿瘤细胞快速死亡,可作为潜在抗癌剂,用于白血病、胃癌和结肠癌等肿瘤的治疗[27-28]。环境因素、药物因素及其他因素是激活ASM的主要原因,ASM在其影响下活性增强。
3.1 环境因素
ASM作为外源刺激的介质,是外源环境稳定的一个重要因素。细菌和病毒感染如金黄色葡萄球菌[29]、铜绿假单胞菌[30]、脑膜炎奈瑟球菌[31]、肺炎链球菌[32]、分枝杆菌属[33]、埃博拉病毒[34]、柯萨奇病毒B3[35]和鼻病毒[36]等可激活ASM,使大量神经酰胺累积于细胞膜,脂筏结构聚簇,产生炎症反应或使细胞发生凋亡,导致疾病发生。长期或高剂量暴露在电离辐射[37]、紫外线[38]、噪声[39]或重金属[40]的环境下,ASM迅速活化,释放到细胞表面,水解膜上鞘磷脂的磷酸二酯键,产生神经酰胺,通过一系列信号转导,造成机体损伤。流行病学调查显示,抑郁症患者外周血单核细胞和血浆中ASM活性增加,可能与慢性社会心理压力相关[41]。REICHEL等[42]通过建立慢性心理应激模型,诱导小鼠产生慢性社会心理压力。结果发现,模型小鼠的肝和血清中ASM活性均升高,且肝炎症浸润,鞘磷脂代谢紊乱。表明慢性社会心理压力可能通过增强ASM活性进而影响机体健康。
3.2 药物因素
外源性因素是促使ASM活性增强的关键因素之一,而药物因素的影响也不能忽视。乙醇是一种精神药物,摄入过量可激活ASM生成神经酰胺介导神经元细胞死亡[43]。REICHEL等[44]对酒精依赖患者血浆进行ASM活性测定,结果与健康者比较,酒精依赖患者中S-ASM活性高出3倍,提示S-ASM活性增强可能与乙醇诱导脂质改变有关。研究发现,利用高糖腹透液治疗终末期肾病,常引起透析液的生物不相容性,造成腹膜损伤[45]。汤天凤等[46]通过动物实验探讨高糖腹透液诱导腹膜间皮细胞凋亡的作用机制,发现高糖腹透液可激活ASM诱导腹膜间皮细胞凋亡,导致腹膜受损。李燕飞等[47]实验发现,百草枯致小鼠肺纤维化的过程中伴随着ASM活性的升高,肺部组织出现炎症细胞浸润和胶原沉积,表明ASM可能参与百草枯致肺纤维化的病理生理过程。此外,脂多糖也可介导小鼠肺损伤,导致肺弹性下降,肺泡萎陷;脂多糖给药2~4 h后,ASM的活性达到峰值[48]。
有趣的是,ASM与肿瘤的发生和发展有一定的相关性。综合近几年体内、外和临床试验结果,一些抗肿瘤药物包括全反式维甲酸[49]、顺铂[50]、吉西他滨[51]、吴茱萸碱[52]、喹乙醇[53]、白藜芦醇[54]、鞣花酸[55]和庆大霉素[56]等通过激活ASM,提高神经酰胺含量,使肿瘤细胞死亡,具有抗肿瘤作用。其中,全反式维甲酸作为ASM激活剂,在人急性早幼粒细胞白血病细胞骨髓分化过程中可使ASM表达增强4倍,随后产生大量神经酰胺堆积于急性早幼粒白血病细胞内,应用全反式维甲酸8 h后,ASM水平明显增高,24 h达到最高值[49],表明神经酰胺介导的信号通路,尤其是ASM的作用,很可能是肿瘤治疗的一个突破口。
3.3 其他
除环境因素和药物因素诱导ASM活性外,其他因素也会激活ASM。研究发现,许多受体和非受体通过激活ASM介导细胞应激形式,启动一系列生物化学反应。现已知受体如白细胞介素1β[57]、白细胞介素 6[58]、淋巴细胞功能相关抗原1[59]、白细胞分化抗原 95[60]、白细胞分化抗原 40[61]、白细胞分化抗原28[62]等可使ASM堆集于质膜中,产生富含神经酰胺的结构域,进而激活下游信号分子,导致细胞纤维化、炎症反应或使机体免疫下降等相关效应产生。另有研究报道称,血小板活化因子[63]、肿瘤坏死因子[8]和核因子 E2 相关因子[64]可迅速激活ASM,影响溶酶体功能,这些细胞因子可在转录或翻译水平上调节ASM,或使其受翻译后修饰的影响。ATP也是调控ASM活化的一种形式。WANG等[65]通过体内实验发现,ATP上调ASM活性,促使细胞表面组织因子解密和微泡脱落,严重可致血栓性疾病发生。此外,SUN等[66]研究表明,活性氧自由基可能通过诱导蛋白二聚体来激活ASM,引起线粒体功能障碍,导致细胞周期阻滞,最终走向凋亡,但尚未明确活性氧是否直接调节酶的活性,或是由其他中间体完成。
4 抑制ASM活性的因素
ASM活性抑制具有抗凋亡和保护细胞的作用,可潜在地用于治疗与ASM活性增强相关的疾病,如阿尔茨海默病、抑郁症、多发性硬化症、感染性疾病和帕金森病等[8,67],其抑制主要受药物因素和其他因素的影响。
4.1 药物因素
ASM直接抑制剂是一种直接作用于酶靶标具有生物活性的化合物,低浓度即可抑制酶活性,对ASM活性增强相关的疾病损害具有保护作用[67]。α-倒捻子素(alpha-mangostin)是一种来自于山竹果皮上的提取物,可直接抑制ASM活性。LUO等[68-69]发现,α-倒捻子素可减少内质网应激诱导的肾细胞凋亡,减轻糖尿病肾损伤。基于α-倒捻子素,研究者们发现1,3,6,7-四羟基黄酮衍生物[70]、1,3,6,7-四羟基呫吨酮衍生物[71]和N-羟基-3-烷氧基苯甲酰胺[72]能更有效地抑制ASM活性,对优质化妆品的开发研究及ASM相关疾病药物的制备具有重要意义。此外,磷脂酰肌醇-3,5-双磷酸盐衍生物[73]、双磷酸盐[74]和苯并吡喃酮衍生物的类似物[13]也可直接抑制ASM活性,具有抗细胞凋亡、细胞分化和增殖的作用。由于直接抑制ASM活性药物的通用支架很难找到,且其分子质量大,不易通过生物膜,作为临床药用还需进一步研究和验证[75]。ASM晶体结构的解析[6],将为今后开发高效的小分子直接抑制剂作为候选药物提供依据。
KORNHUBER等[76]通过体外实验检测各种药物抑制ASM活性的能力,最终72种可使ASM活性降低超50%的药物被列为ASM功能抑制剂(functional inhibitors of ASM,FIASM),其中42种可使ASM活性降低70%~90%。FIASM主要积累于溶酶体,促使ASM从溶酶体内膜脱离,经蛋白水解降解失活[68]。大多数FIASM药物被列入世界卫生组织批准药物清单,应用于ASM相关的临床疾病治疗[67]。这些药物虽然高效,但存在明显的副作用和并发症风险。近几年来,研究者们通常使用ASM功能性抑制药物,如阿米替林[77]、丙咪嗪[78]、地西帕明[79]、氟西汀[80]、帕罗西汀[24]和奋乃静[81]等来抑制ASM活性。研究外界刺激对宿主疾病损害的减轻程度及其机制,有望进一步推行到非临床或临床试验中,为相关疾病诊治提供参考意义。此外,一些新药物,包括芬戈莫德[82]、芬地林[83]、扇贝多肽[84]、青蒿琥珀[85]和褪黑素[86]等可降低ASM活性,介导下游信号通路,减少外源刺激诱导的机体损害,其具体作用机制还有待深入研究。
4.2 其他
动物实验中通过敲除ASM或细胞实验中运用RNA干扰技术,通过质粒构建siRNA表达载体转染细胞,皆可抑制ASM基因表达[87-88]。ASM调节自噬,自噬也可抑制ASM活性。氯喹是一种自噬通量抑制剂,可抑制ASM活性[89]。研究发现,ASM功能性抑制剂通常是一种带弱碱性和阳离子两亲性质的化合物,具有高pKa和高logP值,能较好地通过血脑屏障,在此条件下,ASM才具有潜在的抑制作用[68]。
5 结语
综上所述,ASM调节细胞增殖、信号转导和细胞凋亡,其活性的变化与疾病间存在密切联系。ASM活性调控受到多种因素的影响(表1),ASM的激活是其发挥作用的关键,其激活受外源性环境因素和药物因素和其他因素的影响,但影响体内ASM活化的分子机制仍有待研究。研究者们已发现,通过抑制ASM活性可减轻相关疾病带来的机体损害,其抑制主要受药物因素影响。ASM直接抑制剂可直接抑制酶活性,但需要准确的目标定位才具有生物活性。而FIASM对ASM无特定影响,在影响ASM活性的同时也作用于其他靶标,产生许多副作用。在今后的工作中,研究ASM调控外界刺激与宿主细胞作用的同时,应以ASM活性的改变是否对宿主有益或有害为出发点,开发高效的小分子直接抑制剂或不影响其他靶标的ASM功能性药物,发展新的治疗策略。
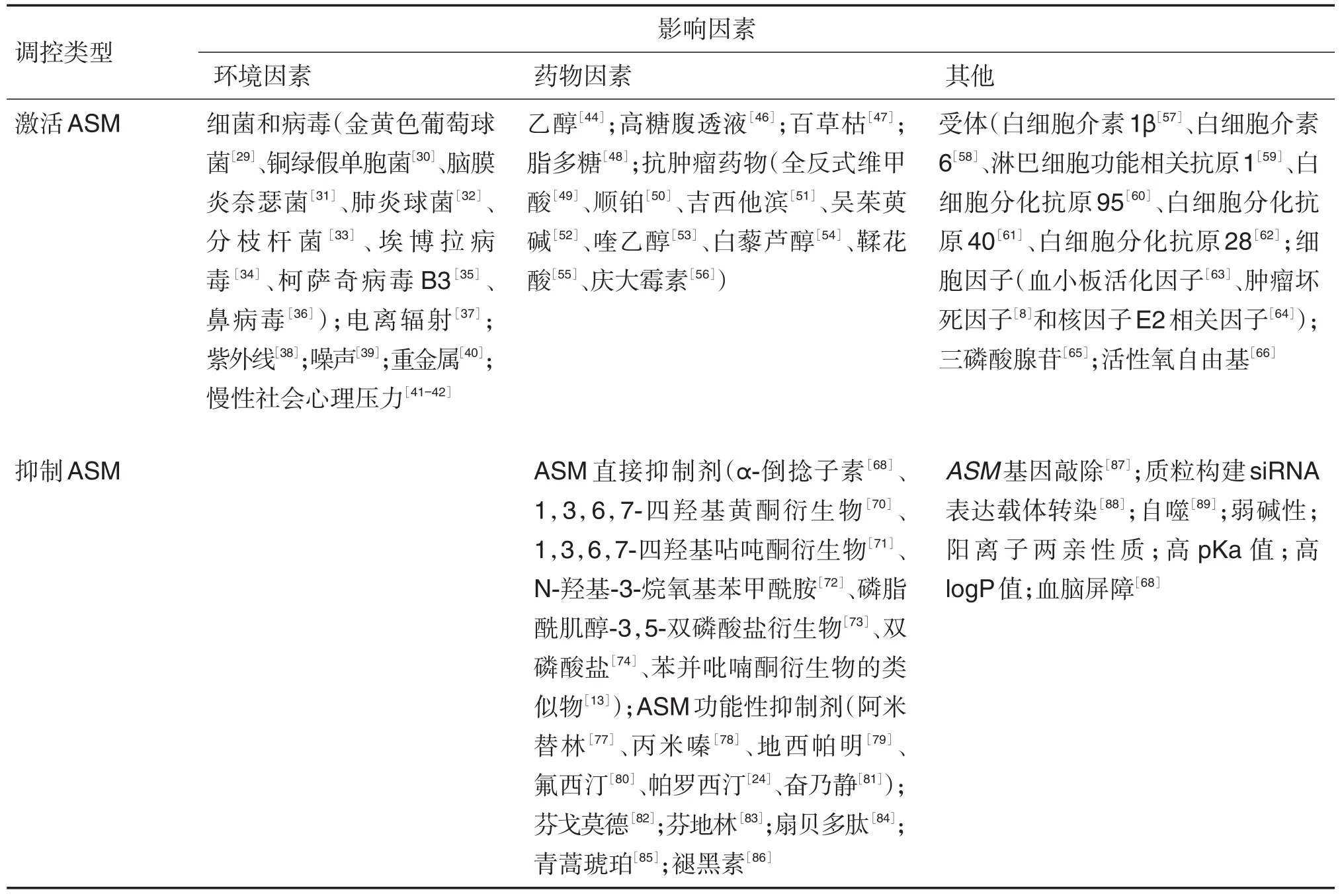
表1 酸性鞘磷脂酶(ASM)活性调控及其影响因素

