麦角甾醇与吉非替尼联合用药协同抑制非小细胞肺癌A549和PC-9细胞增殖
米完完,黄 挺,张梦迪,黄绳武
(1.浙江中医药大学药学院,浙江 杭州 311402;2.杭州红十字会医院普外科,浙江 杭州 310003)
由于癌症发病率和死亡率的持续增高,目前仍然是世界上重要的公共卫生问题。在2018年,我国共有430万新发肿瘤病例和290万癌症死亡病例,肺癌发病率最高,且死亡率也排在各种不同肿瘤类型疾病之首[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占85%[2],传统的放、化疗效果一直不理想,缓解率仅约30%,大多数患者就诊时,往往已处于中晚期,错过了手术治疗的最佳时期。
吉非替尼(gefitinib,GEF)是表皮生长因子受体(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR)酪氨酸激酶抑制剂,一线治疗EGFR突变的晚期NSCLC[3-4]。其作用机制主要通过与ATP竞争和EGFR的结合,通过丝氨酸苏氨酸激酶(serine-threonine kinase,Akt)信号通路等途径阻断EGFR信号传导通路,抑制自身磷酸化以及活化,阻断表达EGFR的肿瘤细胞生长,阻断磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/Akt等下游信号通路,诱导肿瘤细胞凋亡,起到抗肿瘤作用[5-7]。然而,即使是GEF治疗有效者,多数患者在治疗后10~14个月后都会发生不同程度的耐药现象,最终将导致药物疗效降低[8-10]。2018年底,国家对进口药GEF实行零关税,并被纳入医保行列,此举使GEF在NSCLC患者中广泛使用。但面临的问题是GEF耐药出现的频率大幅度增加。因此,增加GEF对肺癌细胞的敏感性,减小GEF使用剂量,预防与克服GEF的耐药性显得尤为迫切。
本实验室前期采用真菌牛樟芝开展体外抗肿瘤作用研究,筛选出其中的麦角甾醇(ergosterol,ERG)成分对肺腺癌A549细胞具有较好的细胞增殖抑制作用。同时实验室发现ERG和顺铂联用在A549细胞上具有较好的促进细胞凋亡的作用。在体外研究的基础上,实验室开发了ERG联合顺铂主动靶向双载药脂质体递药系统[11-13],体内外实验证实了其具有较好的靶向抗肺癌作用。
本研究采用2种细胞系(分别对GEF敏感的PC-9细胞和耐药的A549细胞)进行ERG对肿瘤细胞的抑制作用研究。探讨ERG与GEF联用是否具有协同抗肺癌的作用,能否针对敏感细胞株达到增效效果,能否增加耐药细胞株的敏感性,以及初步探讨其作用机制,为进一步研究体内抗肿瘤活性提供实验依据。
1 材料与方法
1.1 细胞、试剂和主要仪器
人肺癌A549细胞(中国科学院生命科学研究院细胞库),人肺癌细胞PC-9(上海名劲生物科技有限公司)。GEF原料药(南京安格医药化工有限公司,批号:170301);ERG原料药(批号:BCBN4049V),二甲基亚砜(批号:WXBB8079V)(美国Sigma公司);MTT(批号:B0016K012500),0.22 μm PVDF 膜(美国Biosharp公司);0.25%胰蛋白酶(杭州诺森德生物技术有限公司,批号:ZL101818);优级胎牛血清(fetal bovine serum,FBS)(澳洲Gemini公司,批号:A37F00H);RPMI 1640(美国Gibco公司,批号:8118009);青-链霉素溶液(批号:170907-0503)、Hoechst 33258凋亡染色试剂盒、PMSF(100 mmol·L-1,批号:090117171114)、BCA蛋白浓度测定试剂盒(增强型,批号:071417171026)、SDS-PAGE蛋白上样缓冲液(批号:051017170702)、SDS-PAGE凝胶配制试剂盒(批号:111517171113)(上海碧云天生物技术有限公司);Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒(批号:7235944)、PI/RNase染色液(批号:7166582)(美国BD公司);0.22 μm PVDF膜(美国Biosharp公司);β肌动蛋白、EGFR、Akt小鼠抗单克隆抗体,p-Akt、p-EGFR兔多克隆抗体(美国ImmunoWay Biotechnology公司);山羊抗小鼠荧光二抗,山羊抗兔荧光二抗(美国LI-COR公司)1300 SERIES A2生物安全柜(美国赛默飞世尔公司);ECLIPSE TS100/100-F倒置生物显微镜(日本尼康公司);Invitrogen EVOS FL细胞成像工作站、Thermo 3111型CO2培养箱,Thermo 905超低温冰箱(美国赛默飞世尔公司);Eppendorf 5427R台式高速冷冻离心机、Eppendorf 5702台式离心机、微量移液枪(德国Eppendorf公司);SX-500高压灭菌锅(日本TOMY公司);Cryosystem 750液氮罐(美国MVE公司);SynErgosteroly H1MFD多功能酶标仪(美国BioTek公司);guava easyCyte 6HT-2L微流式细胞分析仪(美国默克公司);Mini-PROTEAN Tetra小型垂直电泳槽(美国Bio-Rad公司);Odyssey Clx双色红外激光成像系统(美国LI-COR公司)。
1.2 MTT法检测细胞存活
调整对数生长期A549/PC-9细胞悬液浓度为5×107L-1。100×g离心5 min后,吹打混匀成单细胞悬液,每孔加100 μL于96孔培养板,于37℃,5%CO2培养箱中培养至细胞融合80%后加药处理。其中各个给药组加100 μL不同浓度不含FBS的药物溶液,正常对照组加100 μL不含FBS培养液。每浓度各设5复孔,分别于加药后第24,48和72 h后进行MTT检测。每孔加MTT 5 g·L-1溶液20 μL,37℃孵育4 h后,采用酶标仪于492 nm处测定各孔吸光度值(A492nm),在570 nm处验证。计算各组各浓度下的抑制率(IR),采用q值判断ERG和GEF联用的性质。本实验重复3次进行。IR(%)=(对照组A492nm-实验组A492nm)/对照组A492nm×100%。q=EAB(/EA+EB-EA×EB)。
式中EA和EB为各药单用IR,EAB为两药合用IR。q>1.15为协同作用,0.85~1.15为相加作用,<0.85为拮抗作用。
1.3 Hoechst 33258染色检测细胞凋亡
取对数生长期A549非小细胞肺癌细胞,实验分为 4 组:对照组、ERG 20 μmol·L-1、GEF 20 μmol·L-1和 ERG+GEF(20+20)μmol·L-1。调整对数生长期A549细胞悬液密度为1.5×108L-1。100×g离心5 min后,吹打混匀成单细胞悬液,每孔加2 mL含药培养基于6孔培养板,每药3复孔。于37℃,5%CO2培养箱中培养至细胞融合80%后加药处理。48 h后PBS清洗3次,加4%多聚甲醛室温固定20 min。吸出4%的多聚甲醛后用PBS小心清洗3次,加Hoechst 33258染液,37℃染色30 min。弃染色液后用PBS清洗3次,于荧光显微镜下观察细胞核形态。本实验重复3次进行。
取对数生长期PC-9非小细胞肺癌细胞,实验分为4组:对照组、ERG 40 μmol·L-1、GEF 5 μmol·L-1和 ERG+GEF(40+5)μmol·L-1,细胞悬液密度为2×108L-1,其他操作同上。
1.4 流式细胞术测定细胞凋亡率
采用AnnexinⅤ-PI双染流式细胞术检测各组凋亡情况。将对数生长期的A549细胞调整密度为1.5×108L-1。100×g离心5 min后,吹打混匀成单细胞悬液,每孔加2 mL给药培养基于6孔培养板,设置每个药每浓度3复孔,ERG(10,20,40)μmol·L-1,GEF(10,20,40)μmol·L-1,ERG+GEF(10+10,20+20,40+40)μmol·L-1。于37℃,5%CO2培养箱中培养至细胞融合80%后加药处理48 h后收集上清及细胞,PBS洗涤3次,100×g离心5 min,用100 μL 1×流式缓冲液重悬,每个给药孔加 5 μL FITC与5 μL PI荧光染料,于室温下黑暗处孵育15 min后,每孔继续加400 μL 1×缓冲液,用涡旋混合器低转速下混合均匀,过400目筛网后,1 h内采用流式细胞仪检测细胞凋亡率。实验重复3次。
取对数生长期PC-9细胞,设每药每浓度3复孔,ERG(20,40,80)μmol·L-1,GEF(2.5,5,10)μmol·L-1,ERG+GEF(20+2.5,40+5,80+10)μmol·L-1。其他操作同上。
1.5 流式细胞术测定细胞周期
将对数生长期的A549细胞调整为1.5×108L-1,接种于6孔培养板内,于37℃,5%CO2培养箱中培养至细胞融合80%后加药处理,设ERG 40 μmol·L-1组、GEF 40 μmol·L-1组和 ERG+GEF(40+40)μmol·L-1组。药物作用48 h后,收集上清及细胞,100×g离心10 min,PBS洗涤1次后,用75%冰乙醇固定过夜,离心弃乙醇,用PBS洗涤2次。弃PBS,每个样本加0.5 mL PI染色液室温避光染色15 min,置流式细胞仪上测定各周期细胞比例。本实验重复3次。
取对数生长期PC-9细胞,设ERG 40 μmol·L-1、GEF 5 μmol·L-1和ERG+GEF(40+5)μmol·L-1,每浓度3复孔。其他操作同上。
1.6 Western 印迹法检测 Akt,p-Akt,EGFR 和p-EGFR蛋白表达
将对数生长期的A549/PC-9细胞密度调整为2×108L-1接种于6孔培养板内,A549细胞分别设GEF 20 μmol·L-1、ERG 20 μmol·L-1、ERG+GEF(20+20)μmol·L-1组和对照组,PC-9细胞分别设GEF 5 μmol·L-1、ERG 40 μmol·L-1、ERG+GEF(40+5)μmol·L-1组和对照组加药处理48 h后提取细胞总蛋白,并用BCA试剂盒测定其浓度。调整各组总蛋白浓度相同后将蛋白质样品与5×上样缓冲液混合后于100℃中煮沸5 min,加相应浓度的SDS-PAGE胶中电泳至溴酚蓝距离胶底部1 cm处即停止电泳,然后转至0.22 μm PVDF膜上,Western封闭液封闭1 h,稍洗后分别加适量一抗Akt(1∶1000),p-Akt(1∶500),EGFR(1∶1000),p-EGFR(1∶500),β肌动蛋白(1∶4000)于4℃下孵育过夜,Western洗涤液漂洗3次,每次5 min,加对应来源的荧光二抗常温孵育2 h,Western洗涤液洗膜3次,每次5 min,采用Odyssey红外荧光扫描成像系统扫膜,采用Image J软件对蛋白印迹条带进行积分吸光度(integrated absorbance,IA)分析。待测蛋白相对表达水平用目标蛋白IA值和β肌动蛋白蛋白IA之比表示。本实验重复3次。
1.7 统计学分析
实验结果数据均用±s表示,实验重复3次。采用SPSS 17.0软件进行统计学处理,采用单因素方差分析法,两组间比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 麦角甾醇与吉非替尼联合用药对人肺癌A549和PC-9细胞的增殖抑制作用
人肺癌A549细胞增殖抑制实验结果(图1)显示,在 24,48 和 72 h,GEF 5~160 μmol·L-1和ERG 5~160 μmol·L-1均能抑制A549细胞的生长,且呈浓度依赖性(ERG:r=0.898,r=0.924,r=0.935;GEF:r=0.988,r=0.884,r=0.793)。与ERG和GEF单药各浓度组相比,两药联用相应浓度组对A549细胞的增殖抑制率提高(P<0.01)。作用24和48 h时,ERG+GEF联用浓度分别为(5+5)μmol·L-1,(10+10)μmol·L-1,(20+20)μmol·L-1时,两药联用具有协同作用;作用72 h时,两药联用ERG+GEF(5+5)μmol·L-1具有协同作用。ERG+GEF(20+20)μmol·L-1是两药具有协同作用的最大浓度,浓度加大,两药仅仅只有相加作用(图1D)。因此,后续 A549 细胞实验以 ERG 20 μmol·L-1和 GEF 20 μmol·L-1作为中间浓度进行。
人肺癌PC-9细胞增殖抑制实验结果(图2)显示,在24,48和72 h时,GEF 0.625~20 μmol·L-1和ERG 5~160 μmol·L-1均能抑制PC-9 细胞的生长,该抑制作用呈浓度依赖性(ERG:r=0.925,r=0.978,r=0.869;GEF:r=0.872,r=0.859,r=1.0)。与各单用药组相比,ERG+GEF联用各组PC-9细胞的增殖抑制率均提高(P<0.01)。作用24 h与48 h时,ERG和GEF联用浓度分别为(5+0.625)μmol·L-1,(10+1.25)μmol·L-1,(20+2.5)μmol·L-1,(40+5)μmol·L-1时,两药联用具有协同作用,ERG+GEF(40+5)μmol·L-1时具有协同作用的最大浓度,浓度加大,两药仅仅只有相加作用(图2D)。因此,后续PC-9细胞实验以ERG+GEF(40+5)μmol·L-1作为中间浓度进行。

Fig.1 Effect of ergosterol(ERG)combined with gefitinib(GEF)on proliferation of A549 cells and their synergy index.Human lung cancer cells A549 were treated with ERG 5-160 μmol·L-1(A),GEF 5-160 μmol·L-1(B)or ERG+GEF combination(C)for 24,48 or 72 h,respectively.D:synergy index of ERG+GEF combination at 24,48 or 72 h.±s,n=5.**P<0.01,compared with corresponding concentration of GEF group;##P<0.01,compared with corresponding concentration of ERG group.

Fig.2 Effect of ERG combined with GEF on proliferation of PC-9 cells and their synergy index.PC-9 cells were treated with ERG 0.625-20 μmol·L-1(A),GEF 5-160 μmol·L-1(B)or ERG+GEF combination(C)for 24,48 or 72 h,respectively.D:synergy index of ERG+GEF combination at 24,48 or 72 h.±s,n=5.**P<0.01,compared with corresponding concentration of GEF group;##P<0.01,compared with corresponding concentration of ERG group.
2.2 麦角甾醇与吉非替尼联合用药对人肺癌A549,PC-9细胞核形态的影响
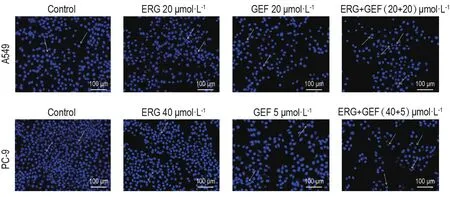
Fig.3 Effect of ERG combined with GEF on A549 and PC-9 cells on nuclear morphology by Hoechst 33258 staining.Cells were treated with ERG and GEF according to groups for 48 h.Arrows show the changes of nuclear morphology.
Hoechst 33258染色结果(图3)显示,正常对照组的A549和PC-9细胞发出均匀的蓝色荧光,细胞核形态呈圆形或椭圆形,大小均一,无明显形态学改变;ERG组与GEF组细胞出现核分叶与核碎裂凋亡样特征;两药联用组细胞核具有明显的核形态变化,核分叶与核碎裂,凋亡样小体,细胞核大小不一等凋亡样特征(图中箭头指向处)。
2.3 麦角甾醇与吉非替尼联用对细胞凋亡和细胞周期的影响
2.3.1 麦角甾醇与吉非替尼联用对细胞凋亡的影响

Fig.4 Effect of ERG combined with GEF on A549 cell apoptosis by flow cytometry.A549 cell were treated with ERG 10,20 and 40 μmol·L-1,GEF 10,20 and 40 μmol·L-1,and ERG+GEF(10+10),(20+20),(40+40)μmol·L-1respectively for 48 h.B was A549 cell apoptotic rate in A.±s,n=3,**P<0.01,compared with control group;##P<0.01,compared with corresponding concentration of ERG group;△△P<0.01,compared with corresponding concentration of GEF group.
A549细胞凋亡的流式结果见图4。与对照组相比,ERG 20,40 μmol·L-1及GEF各浓度的凋亡率升高(P<0.01)。与相应浓度GEF,ERG单药组相比,ERG+GEF联用(10+10)μmol·L-1和(40+40)μmol·L-1组细胞凋亡率升高(P<0.01)。
PC-9细胞凋亡的流式结果(图5)显示。与对照组相比,ERG各浓度组及GEF各浓度组的凋亡率显著升高(P<0.01)。与GEF 5,10 μmol·L-1和ERG 40,80 μmol·L-1单药组相比,ERG+GEF(40+5)μmol·L-1和(80+10)μmol·L-1组细胞凋亡率显著升高(P<0.01)。
2.3.2 麦角甾醇与吉非替尼联用对细胞周期的影响
A549细胞周期的流式结果见图6。与对照组G0/G1期细胞比例(56.65±0.13)%相比,ERG 20 μmol·L-1组(58.97±0.94)%及GEF 20 μmol·L-1(72.60±0.81)%单药组G0/G1期细胞比例均升高(P<0.05,P<0.01),表明对A549细胞产生了明显的G0/G1期阻滞。与对照组G2/M期比例(29.63±2.15)%相比,ERG 20 μmol·L-1组(32.05±2.27)%细胞比例显著升高(P<0.01),表明ERG对A549细胞产生明显的G2/M阻滞。与ERG组相比,两药联用组G0/G1期细胞比例显著升高(P<0.01),G2/M期细胞比例无差异,S期细胞比例显著降低(P<0.05),与GEF组相比,两药联用组G0/G1期细胞比例显著降低(P<0.01),G2/M期细胞比例显著升高(P<0.01),S期细胞比例显著升高(P<0.05)。表明两药联用改变了A549细胞G0/G1,G2/M,S期的细胞比例,分别为(65.16±1.55)%,(8.74±0.92)%,(26.10±1.11)%。
PC-9细胞周期的流式结果(图7)显示,与对照组S期(19.13±1.20)%及G2/M期(9.64±1.25)%细胞比例相比,ERG 40 μmol·L-1组 S 期(26.93±2.02)%及 G2/M期比例为(13.58±1.80)%细胞比例均显著升高(P<0.01),说明ERG对PC-9细胞周期产生明显的S期及G2/M期阻滞。而GEF 5 μmol·L-1组 G0/G1期细胞比例(78.35±1.58)%比对照组(71.23±0.44)%显著升高(P<0.01),说明 GEF 5 μmol·L-1可阻滞细胞于 G0/G1期。与 GEF 组相比,两药联用时,PC-9细胞G0/G1期细胞比例(78.91±1.86)%,S期细胞比例为(13.18±3.16)%,G2/M期细胞比例(8.74±0.92)%无差异。表明两药联用未使PC-9细胞周期发生改变。

Fig.5 Effect of ERG combined with GEF on PC-9 cell apoptosis by flow cytometry.PC-9 cell were treated with ERG 20,40 and 80 μmol·L-1,GEF 2.5,5 and 10 μmol·L-1and ERG+GEF(20+2.5),(40+5),(80+10)μmol·L-1respectively for 48 h.B was PC-9 cell apoptotic rate in A.±s,n=3.**P<0.01,compared with control group;##P<0.01,compared with corresponding concentration of ERG group;△△P<0.01,compared with corresponding concentration of GEF group.
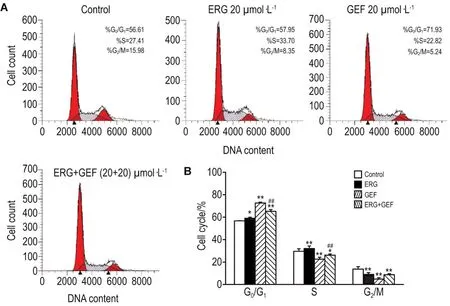
Fig.6 Effect of ERG combined with GEF on A549 cell cycle by flow cytometry.See Fig.3 for the cell treatment.±s,n=3.*P<0.05,**P<0.01,compared with the control group.##P<0.01,compared with ERG group;△P<0.05,△△P<0.01,compared with GEF group.
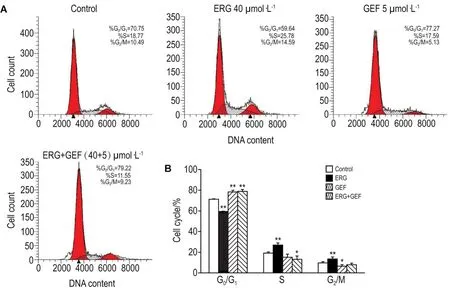
Fig.7 Effect of ERG combined with GEF on PC-9 cell cycle distribution by flow cytometry.See Fig.3 for the cell treatment.±s,n=3.*P<0.05,**P<0.01,compared with control group.
2.4 麦角甾醇与吉非替尼联用对Akt,p-Akt,EGFR和p-EGFR蛋白表达的影响
Western印迹结果(图8)显示,在A549细胞中,与对照组相比,GEF 20 μmol·L-1组的p-Akt/Akt和p-EGFR/EGFR蛋白表达水平降低(P<0.01,P<0.05);ERG 20 μmol·L-1组的p-Akt/Akt和p-EGFR/EGFR蛋白表达水平无明显变化;与GEF单药相比,两药联用组(20+20 μmol·L-1)的p-EGFR/EGFR蛋白表达水平显著降低(P<0.01)。表明ERG和GEF联用能更好抑制EGFR相关信号通路相关蛋白的表达。
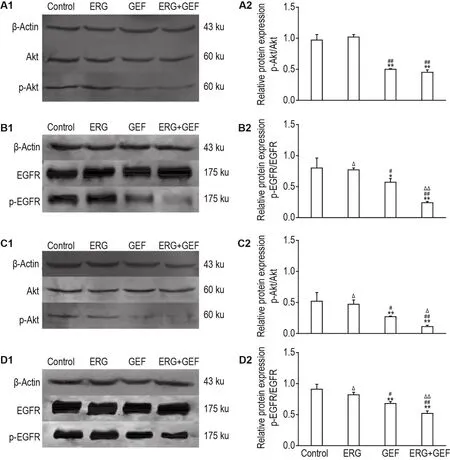
Fig.8 Effect of ERG combined with GEF on protein expression of p-Akt/Akt and p-EGFR/EGFR in A549 and PC-9 cells by Western blotting.See Fig.6 and 7 for the cell treatment.A2-D2 were semi-quantitative results of A1-D1,respectively.±s,n=3.*P<0.05,**P<0.01,compared with control group;#P<0.05,##P<0.01,compared with ERG group;△P<0.05,△△P<0.01,compared with GEF group.
在PC-9细胞中,与对照组相比,GEF 5 μmol·L-1组的p-Akt/Akt和p-EGFR/EGFR蛋白表达水平均降低(P<0.01),ERG 40 μmol·L-1组的p-Akt/Akt与p-EGFR/EGFR蛋白表达水平无显著差异;与GEF 5 μmol·L-1单药组相比,两药联用后 p-Akt/Akt和p-EGFR/EGFR蛋白表达显著下调(P<0.05,P<0.01)。表明ERG和GEF联用能更好抑制EGFR和Akt信号通路相关蛋白的表达。
3 讨论
本研究结果表明,对于GEF耐药细胞A549细胞,在GEF 5~160 μmol·L-1和ERG 5~160 μmol·L-1均能抑制A549细胞的生长,且呈浓度依赖性,在一定浓度下具有协同作用。对于GEF敏感细胞PC-9细胞,在 GEF 0.625~20 μmol·L-1和 ERG 5~160 μmol·L-1均能抑制PC-9细胞的生长,且呈浓度依赖性,在一定浓度下具有协同作用。Hoechst 33258染色结果显示,两药联用细胞凋亡样特征明显。采用流式细胞仪检测发现,ERG与GEF联用的凋亡率明显高于ERG和GEF单用。且随着药物浓度的增加,细胞凋亡率呈现增加的趋势,有个别组由于两药联用组凋亡率标准差较大,未呈现显著差异。在考察细胞周期时发现,对于A549细胞,两药联用改变了G0/G1,G2/M和S期细胞比例,主要将细胞阻滞在G0/G1期。对于PC-9细胞,两药联用未改变G0/G1,G2/M和S期细胞比例。表明在不同肺癌细胞系,ERG与GEF联用抑制肺癌细胞凋亡的机制不同。在A549细胞中,ERG和GEF联用能更好抑制EGFR相关信号通路的表达。在PC-9细胞中,ERG和GEF联用能更好抑制EGFR,Akt相关信号通路的表达。
本研究的目的旨在探讨ERG与GEF联用能否针对敏感细胞株达到增效、增敏的效果,能否增加耐药细胞株的敏感性,将药物联合使用,如何能够发挥更大的抗肺肿瘤作用,从而为解决临床GEF耐药性提供思路。在针对其他课题的联合用药试验中[11],出于增效减毒的目的,将ERG浓度固定,增加化疗药的浓度进行细胞增殖抑制试验,结果表明ERG与其他化疗药联用,起到了增效减毒的作用。在进行本实验时,考虑到是否可以采用药物联用的方式,达到最大的抗肺癌疗效。因此,同时增加ERG与GEF的浓度来进行细胞增殖抑制试验。而联合治疗可通过调节不同的信号转导途径来改善治疗效果。同时,与单药治疗相比,这种策略可以减少药物的不良反应,增加细胞对药物的敏感性[14-15]。结果显示,ERG,GEF组以及两药联用组对A549、PC-9细胞的增殖均有一定的抑制作用,且呈现一定的浓度与时间依赖效应。在这一部分实验中,A549细胞中ERG 10 μmol·L-1与GEF 10 μmol·L-1联用,协同作用优于ERG 20 μmol·L-1+GEF 20 μmol·L-1。根据MTT实验结果,后续实验采用了ERG 10 μmol·L-1+GEF 10 μmol·L-1进行,但凋亡实验结果不尽人意。MTT实验主要针对细胞抑制,凋亡实验主要考察细胞的凋亡,实验目的不同。出于该考虑,后续进行了 ERG 10 μmol·L-1+GEF 10 μmol·L-1和 ERG 20 μmol·L-1+GEF 20 μmol·L-12种浓度预实验,在凋亡染色试验和Western印迹实验中,均发现ERG 20 μmol·L-1+GEF 20 μmol·L-1(浓度相对高),实验结果有显著性差异,因此最终选择该浓度进行后续实验。
采用流式细胞仪检测细胞凋亡时发现,ERG和GEF联用在PC-9细胞上的凋亡率要远远高于A549细胞中,可能是因为GEF对PC-9细胞敏感,对A549细胞不敏感,ERG导致细胞死亡的主要途径可能不是通过凋亡途径发生的,而是通过自噬等其他途径发生的。细胞周期实验中,ERG组相对于对照组,能引起S期细胞比例极显著增加,ERG+GEF组能导致2种细胞的G0/G1期阻滞抑制其增殖,从而抑制肿瘤进一步的发展恶化。
EGFR家族成员在肺癌的发展过程起重要的作用,其在40%~80%的非小细胞肺癌中过度表达,与肿瘤的生长、增殖、运动、黏附、侵袭、凋亡和转移等密切相关。EGFR是HER/ErbB家族中的一个跨膜蛋白,与胞外因子结合后能通过一系列的下游信号通 路 ,如 Ras/Raf/MAPK[16],PI3K/Akt[17]和 Jak/STAT3[18]等,影响下游蛋白c-Fos,c-Jun,Bad,胱天蛋白酶9和叉头转录因子等,从而达到促进细胞分裂、增加细胞增殖、转化、转移的作用。GEF的作用机制就是与ATP竞争EGFR上的结合位点,从而达到抑制磷酸化、阻断信号通路的效果[19]。因此,在Western印迹实验中,选择了EGFR及下游相关信号通路Akt的表达。结果ERG+GEF组的p-Akt/Akt水平和p-EGFR/EGFR水平均极显著降低,表明两药联用能在一定程度上抑制EGFR信号通路的表达。而PI3K/Akt/mTOR信号通路是EGFR信号通路的下游信号通路,因此推测是否两药联用能在一定程度上抑制PI3K/Akt/mTOR信号通路的表达,从而使肿瘤细胞产生凋亡。
本研究的不足之处在于ERG与GEF联用,对GEF敏感的PC-9细胞能够起到增效、增敏作用,对GEF耐药的A549细胞能增加其一定的敏感性,但对于机制研究只进行了初步探讨。近年来许多研究表明,PI3K/Akt/mTOR信号通路在肿瘤细胞中发挥重要的作用。因此,有关ERG与GEF联用抗肿瘤更全面的分子机制有待进一步研究。

