溶瘤腺病毒修饰间充质干细胞裂解上清对小鼠乳腺癌细胞4T1生物学特性的影响
刘 超,孟虹芳,戴诗云,荆 杰
(1.滨州医学院临床医学院,山东烟台 264000;2.军事科学院军事医学研究院辐射医学研究所,北京 100850)
溶瘤腺病毒(oncolytic adenovirus,rAd)是肿瘤基因治疗最常见的载体之一,可在肿瘤细胞内特异性复制,并最终裂解肿瘤细胞;同时,可作为载体将治疗基因导入肿瘤细胞并大量表达,进而发挥抑制肿瘤生长和转移的作用。然而,网状内皮系统的吞噬清除以及病毒抗体的中和是阻碍rAd发挥作用的2个主要屏障。近年来,间充质干细胞(mesenchymal stem cells,MSC)已成为治疗多种疾病如癌症的有效基因传递载体[1-3]。MSC递送rAd,可规避病毒抗体的中和作用,增加rAd在肿瘤内累积,最终提升rAd的抗肿瘤效应。然而,MSC在肿瘤治疗中的作用存在较大争议,既有抑制肿瘤生长的报道[4-5],也有其可通过分泌生长因子、抑制免疫和炎症反应促进肿瘤生长和进展的报道[6-7]。核心蛋白聚糖(decorin,DCN)是一类抑癌基因,研究表明,DCN能够抑制多种肿瘤的生长和转移[8-11]。本研究前期动物实验结果表明,感染携带DCN基因的溶瘤腺病毒rAd.DCN的MSC,即MSC.DCN,可以影响小鼠4T1移植瘤的生长和转移(待发表),但其作用机制尚未完全阐明。本研究将通过体外共培养体系探讨MSC.DCN对小鼠乳腺癌细胞4T1生物学特性的影响,初步研究MSC.DCN抑制小鼠4T1移植瘤生长和转移的机制。
1 材料与方法
1.1 细胞、病毒、试剂和仪器
小鼠乳腺癌4T1细胞购自美国菌种保藏中心(American Type Culture Collection);脐带MSC及携带DCN基因的rAd.DCN和对照病毒rAd.Null由本实验室保存,病毒构建参考文献[8]。DMEM和alpha-MEM培养基购自美国Thermo公司;胎牛血清购自美国Gemini公司;RIPA裂解液和BCA蛋白浓度测定试剂盒购自北京碧云天公司;小鼠抗人DCN单抗购自美国R&D公司;小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单抗购自英国Abcam公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG单抗购自北京中杉金桥公司;Dye670购自美国Thermo公司;FITC-AnnexinⅤ/PI凋亡检测试剂盒购自天津三箭公司。Power-Pac164-5050电泳仪购自美国Bio-Rad公司;BD FACS Calibur流式细胞仪购自美国BD公司;光学显微镜购自日本奥林巴斯株式会社;7500Fast实时荧光定量PCR系统购自美国ABI公司,Tanon 5200全自动化学发光成像仪购自上海天能公司。
1.2 4T1细胞和MSC培养和传代
以含有10%胎牛血清的DMEM为4T1细胞的培养基,以含有10%胎牛血清的alpha-MEM为MSC的培养基,待细胞生长至80%~90%融合度时进行传代,传代比例为1∶3。
1.3 溶瘤腺病毒感染MSC最佳感染滴度的筛选
培养至第4代的MSC以每孔1.5×108L-1的密度接种于6孔板内,每孔2 mL,待细胞贴壁后按感染复数(multiplicity of infection,MOI)分别加入1,2,5和10 MOI的rAd.DCN及空载体(rAd.Null),并设置MSC对照组。MSC感染病毒48 h后,用RIPA裂解液裂解细胞,10 000×g离心10 min,取上清液。BCA法测定蛋白浓度,将样品蛋白浓度调一致,以4∶1体积比加5×上样缓冲液混匀,煮沸10 min。将提取的蛋白质进行聚丙烯酰胺凝胶电泳(SDS-PAGE),上样量为 20 μg,分离后转至PVDF膜,5%脱脂奶粉室温封闭2 h。分别加DCN和GAPDH抗体(按1∶1000稀释)4℃孵育过夜。TBS-T清洗3次,每次5 min。随后加HRP标记山羊抗小鼠IgG抗体(二抗)(按1∶5000稀释),室温孵育1 h;TBS-T洗膜3次,每次5 min;发光,显影,扫描后分析蛋白条带积分吸光度(integrated absorbance,IA),待测蛋白表达水平用IA待测蛋白/IAGAPDH比值表示。
1.4 细胞裂解液的制备
培养至第4代的MSC以每孔1.5×108L-1的密度接种于6孔板内,每孔2 mL,待细胞贴壁后按2 MOI的剂量分别加rAd.DCN和rAd.Null,并命名为MSC.Null和MSC.DCN,设置MSC对照组。48 h后,收集细胞及上清,在-80℃和37℃之间反复冻融裂解3次,300×g4℃离心10 min,收集上清。取对数生长期的4T1细胞以1.5×108L-1的密度接种于6孔板内,每孔2 mL,待细胞贴壁后将原培养基吸出,分别加1 mL上述裂解上清和DMEM完全培养基进行共培养。
1.5 RT-PCR法检测4T1细胞DCN mRNA表达
4T1细胞与各裂解上清共培养3 d后,Trizol提取4T1细胞RNA,按说明书操作,以β肌动蛋白为内参基因,利用实时荧光定量PCR仪进行扩增反应。β肌动蛋白引物序列:5′-AGGCCAACCGTGAAAAGATG-3′(正向),5′-TGGCGTGAGGGAGAGCATAG-3′(反向);DCN引物序列:5′-GGGATAGGCCCAGAAGTT-3′(正向),5′-TGGCATTGACAGCGGAAG-3′(反向)。反应程序:95℃ 2 min;95℃ 15 s,60℃ 30 s,共40个循环,以循环阈值(Ct值)作为统计参数,mRNA的表达水平采用2-ΔCt表示。
1.6 Western印迹法检测4T1细胞DCN蛋白表达
4T1细胞与各裂解上清共培养3 d后,用RIPA裂解液裂解细胞,10 000×g离心10 min,取上清液。BCA法测定蛋白浓度,将样品蛋白浓度调一致,以4∶1体积比加5×上样缓冲液混匀,煮沸10 min。将提取的蛋白质进行SDS-PAGE,上样量为20 μg,分离后转至PVDF膜,5%脱脂奶粉室温封闭2 h。分别加入DCN和GAPDH抗体(按1∶1000稀释)4℃孵育过夜。TBS-T清洗3次,每次5 min。随后加HRP标记羊抗小鼠IgG抗体(1∶5000),室温孵育1 h,TBS-T洗膜3次,每次5 min。发光,显影,扫描后分析蛋白条带IA,待测蛋白表达水平用IA待测蛋白/IAGAPDH比值表示。
1.7 流式细胞术检测4T1细胞增殖
取1×107对数生长期的4T1细胞加入1×PBS 500 μL混匀,将Dye670 1 μL加1×PBS 500 μL混匀后加入到4T1细胞悬液中,37℃避光孵育10 min,然后加含10%胎牛血清的DMEM培养基4 mL混匀,在冰上孵育5 min,然后用1×PBS 5 mL洗涤3次。Dye670标记完成后取出1×106,加2%多聚甲醛400 μL固定,避光保存,剩余4T1细胞以每孔3×105细胞接种于6孔板内,按1.4与不同细胞裂解上清进行共培养,并设置4T1对照组。共培养第3和5天收集4T1细胞,用流式细胞仪检测肿瘤细胞增殖。使用Modfit LT分析4T1细胞的增殖指数。
1.8 流式细胞术检测4T1细胞凋亡
4T1细胞与各裂解上清共培养3和5 d后,消化收集4T1细胞,300×g离心5 min,弃上清。加1×PBS 1 mL,300×g离心5 min,弃上清。加入结合缓冲液100 μL重悬细胞;然后加入FITC-Annexin V 5 μL混匀,室温避光孵育10 min;再加PI 5 μL混匀,室温避光孵育5 min加1×PBS 300 μL重悬细胞,用流式细胞仪检测4T1细胞凋亡,细胞凋亡的标志为FITC-AnnexinⅤ和PI双阳性。
1.9 划痕法检测4T1细胞迁移
将4T1细胞以每孔6×105接种于6孔板内,待细胞贴壁后用无菌枪头进行“井”字划痕,然后用1×PBS 2 mL清洗细胞3次,去除划痕过程中产生的细胞碎片。分别加1.4所述与不同细胞裂解上清1 mL和无血清DMEM培养基1 mL,并设置正常细胞对照组,划痕后0和12 h在固定视野下拍照,观察划痕宽度。使用Image J软件打开图片后,随机划取6条水平线,计算划痕宽度的均值。迁移率(%)=(0 h划痕宽度-12 h划痕宽度)/0 h划痕宽度×100%。
1.10 统计学分析
实验结果数据用±s表示,应用GraphPad Prism software version 5进行统计学分析,各组间的比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Studentt检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 rAd.DCN感染MSC最佳感染滴度的筛选
为验证rAd.DCN对MSC的感染效率,并筛选最佳感染滴度,本研究采用不同感染滴度的rAd.DCN感染MSC。Western印迹实验(图1A和1B)显示,与MSC对照组和rAd.Null组相比,rAd.DCN感染MSC 48 h即能高效介导DCN在MSC内的表达,且随感染滴度的增加,表达量增强,在2 MOI达到最高。因此,后续实验选用2 MOI感染MSC。
2.2 溶瘤腺病毒修饰MSC裂解上清对4T1细胞DCN表达的影响
在MSC,MSC.Null和MSC.DCN裂解上清与4T1细胞共培养3 d后,分别通过RT-PCR和Western印迹法从核酸及蛋白水平检测4T1细胞DCN的表达。RT-PCR结果(图2A)显示,MSC.Null组与MSC对照组之间DCNmRNA的表达水平无明显差异;MSC.DCN组DCNmRNA的表达水平较MSC对照组和MSC.Null组明显升高(P<0.01)。Western印迹实验结果(图2B和2C)显示,与MSC对照组相比,MSC.Null组DCN蛋白表达无明显改变;与MSC.Null组相比,MSC.DCN组DCN蛋白表达水平明显升高。上述结果表明,MSC.DCN裂解上清中存在具有活性的溶瘤腺病毒颗粒,其可介导DCN在4T1细胞中的高效表达。

Fig.1 Effect of oncolytic adenovirus on expression of decorin(DCN)protein in mesenchymal stem cells(MSCs)detected by Western blotting.MSCs were infected by oncolytic adenovirus carrying DCN gene(rAd.DCN)and control virus(rAd.Null),respectively,for 48 h.B was the semi-quantitative result of A.MOI:multiplicity of infection;IA:integrated absorbance.
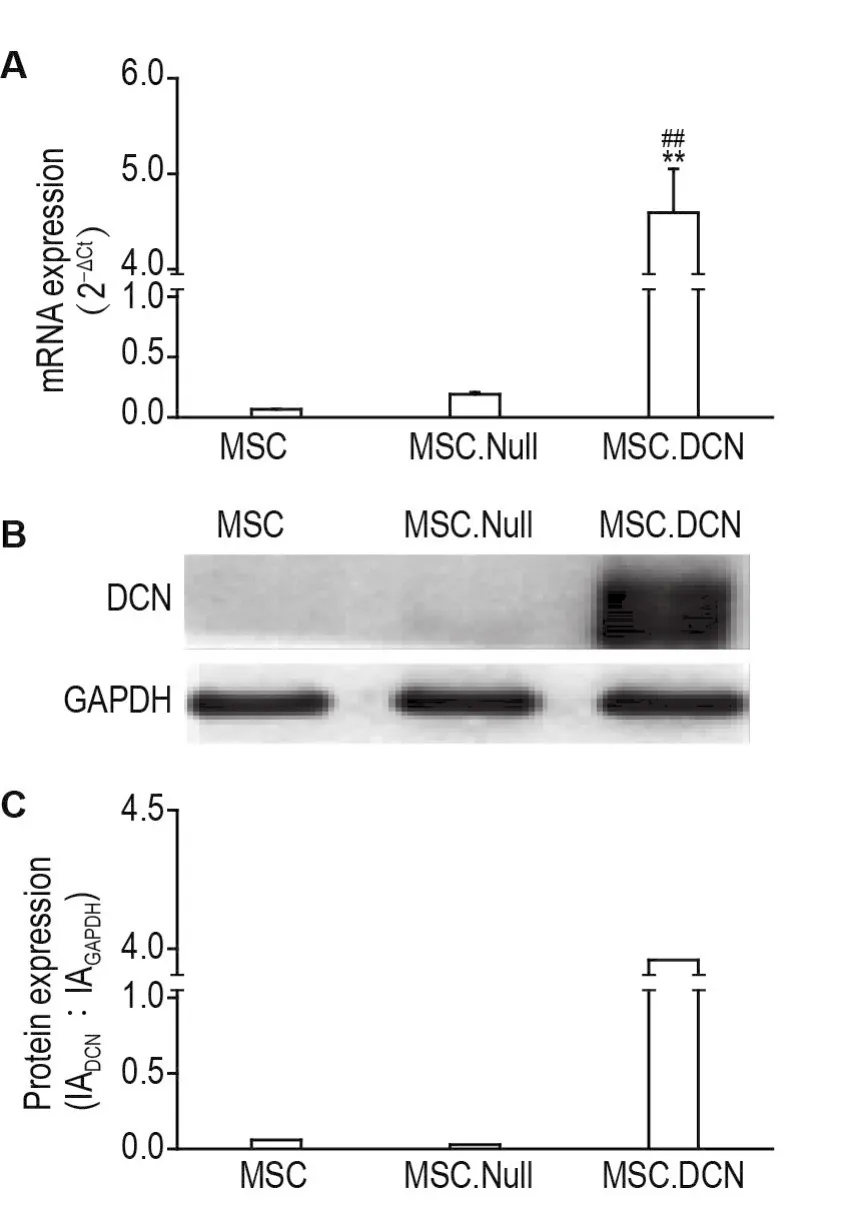
Fig.2 Effect of lysate supernatant of MSCs infected by rAd.DCN(MSC.DCN)and MSCs infected by rAd.Null(MSC.Null) on DCN expression in 4T1 cells by RT-PCR and Western blotting.MSCs were infected by 2 MOI rAd.DCN and 2 MOI rAd.Null,respectively,for 48 h.4T1 cells were treated with the lysates of MSC,MSC.Null and MSC.DCN for 3 d.A:DCN mRNA expression.±s,n=3.**P<0.01,compared with MSC control group;##P<0.01,compared with MSC.Null group.B and C:DCN protein expression,C was the semi-quantitative result of B.
2.3 溶瘤腺病毒修饰MSC裂解上清对4T1细胞增殖的影响
将MSC,MSC.Null和MSC.DCN的裂解上清与4T1细胞共培养不同时间,通过流式细胞术检测4T1细胞增殖。结果(图3A和3B)显示,共培养3 d后,与正常对照组相比,MSC组4T1细胞增殖指数下降(P<0.01);与 MSC组相比,MSC.Null组和MSC.DCN组4T1细胞增殖指数下降(P<0.05,P<0.01),但两者之间无统计学差异。共培养5 d后,与正常对照组相比,MSC组4T1细胞增殖指数下降但无统计学差异;与MSC组相比,MSC.Null组和MSC.DCN组4T1细胞增殖指数下降(P<0.05,P<0.01)。与MSC.Null组相比,MSC.DCN组4T1细胞增殖指数无明显下降。上述结果表明,MSC裂解上清可在一定程度上抑制4T1细胞增殖,溶瘤腺病毒可以进一步抑制4T1增殖,而且这种抑制作用与携带的基因之间的关系不明显。
2.4 溶瘤腺病毒修饰MSC裂解上清对4T1细胞凋亡的影响
将MSC,MSC.Null和MSC.DCN的裂解上清与4T1细胞共培养不同时间,用流式细胞术检测4T1细胞凋亡。结果(图4A和4B)显示,共培养3 d,与正常对照组相比,MSC组4T1细胞凋亡无明显改变;与MSC组相比,MSC.Null组和MSC.DCN组4T1细胞凋亡比例上升(P<0.05,P<0.01),两组之间无统计学差异。共培养5 d,与正常对照组相比,MSC组4T1细胞凋亡无明显改变;与MSC组相比,MSC.Null组和MSC.DCN组4T1细胞凋亡比例升高(P<0.01),两组之间无统计学差异。因此推测,4T1细胞凋亡主要是由溶瘤腺病毒自身引起的。
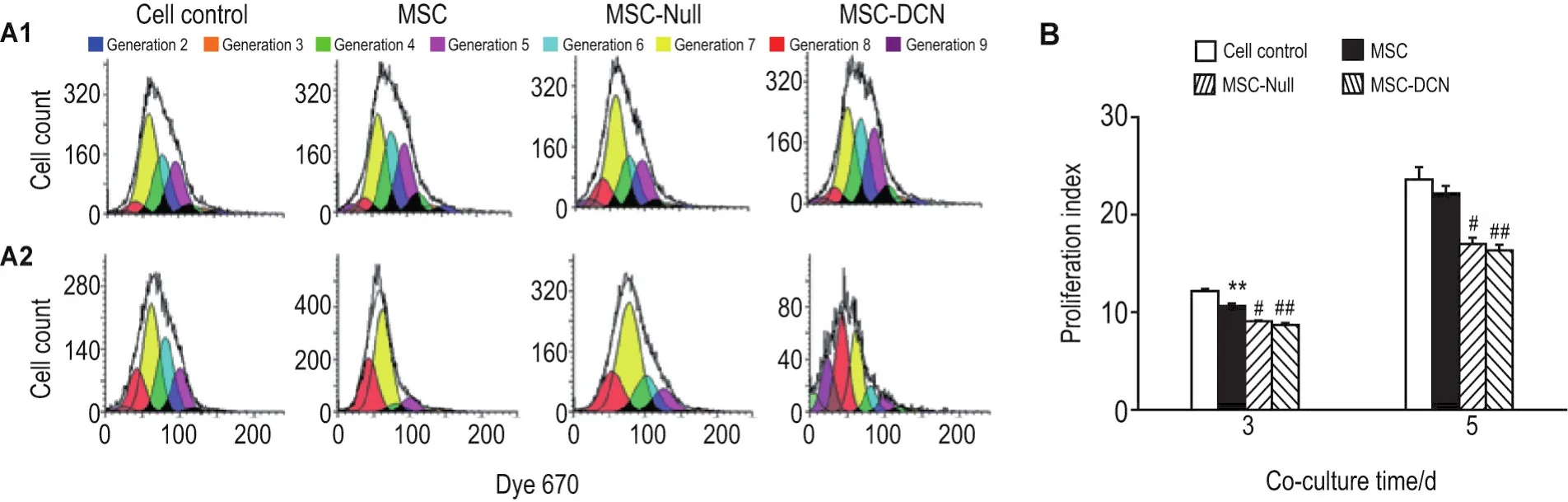
Fig.3 Effect of lysate supernatant of MSC.DCN and MSC.Null group on proliferation of 4T1 cells detected by flow cytometry.4T1 cells were treated with lysates from MSC,MSC.Null and MSC.DCN for 3(A1)and 5 d(A2).B was the semiquantitative result of A.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with MSC group.
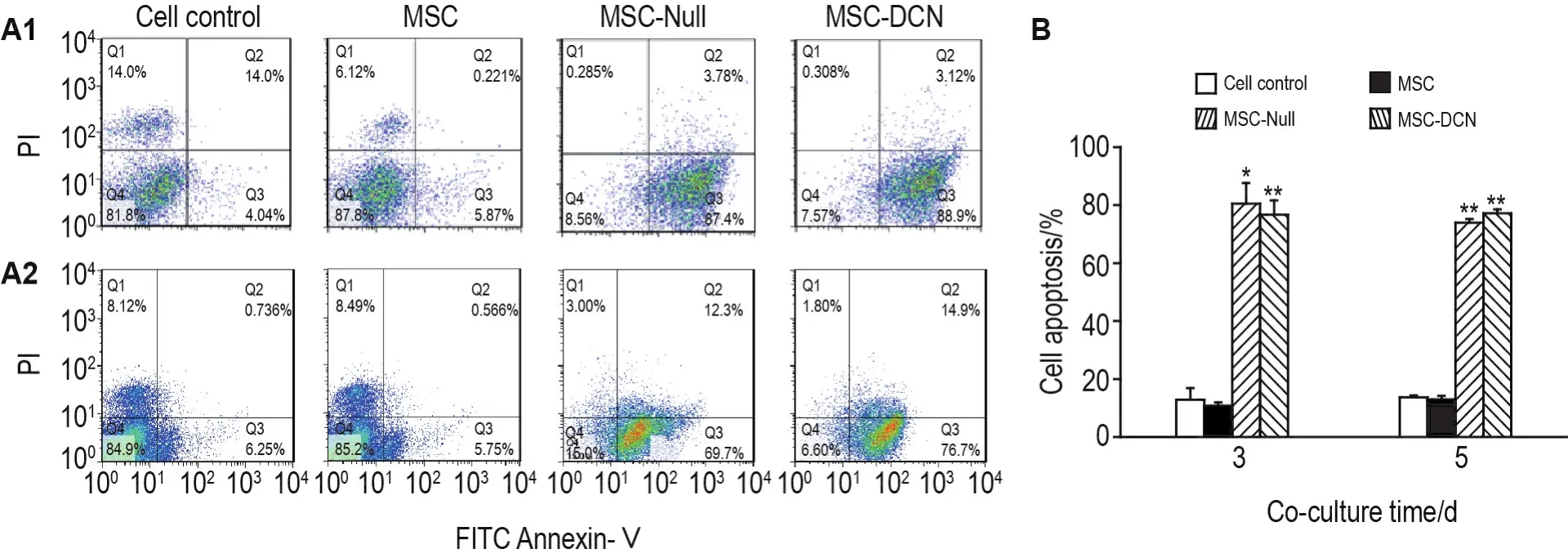
Fig.4 Effect of lysate supernatant of MSC.DCN and MSC.Null group on apoptosis of 4T1 cells detected by flow cytometry.See Fig.3 for the cell treatment.A1:co-culture for 3 d;A2:co-culture for 5 d;B was the semi-quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with MSC group.
2.5 溶瘤腺病毒修饰MSC裂解上清对4T1细胞迁移的影响
将MSC,MSC.Null和MSC.DCN的裂解上清与4T1细胞共培养,用细胞划痕实验观察4T1细胞的迁移。结果(图5A和5B)显示,与对照细胞组相比,MSC裂解上清与4T1共培养12 h后可促进4T1细胞迁移(P<0.01)。与MSC组相比,MSC.Null组4T1细胞迁移无明显差异,MSC.DCN组4T1细胞迁移明显受到抑制(P<0.05)。与MSC.Null组相比,MSC.DCN组4T1细胞迁移受到抑制(P<0.05)。上述结果表明,rAd自身对MSC裂解上清所诱导的4T1细胞迁移具有一定的抑制作用,且DCN能够增强这种迁移抑制效应。

Fig.5 Effect of lysate supernatant of MSC.DCN and MSC.Null on migration of 4T1 cells detected by wound healing assay.4T1 cells were treated with lysates from MSC,MSC.Null and MSC.DCN for 12 h.B was the semiquantitative result of A.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,compared with MSC group;△P<0.01,compared with MSC.Null group.
3 讨论
溶瘤病毒(rAd)疗法作为肿瘤基因治疗的重要方向,不仅可以通过病毒复制直接溶解肿瘤细胞,而且可通过释放大量肿瘤抗原和调节肿瘤微环境来激活抗肿瘤免疫反应。美国食品药品监督管理局(FAD)于2015年批准,表达粒细胞-巨噬细胞集落刺激因子的Ⅰ型溶瘤性单纯疱疹病毒用于临床治疗晚期黑素瘤[12],在肿瘤的免疫治疗领域具有重要的里程碑意义。而rAd作为肿瘤基因治疗最常见的载体,可携带治疗基因,发挥治疗基因和病毒的协同抗肿瘤作用,增强肿瘤杀伤能力。对于发生了远端转移的肿瘤,系统递送rAd是一种有效的治疗方式。但是,通过静脉注射进入血液循环的rAd靶向性差,使rAd的疗效受限,并且经肝后会造成不同程度的肝毒性。
MSC是一种多能干细胞,由于其免疫原性低,并具有向肿瘤组织定向迁移的能力,可作为系统递送溶瘤腺病毒的有效载体[13-14]。以MSC作为溶瘤腺病毒的载体,可提高其靶向性,同时减少肝毒性。MSC归巢至肿瘤组织后,rAd通过大量复制将MSC裂解后释放并感染周围肿瘤细胞,可同时发挥溶瘤作用及其携带的治疗基因的作用。本研究通过RT-PCR和Western印迹实验可以看到,MSC.DCN裂解上清可高效介导DCN在4T1细胞的表达。
多项研究表明,DCN作为一种抑癌基因,在肺癌和胰腺癌等恶性肿瘤组织中表达下调[15-17]。也有研究表明,DCN可以制乳腺癌和胆管细胞癌等多种肿瘤的生长和转移[18-20]。本课题组前期工作表明,以rAd作为载体,将DCN基因转入肿瘤细胞,DCN通过抑制转化生长因子β信号通路,抑制间充质表皮转化因子信号通路,抑制Wnt/β连环蛋白(β-catenin)和血管内皮生长因子信号通路等,调节肿瘤细胞的增殖、凋亡和迁移,从而有效抑制乳腺癌和前列腺癌等肿瘤细胞的生长和转移[21-23]。
本研究采用rAd作为载体携带DCN基因,评价其对4T1细胞生物学特性的影响。细胞增殖实验表明,MSC裂解上清能抑制4T1细胞的增殖,MSC.Null和MSC.DCN裂解上清的抑制作用更强,但2组之间的抑制作用无统计学差异,因此推测,rAd自身可增强MSC裂解上清对4T1细胞增殖的抑制作用。而细胞凋亡实验结果也提示,4T1细胞的凋亡主要是由rAd自身引起的,而携带的DCN基因对此作用无明显影响。细胞划痕实验表明,MSC.DCN裂解上清能够抑制MSC裂解上清的促迁移作用,推测可能是MSC.DCN裂解上清能有效感染4T1细胞,使4T1细胞高表达DCN,从而抑制由MSC裂解上清所诱导的4T1细胞迁移,但这种抑制作用并不能使4T1细胞的迁移速率降至其自发迁移。具体作用机制和所涉及的信号通路等尚需深入研究。
综上所述,MSC.DCN能抑制小鼠乳腺癌细胞4T1细胞的增殖及MSC裂解上清所诱导4T1细胞的迁移,同时促进4T1细胞的凋亡。因此,以MSC作为载体,可以将携带DCN基因的溶瘤腺病毒递送至肿瘤局部,从而发挥抗肿瘤作用。同时,DCN可以抑制MSC裂解上清的促肿瘤作用,降低MSC应用于肿瘤治疗的风险。因此,以MSC作为载体,介导rAd的基因治疗可作为一种潜在的肿瘤治疗方式。
- 中国药理学与毒理学杂志的其它文章
- 双硫仑对人脂肪肉瘤细胞系SW872细胞的抑制作用及其机制
- 酸性鞘磷脂酶活性调控及相关药物研究进展
- 麦角甾醇与吉非替尼联合用药协同抑制非小细胞肺癌A549和PC-9细胞增殖
- Ophiopogonin D upregulates CYP2J3/EETs to activate Pl3K/AkteNOS pathway and rescue H2O2-induced H9c2 cell injury
- Evaluation genotoxicity of acetylnerolin based on quantitative structure-activity relationship model and in vitro tests
- 胆碱能M受体调控细胞周期蛋白依赖性激酶5及其在敌敌畏诱导SH-SY5Y细胞毒性损伤中的作用

