双硫仑对人脂肪肉瘤细胞系SW872细胞的抑制作用及其机制
韩 冰,苗成利,张 林,高川成,肖凤君,王立生,
(1.吉林大学护理学院康复教研室,吉林 长春 130021;2.北京大学国际医院腹膜后肿瘤外科,北京102206;3.军事科学院军事医学研究院辐射医学研究所,北京 100850)
腹膜后脂肪肉瘤(retroperitoneal liposarcoma,RPLS)是腹膜后肉瘤的最常见类型,约占腹膜后软组织肉瘤的45%[1]。其在发病初期并无症状,因此,患者在被确诊时肿瘤体积往往巨大,已侵占腹腔内脏器,使手术难以完全切除,导致术后易复发且预后较差[2-3]。该病目前主要的治疗手段为手术切除,尚缺乏其他有效的治疗方法,亟需研发能有效治疗RPLS的药物。利用新型的筛选模型评价已上市药物老药新用模式是节省人力、财力和时间成本的有效策略[4-5]。秋兰姆衍生物双硫仑(disulfiram,DSF)作为醛脱氢酶(aldehyde dehydrogenase,ALDH)的抑制剂,是一种历史悠久的戒酒药[6]。近些年,由于其在体内外实验中表现出优良的抑制肿瘤作用而备受关注[7-11]。脂肪肉瘤细胞由于其独特的代谢特点而对多种化疗药物具有抗性。我们在筛选对脂肪肉瘤细胞具有抑制作用的化合物时,发现DSF能有效抑制脂肪肉瘤细胞的生长,但对其作用特点及机制并不清楚。
从细胞死亡入手可很好阐释抗肿瘤药物的作用机制。近年来一些新型细胞死亡方式机制的研究不断深入,如细胞铁死亡(ferroptosis)是一种新发现的依赖于铁离子及与活性氧诱导脂质过氧化密切相关的调节性死亡方式[12]。细胞铁死亡可被铁离子螯合剂Fer-1逆转[13]。细胞焦亡(pyroptosis)是高度炎症细胞的死亡形式之一,其机制主要通过炎症小体激活胱天蛋白酶1并促进炎症因子分泌多种炎症调节分子如肿瘤坏死因子α诱导蛋白3(tumor necrosis factor alpha-induced protein 3,TNFAIP3)(A20)等参与铁死亡和焦亡的调控[13-14]。因此,本研究探究DSF对脂肪肉瘤细胞系SW872的抑制作用,并阐明炎症小体和A20等炎症调节分子在DSF诱导脂肪肉瘤细胞死亡中的作用,以期为RPLS的临床治疗提供新的思路。
1 材料与方法
1.1 细胞、药物、主要试剂和仪器
脂肪肉瘤细胞系SW872购于美国菌种保藏中心(ATCC),将细胞从液氮中取出,置37℃水浴锅中快速化开,用含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养液,于CO2细胞培养箱中贴壁培养;DMEM(Gibco公司,美国);FBS(四季青,中国);胰酶,双抗(Hyclone,美国);DSF和炎症小体NLRP3抑制剂MCC950(美国,APEBIO);铁离子螯合剂Fer-1(Sigma,美国);CCK-8试剂盒(Bimake,美国);吉姆萨染色液(索莱宝,中国);DAPI染液(凯基,中国);细胞凋亡双染、SBYR荧光定量PCR试剂盒(GenStar公司,中国);反转录试剂盒(全式金,中国);ALDH1A1,ALDH1A2,ALDH1A3,A20和β-肌动蛋白引物由北京生工引物合成部合成;兔抗人TNFAIP3/A20、兔抗人三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单抗均购于美国Cell Signaling Technology公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG多抗购于中国中杉金桥公司;RIPA裂解液和蛋白酶抑制剂购于中国碧云天公司。二级生物安全柜(ESCO,美国);离心机、CO2细胞培养箱和多功能全波长酶标仪(Thermo公司,美国);光学倒置显微镜(Olympus公司,日本);FACSCalibur流式细胞仪(BD公司,美国);蛋白垂直电转仪(Bio-Rad公司,美国);7500 Fast实时定量PCR仪(Applied Biosystems,美国);凝胶成像系统(Tanon公司,中国)。
1.2 CCK-8法检测SW872细胞存活
将处于对数生长期的SW872细胞常规消化,计数,细胞密度调整到1×108L-1,并加入终浓度分别为0,1,2.5,5和10 μmol·L-1的DSF,100 μL每孔接入96孔板,每组3复孔,置于37℃,5%CO2饱和湿度培养箱。24 h后,每孔加10 μL CCK-8,37℃孵育3 h,酶标仪检测450 nm波长处吸光度。结果以细胞存活率表示:细胞存活率(%)=(实验组A450nm-空白对照组A450nm)/(对照组A450nm-空白对照组A450nm)×100%,并将5个浓度对应的细胞增殖抑制率(1-存活率)输入SPSS统计学软件中,利用回归功能计算出DSF对SW872细胞的IC50。
1.3 光镜下观察SW872细胞形态
将处于对数生长期的SW872细胞常规消化,计数,细胞密度调整到1×105L-1,并加终浓度分别为 0,1 和 2.5 μmol·L-1的 DSF,2 mL 每孔接入6孔板中,24 h后在显微镜下观察拍照。
1.4 流式细胞仪检测SW872细胞凋亡
取处于对数生长期的SW872细胞,以每孔3×105接入6孔板中。设正常细胞对照组、DSF 1 μmol·L-1组和 DSF 2.5 μmol·L-1组,作用 24 h后收集细胞,用冰PBS洗2遍后用100 μL 1×结合缓冲液重悬,加5 μL AnnexinV-FITC,室温避光孵育15 min,加2 μL PI,室温孵育5 min,加400 μL PBS重悬,立即上机检测并计算FITC+PI-阴性的细胞百分率。
1.5 克隆形成试验检测DSF对SW872细胞克隆形成的影响
将处于对数生长期的SW872细胞消化、离心、计数,铺于24孔板中,每孔500个细胞,500 μL体系(含10%FBS的DMEM),3个复孔。待细胞贴壁后,每孔加入DSF最终浓度分别为0(细胞对照组)、0.1和0.25 μmol·L-1,6 d后,细胞对照组出现肉眼可见的细胞集落,进行吉姆萨染色、拍照(20×)、在显微镜下计细胞数在60个以上的细胞集落。
1.6 RT-PCR法检测细胞中A20和ALDH1A1~3mRNA的水平
将处于对数生长期的细胞消化、离心、计数、加入药物并调整药物浓度为0(正常细胞对照组)、1、5和10 μmol·L-1,铺于6孔板中,每孔5×105个细胞,2 mL体系(含10%FBS的DMEM)。12 h后将细胞进行消化离心,Trizol法提取RNA,并取1 μg RNA反转录为cDNA,进行RT-PCR。引物序列如下:A20上游:5′-TGCTGCCCTAGAAGTACAATAGGAA-3′,下游:3′-GCAGCTGGTTGAGTTTATGCAAG-5′;ALDH1A1上游:5′-TTGGAATTTCCCGTTGGTTA-3′,下游:3′-CTGTAGGCCCATAACCAGGA-5′;ALDH1A2上游:5′-AGGGCAGTTCTTGCAACCATGGAA-3′,下游:3′-CACACACTCCAATGGGTTCATGTC-5′;ALDH1A3上游:5′-GCCCTTTATCTCGGCTCTCT-3′,下游:3′-CGGTGAAGGCGATCTTGT-5′;β-肌动蛋白上游:5′-CATCCTCACCCTGAAGTACCC-3′,下游:3′-AGCCTGGATAGCAACGTACATG-5′。所得数据使用 2-ΔCt表示。
1.7 Western印迹法检测细胞中A20蛋白的表达
将处于对数生长期的细胞消化、离心、计数、加入DSF并调整药物浓度为1,5和10 μmol·L-1,铺于6孔板中,同时设立正常细胞对照组,每孔5×105个细胞,3复孔。24 h后弃上清,使用RIPA裂解细胞,BCA法测定蛋白量,以相同蛋白量上样,蛋白样本经SDS-PAGE电泳、转膜及一抗(A20和内参GAPDH,1∶1000稀释)4℃孵育过夜,二抗(HRP标记山羊抗兔抗体,1∶5000稀释)摇床孵育2 h,ECL显色后用凝胶成像仪对蛋白条带拍照,在内参一致的情况下,观察目的蛋白的表达,目的蛋白的积分吸光度值和内参蛋白的吸光度值比值表示目的条带的相对表达量。
1.8 CCK-8法检测铁离子螯合剂Fer-1和NLRP3炎症小体抑制剂MCC950对DSF抑制SW872细胞增殖的影响
为检测铁离子和炎症小体对DSF抑制SW872细胞的增殖的影响,利用铁离子螯合剂Fer-1和炎症小体抑制剂MCC950与DSF共处理细胞。将处于对数生长期的SW872细胞常规消化,计数,细胞密度调整到1×108L-1,并加终浓度分别为0,1,2.5(或0,3,5,7.5)μmol·L-1DSF 100 μL每孔接入96孔板,每组3复孔;再在剩余含有相应DSF浓度的培养液中加终浓度为 1 μmol·L-1Fer-1 或 10 nmol·L-1MCC950,充分混匀后接于同一96孔板,3复孔。24 h后,使用CCK-8法检测细胞的存活状况(方法同1.2),结果以细胞存活率表示。
1.9 统计学分析
实验结果数据用±s表示。采用SPSS24.0软件进行统计分析,组间两两比较采用t检验,实验重复3次,以P<0.05为差异有统计学意义。
2 结果
2.1 DSF对SW872细胞增殖的抑制作用
利用CCK-8法测定DSF对SW872细胞增殖抑制作用,结果(图1)显示,与正常对照组相比,DSF 1~10 μmol·L-1作用于SW872细胞24 h后,能明显抑制细胞增殖(P<0.01),DSF半数抑制浓度(IC50)为0.99 μmol·L-1。
2.2 DSF对SW872细胞ALDH1 mRNA水平的影响
RT-PCR结果(图2)显示,DSF作用于SW872细胞12 h后,ALDH1A1,ALDH1A2和ALDH1A3的mRNA水平反馈性升高。通过对不同浓度DSF作用的SW872细胞中ALDH1mRNA水平的比较,以DSF 5 μmol·L-1为最高。发现随DSF 浓度增加到10 μmol·L-1,ALDH1的mRNA水平下降。
2.3 DSF对SW872细胞形态的影响
DSF作用于SW872细胞24 h后,与细胞对照组相比,发现在DSF的作用下,SW872发生皱缩,变圆,细胞间隙增大,随浓度增加现象越明显(图3)。

Fig.1 Effect of disulfiram(DSF)on viability of SW872 cells by CCK-8 assay.The cells were treated with DSF for 24 h.±s,n=3.**P<0.01,compared with cell contro(l0)group.

Fig.2 Effect of DSF on mRNA level of ALDH1A1-3 in SW872 cells detected by RT-PCR.The SW872 cells were treated with DSF 0,1,5 and 10 μmol·L-1respectively for 12 h.The mRNA Level of ALDH1A1-3 was detected.±s,n=3.**P<0.01,compared with cell control(0)group.
2.4 DSF对SW872细胞凋亡的影响
流式细胞仪检测结果(图4)显示,DSF作用于SW872 细胞 24 h 后,DSF 1 μmol·L-1组 SW872细胞的早期凋亡率达(32.6±1.82)%(P<0.01),DSF 2.5 μmol·L-1组 SW872细胞的早期凋亡率达(50.17±4.27)%(P<0.01)。

Fig.3 Morphology of SW872 cells treated with DSF for 24 h.The cells were treated with DSF 0,1 and 2.5 μmol·L-1for 24 h.Arrows show typical cell morphology.

Fig.4 Effect of DSF on apoptosis of SW872 cells detected by flow cytometry.The cells were treated with DSF 0,1 and 2.5 μmol·L-1for 24 h and stained with Annexin Ⅴ-FITC and propidium iodide.B was the quantitative result of apoptotic cells in A.±s,n=3.**P<0.01,compared with cell control(0)group.
2.5 DSF抑制SW872细胞克隆的形成
克隆形成实验结果(图5)显示,细胞对照组(DSF 0 μmol·L-1)平均形成(129±5)个细胞克隆,DSF 0.1 μmol·L-1组平均形成(17±7)个细胞克隆(P<0.01),DSF 0.25 μmol·L-1组无SW872细胞克隆的形成。
2.6 炎症小体参与DSF对SW872细胞的抑制作用
CCK-8的结果(图6)表明,铁离子螯合剂Fer-1 1 μmol·L-1不能逆转DSF对SW872细胞造成的增殖抑制,而炎症小体抑制剂MCC950对SW872细胞增殖有一定促进作用,并可逆转DSF对SW872的增殖抑制作用,表明炎症小体参与DSF对SW872细胞的增殖抑制作用。
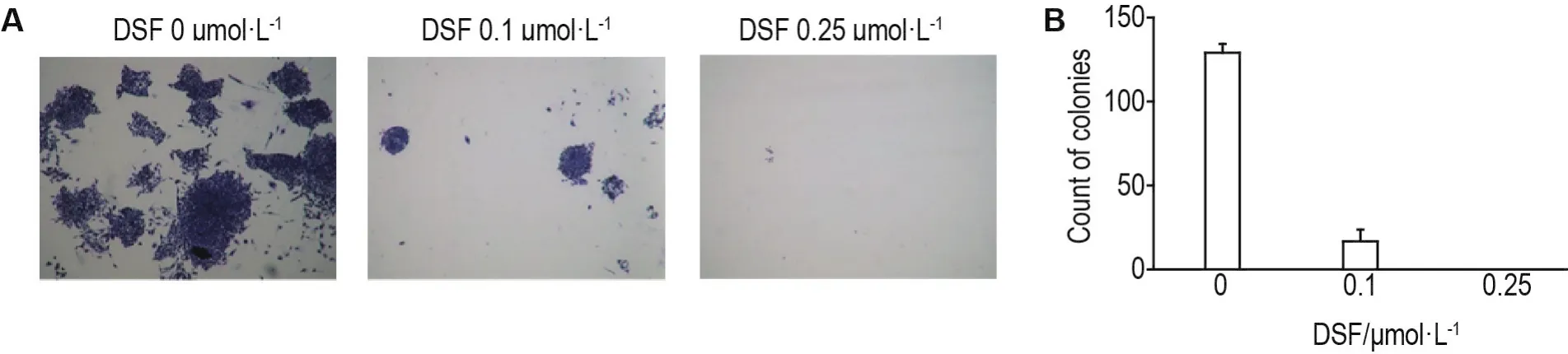
Fig.5 Effect of DSF on colony formation ability of SW872 cells.The cells were treated with DSF 0,0.1 and 0.25 μmol·L-1for 6 d,the colonies were stained and counted.B:The result of colony numbers of A.±s,n=3.**P<0.01,compared with cell control(0)group.

Fig.6 Effect of Fer-1 or MCC950 on cell viability of DSF treated SW872 cells by CCK-8.The SW872 cells were treated with DSF in the presence of Fer-1(A)or MCC950(B)for 24 h.±s,n=3.**P<0.01,compared with cell control(0)group.
2.7 DSF诱导SW872细胞A20表达
DSF作用于SW872 24 h后,DSF组的A20在mRNA和蛋白水平明显上调(P<0.01)。提示A20参与DSF对SW872细胞的抑制作用(图7)。

Fig.7 Effect of DSF on expression of A20 in SW872 cells.The SW872 cells were treated with DSF 0,1,5 and 10 μmol·L-1for 24 h.A:The level of A20 mRNA was detected by RT-PCR;B:A20 protein was detected by Western blotting;C:The qualitive result of B.±s,n=3.**P<0.01,compared with cell control(0)group.
3 讨论
ALDH1是哺乳动物细胞重要的ALDH,涉及细胞中醛氧化成羧酸、维A酸和γ-氨基丁酸生物合成,也是肿瘤干细胞的重要标志分子[15]。DSF是ALDH1特异性抑制剂[16],是一种用于戒酒的药物。近年来研究表明,DSF能抑制肺癌、乳腺癌等多种肿瘤细胞的增殖,有可能发展成为肿瘤治疗药物[16-17]。脂肪肉瘤对于放化疗敏感程度比较差,目前还缺乏有效的治疗药物[18]。本研究利用体外生物学特性检测方法,评价了DSF对SW872细胞的增殖的抑制作用。结果表明,DSF能抑制SW872细胞的增殖,并诱导SW872细胞死亡,是一种SW872细胞的有效抑制剂,有可能应用于脂肪肉瘤的治疗。
体外克隆形成实验表明,低浓度DSF使SW872细胞失去细胞贴壁能力,即可抑制SW872细胞克隆的形成。DSF的高度抑制活性与ALDH1调控肿瘤细胞的干细胞性有关。近年来,较多研究证实了关于化疗不敏感和癌症复发的原因是肿瘤干细胞的存在[19-20]。 ALDH1 家族(包括 ALDH1A1、ALDH1A2和ALDH1A3等)是ALDH九大家族之一,被认为是肿瘤干细胞的标志性分子,具有促进肿瘤干细胞自我更新、增殖和存活的作用[21-22]。DSF作为ALDH的特异性抑制剂能抑制SW872细胞酶活性,从而导致ALDH1A1,ALDH1A2和ALDH1A3mRNA呈现反馈性增高。在DSF处理的SW872细胞中,RT-PCR的结果显示,ALDH1A1,ALDHA2和ALDH1A3均出现随浓度增加先升高再降低的趋势,这可能是由于细胞的代偿作用,在ALDH1被抑制时出现反应性地升高,而更高浓度时则细胞死亡所致。
大量研究表明,DSF通过抑制核因子活化B细胞κ轻链增强子(nuclear factor kappa-light-chainenhancer of activated B cells,NF-κB)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK),又被称为应激活化蛋白激酶(stress-activated protein kinase,SAPK)等经典通路诱导肿瘤细胞的凋亡[23]。DSF的抑制作用与其诱导的细胞死亡方式密切相关。本研究结果也证明,DSF能诱导脂肪肉瘤细胞的凋亡。多种细胞死亡方式,如细胞凋亡、坏死、细胞自噬、坏死性凋亡、细胞焦亡及铁死亡等的调节机制研究不断深入。其中,铁死亡是在铁的参与下脂质过氧化产物和致命性活性氧簇积聚导致的,在药理学上能被铁离子螯合剂,如Fer-1(含有芳烷胺的抗氧化物)等逆转[24]。细胞焦亡则主要通过NLRP3炎症小体介导[25]。利用Fer-1处理细胞并不能够逆转DSF的抑制作用,表明铁死亡不是DSF诱导SW872细胞死亡的主要模式。NLRP3炎症小体是细胞炎性死亡的主要通路,使用NLRP3炎症小体抑制剂MCC950与DSF同时作用于SW872细胞,发现MCC950可部分逆转DSF对SW872细胞的抑制作用,因此,可认为DSF在对SW872细胞的抑制过程中激活了NLRP3炎症小体。研究结果提示,炎症小体介导的细胞死亡参与了DSF对脂肪肉瘤细胞的抑制作用。
众多调控分子参与细胞炎性死亡的调节。A20又称为TNFAIP3,是NF-κB信号传导的内源性负调节因子[26]。越来越多的研究证实,A20通过对靶细胞的蛋白泛素化修饰调节细胞的凋亡与坏死。在一些肿瘤中A20作为抑癌基因发挥功能[27]。近期研究进展将A20定义为炎症相关因子,参与炎症导致的细胞死亡[28]。A20可调节NLRP3炎症小体,从而起到调节铁死亡和焦亡的作用[29-31]。我们前期的研究也证明A20的表达与铁死亡及焦亡有关[13]。本研究发现,DSF处理SW872细胞后,A20在蛋白水平和mRNA水平明显上调,尽管在蛋白升高程度上与mRNA不尽一致,并无明显的剂量效应关系,但A20上调趋势明显,提示可能通过调控炎症小体参与DSF诱导的SW872细胞死亡。
综上,DSF在人脂肪肉瘤细胞系SW872中具有抑制增殖、促进凋亡、抑制克隆形成的作用,其具体机制可能与DSF诱导SW872中A20的表达上调有关,但不通过铁死亡方式,可能与炎症小体的激活有关。

