胆碱能M受体调控细胞周期蛋白依赖性激酶5及其在敌敌畏诱导SH-SY5Y细胞毒性损伤中的作用
杨 培,周 琥,王丽韫,王永安
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
近年来,因广谱杀虫剂有机磷农药在工业、农业及家庭生活中的广泛应用,导致有机磷化合物的过量排放,并可通过食物链富集进入人体,进而给人体健康造成严重损害。敌敌畏(dimethyl-dichlorovinyl-phosphate,DDVP)是生产生活中最常见的有磷酸酯类化合物,神经毒理学研究表明,DDVP中毒机制主要是抑制乙酰胆碱脂酶,使其失去水解乙酰胆碱(acetylcholine,ACh)的能力,造成胆碱能神经末梢释放的ACh大量蓄积,可兴奋ACh的毒蕈碱受体(胆碱能M受体),产生毒蕈碱样作用及中枢神经系统症状[1]。胆碱能M受体属于G蛋白偶联受体超家族成员之一,主要分为M1,M2,M3,M4和M5共5个受体亚型,其中,M1在大部分脑区广泛分布及表达[2]。流行病学资料研究表明,长期接触敌敌畏会引发潜在的神经毒作用,影响机体运动、认知及记忆功能[3-4]。目前DDVP诱发的继发性和迟发性神经损伤尚无有效治疗手段。
细胞周期依赖性蛋白激酶5(cyclin-dependent kinase 5,Cdk5)作为一种广泛表达的多功能丝氨酸/苏氨酸激酶,在神经元发育、迁移、细胞骨架蛋白磷酸化和突触可塑性中起重要作用[5-6]。Cdk5广泛参与神经系统正常生理功能调控与病理过程。生理条件下,Cdk5可磷酸化许多细胞骨架蛋白(tau、神经丝和巢蛋白等)、突触蛋白(突触后致密蛋白95,突触蛋白I和E-钙黏蛋白)和有丝分裂神经元中的转录因子,从而使细胞神经元发生迁移、神经突向外生长、轴突导向正常以及突触形成等功能[5]。但在病理条件下,Cdk5与其伴侣分子P25结合,可增加Cdk5激酶稳定性导致Cdk5持续激活。Cdk5的过度激活、活性失调及其亚细胞分布改变均不同程度的诱导神经元的凋亡或死亡,如过度活跃的Cdk5/P25过度磷酸化tau,tau异常聚集形成在阿尔茨海默病中观察到的神经原纤维缠结,最终导致神经元死亡[7]。在许多神经退行性疾病中,如帕金森病、肌萎缩侧索硬化和缺血性卒中,均发现Cdk5异常过度活化,诱导神经的凋亡损伤,致使神经元走向死亡[8-9]。此外众多文献表明,阻断Cdk5的活性具有一定的神经元保护作用[10-12]。
本课题组前期研究发现,原代大鼠纹状体中等棘状神经元中胆碱能M受体的激活可诱导神经元Cdk5活化,DDVP中毒机制与ACh兴奋胆碱能M受体有关,推测Cdk5可能在DDVP引发的神经毒性损伤发挥着重要的作用[11]。分化良好的SH-SY5Y细胞系具有成熟神经元的特征,具有突触结构、功能轴突囊泡运输,并表达特异性神经元蛋白,同时也是模拟神经细胞损伤常用的细胞模型[13]。本研究采用内源性表达Cdk5激酶的SH-SY5Y细胞构建DDVP诱导神经毒性损伤模型,首先确定胆碱能M受体对SH-SY5Y细胞Cdk5的调控作用,随后探讨Cdk5参与DDVP诱发神经元毒性损伤作用,为DDVP致神经毒性损伤及救治提供新的科学依据。
1 材料与方法
1.1 细胞、药物和主要试剂
SH-SY5Y细胞购于武汉Procell生命科技有限公司。DDVP为本实验室储存液体(纯度≥95%);氧化震颤素(oxotremorine,Oxo-M)购于美国Cayman公司;罗考唯亭(roscovitine,Rosc)购于美国Targetmol公司;MTT和胰蛋白酶购于美国Sigma公司;胎牛血清、MEM/F12培养购于美国Gibco公司;青链霉素购于北京中生奥邦公司;小鼠抗人Cdk5多克隆抗体和兔抗人M1单克隆抗体均购于美国Abcam公司;兔抗小鼠β肌动蛋白单克隆抗体购于武汉赛维尔公司;RIPA裂解液、BCA蛋白定量试剂盒、封闭用标准山羊血清、TRITC标记山羊抗兔IgG抗体(二抗)和FITC标记山羊抗小鼠IgG抗体(二抗)购于中杉金桥;Western印迹法检测试剂盒购于康为世纪生物科技有限公司;山羊抗兔IgG H&L(IRDye®680CW)抗体(二抗)和山羊抗小鼠IgG H&L(IRDye®800CW)抗体(二抗)购于美国LI-COR公司;细胞凋亡检测试剂盒购于上海爱必信公司;其余试剂为国产分析纯试剂。
1.2 主要仪器
酶标仪(Bio-Tek,美国);光学显微镜(Olympus,日本);稳压恒流电泳仪DYC-4C和半干式转移槽DYY-8 B(北京六一仪器厂,中国);SIGMA1-13台式高速离心机(SIGMA,德国);LSM 880 META 激光共聚焦显微镜(ZEISS,德国);Odyssey双色红外荧光成像系统(LI-COR,美国);ULTRALAB超纯水仪器(Millipore,美国);TS-100水平摇床(金坛市泰纳仪器厂,中国)。
1.3 细胞培养
SH-SY5Y细胞培养于含15%胎牛血清及1%青、链霉素的MEM/F12培养基中,培养环境为37℃,5%CO2,每2天半量换液1次,待细胞生长融合度约80%~90%时,使用0.25%胰蛋白酶消化,按1∶3比例传代,周期为4~7 d,选择对数生长期细胞进行实验研究。
1.4 细胞免疫荧光法检测细胞Cdk5和M1蛋白表达
将对数生长期的SH-SY5Y细胞消化成单细胞悬液,接种到共聚焦小皿中,调整密度为1.0×105L-1。于培养箱内孵育第4天更换新鲜培养基后进行处理。使用PBS清洗3次,每次5 min。4%多聚甲醛溶液室温固定15 min,无水甲醇于-20℃透膜10 min,山羊血清室温封闭1 h。加入小鼠抗人Cdk5多克隆抗体、兔抗人M1单克隆抗体(稀释比例为1∶120)4℃孵育过夜,复温20 min后加入TRITC标记的山羊抗兔IgG和FITC标记山羊抗小鼠IgG抗体(二抗)(稀释比例为1∶150),室温避光孵育1 h,DAPI室温避光孵育15 min。于LSM880 META激光共聚焦显微镜下观察并拍照,用于FITC的激发波长为488 nm,用于TRITC的激发波长为568 nm。
1.5 MTT法检测细胞存活率
将对数生长期SH-SY5Y细胞消化成单细胞悬液,接种到96孔板中,调整密度为1.0×105L-1。于培养箱内孵育第4天更换新鲜培养基后给药处理,分为:① Oxo-M(0,1×10-8,1×10-6,1×10-4和1×10-2mol·L-1)培养48 h;② Oxo-M 1×10-4mol·L-1培养0,24,48和72 h;③ 细胞对照组、Oxo-M组(1×10-4mol·L-1作用48 h)、Rosc组(培养结束前1 h 1×10-4mol·L-1)和 Rosc+Oxo-M 组(Rosc 1×10-4mol·L-1预处理 1 h后,再加入 Oxo-M 1×10-4mol·L-1作用至48 h)组;④ DDVP(0,1×10-6,1×10-5,1×10-4和1×10-3mol·L-1)培养48 h;⑤ 细胞对照组、DDVP组(1×10-5mol·L-1作用48 h)、Rosc组(培养结束前1 h加入1×10-4mol·L-1)和Rosc+DDVP组(Rosc 1×10-4mol·L-1预处理1 h后,加入DDVP 1×10-5mol·L-1作用至48 h)。在96孔板中每孔加入MTT溶液(5 g·L-1)20 μL于培养箱中孵育4 h。孵育结束后吸出原有培养基终止培养,每孔加入二甲亚砜150 μL,室温下充分振荡20 min,使紫色结晶物溶解。设定波长为570 nm,在酶标仪上检测样本的吸光度(A570nm)值。设不加细胞只加培养基的空白对照孔调零,每组设6复孔。细胞存活率(%)=(实验组A570nm-空白组A570nm)(/对照组A570nm-空白组A570nm)×100%。
1.6 AnnexinⅤ-FlTC/Pl双染法检测细胞凋亡率
将对数生长期SHSY-5Y细胞接种于6孔板内,换用无血清MEM/F12培养基培养24 h。分组按1.5中⑤给药。每组设3复孔,使用PBS清洗3次,每次5 min,按照说明书加入AnnexinⅤ试剂各5 μL,混匀避光孵育15 min,上机前5 min再加入碘化丙啶(PI)染液各5 μL。混匀,流式细胞仪检测,激发波长为488 nm,发射波长535 nm。AnnexinⅤ+PI+为晚期凋亡细胞,AnnexinⅤ+PI-为早期凋亡细胞。
1.7 TUNEL检测细胞凋亡
将对数生长期SHSY-5Y细胞均匀接种于含盖玻片的35 mm细胞培养皿内,待细胞生长到融合度为70%~80%时,换用无血清MEM/F12培养基培养24 h。分组按1.5中⑤给药。按试剂盒说明书进行操作,在光学显微镜下观察拍照并记录。棕色为TUNEL染色阳性凋亡细胞。
1.8 Western印迹法检测Cdk5的表达
将对数生长期SHSY-5Y细胞取接种于6孔板内,分为① Oxo-M(0,1×10-8,1×10-6和1×10-4mol·L-1)培养48 h组;② Rosc 1×10-4mol·L-1培养0,10,30和60 min组;③ 细胞对照组、Oxo-M组(Oxo-M 1×10-4mol·L-1作用48 h)、Rosc组(培养结束前1 h给予 1×10-4mol·L-1)、Rosc+Oxo-M 组(Rosc 1×10-4mol·L-1预处理1 h后,再加入Oxo-M 1×10-4mol·L-1作用 47 h);④ DDVP(0,1×10-6,1×10-5,1×10-4和1×10-3mol·L-1)培养48 h;⑤ 细胞对照组、DDVP组(1×10-5mol·L-1作用48 h)、Rosc组(培养结束前1 h加入1×10-4mol·L-1)和Rosc+DDVP组(Rosc 1×10-4mol·L-1预处理1 h后,加入DDVP 1×10-5mol·L-1作用47 h)组。培养结束后弃去培养基,使用预热PBS清洗细胞,每孔加入80 μL的RIPA裂解液提取细胞总蛋白。于冰上裂解10 min后,采用细胞刮片收集细胞。于4℃,16 000×g离心30 min。离心后收集上清蛋白液,BCA试剂盒进行蛋白质定量。每泳道以50 μg蛋白上样。经10%SDS-PAGE分离后,转至醋酸纤维膜。5%脱脂奶粉室温封闭1 h,加入小鼠抗人Cdk5多克隆抗体、兔抗小鼠β肌动蛋白单克隆抗体(1∶1000,TBST稀释),4℃孵育过夜。再加IRDye 680RD荧光标记的山羊抗兔和IRDye800CW荧光标记的山羊抗小鼠IgG抗体(二抗,1∶2500,TBST稀释),室温孵育1 h,最后使用Odyssey双色红外荧光成像系统扫描显影。用吸光度分析软件Image J软件对条带的积分吸光度(integrated absorbance,IA)值进行计算,以IA目的蛋白/IAβ肌动蛋白比值代表目的蛋白表达水平。
1.9 统计学分析
实验结果数据以±s表示,采用GraphPad Prism 7 Project软件进行数据分析处理,多组之间均数比较采用单因素方差分析以及单因素方差分析中Dunnettt检验进行分析处理,以P<0.05为差异具有统计学意义。
2 结果
2.1 胆碱能M受体和Cdk5均在SH-SY5Y细胞中表达
通过免疫荧光和激光共聚焦实验检测SH-SY5Y细胞中乙酰胆碱能M1受体与Cdk5的分布与表达,FITC(绿色荧光)标记为M1受体,TRITC(红色荧光)标记为Cdk5激酶。如图1免疫荧光结果显示,M1受体和Cdk5均在SH-SY5Y细胞质中大量表达。
2.2 Oxo-M过度激活胆碱能M受体诱导的SH-SY5Y细胞损伤
2.2.1 Oxo-M对SH-SY5Y细胞存活率的影响
如表1结果显示,与细胞对照组相比,当Oxo-M浓度为1×10-8和1×10-6mol·L-1时,细胞存活率无明显变化,浓度升高至1×10-4和1×10-2mol·L-1时细胞存活率显著降低(P<0.05)。表2结果显示,与细胞对照组相比,SH-SY5Y细胞经Oxo-M 1×10-4mol·L-1处理24 h,细胞存活率无明显变化;处理48 h细胞存活率显著降低(P<0.05);处理72 h时细胞存活率仅为(27.6±4.6)%(P<0.01)。为此,为满足正常细胞实验,确定后续研究给药时间为48 h。
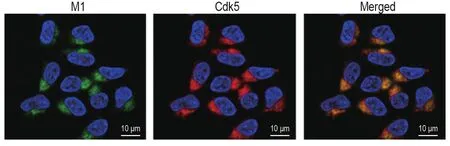
Fig.1 Expression of muscarinic receptor 1(M1 receptor)and cyclin-dependent kinase 5(Cdk5)in SH-SY5Y cells.The immunoreaction labeling of M1 and Cdk5 was determined by using confocal microscopy analysis.The green represents the M1 receptor,red represents Cdk5,and blue represents the nucleus.
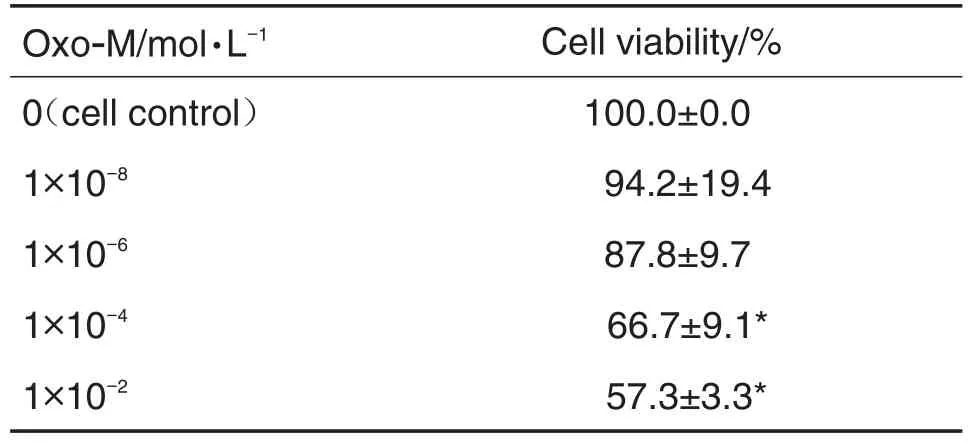
Tab.1 Effect of different concentrations of oxotremorine(Oxo-M)for 48 h on SH-SY5Y cell viability

Tab.2 Time-effects of Oxo-M 1×10-4mol·L-1on SH-SY5Y cell viability
2.2.2 Oxo-M对SH-SY5Y细胞Cdk5表达的影响
如图2结果显示,与细胞对照组相比,Oxo-M 1×10-8和1×10-6mol·L-1处理SH-SY5Y细胞48 h后,Cdk5表达无明显变化。当Oxo-M浓度升高为1×10-4mol·L-1时,Cdk5表达明显增强(P<0.05)。
2.3 Rosc减轻Oxo-M诱导的SH-SY5Y细胞损伤
2.3.1 Rosc对SH-SY5Y细胞Cdk5表达的影响
Rosc是一种高活性Cdk5激酶抑制剂,可有效抑制胞内Cdk5激酶活性。如图3显示,与细胞对照组相比,Rosc 1×10-4mol·L-1作用10和30 min,Cdk5表达无明显改变。当Rosc作用60 min时,Cdk5表达明显降低(P<0.05)。故选择Rosc 1×10-4mol·L-1预处理细胞1 h,观察Rosc对Oxo-M诱导的SH-SY5Y细胞损伤的影响。

Fig.2 Effect of Oxo-M for 48 h on Cdk5 expression of SH-SY5Y cells detected by Western blotting.IA:integrated absorbance.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
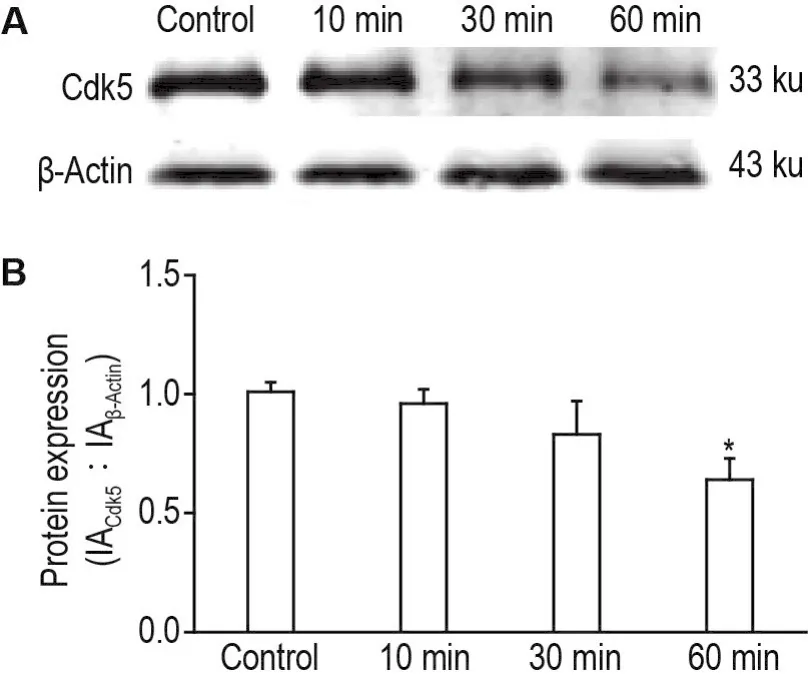
Fig.3 Time-effects of roscovitine(Rosc)on Cdk5 expression of SH-SY5Y cells detected by Western blotting.SH-SY5Y cells were treated with Rosc 1×10-4mol·L-1for 0,10,30 and 60 min,respectively.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
2.3.2 Rosc对Oxo-M诱导的SH-SY5Y细胞损伤的影响
由表3结果显示,与细胞对照组相比,Oxo-M组细胞存活率明显减少(P<0.05),Rosc和Rosc+Oxo-M组无明显改变。与Oxo-M组相比,Rosc+Oxo-M组细胞存活率明显增加(P<0.05)。表明Cdk5抑制剂Rosc可显著减轻Oxo-M诱导的SH-SY5Y细胞损伤。
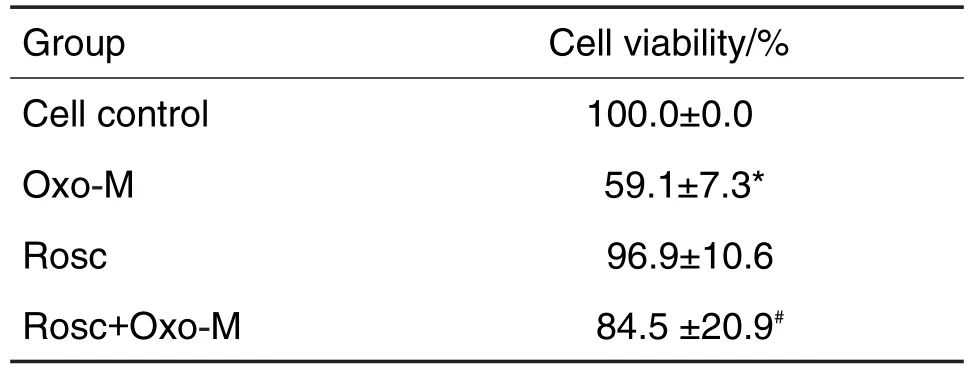
Tab.3 Effect of Rosc on Oxo-M-induced injury in SH-SY5Y cells
2.3.3 Rosc对Oxo-M诱导的SH-SY5Y细胞Cdk5表达的影响
如图4显示,与细胞对照组相比,Oxo-M组Cdk5表达明显升高,Rosc组明显降低(P<0.05)。与Oxo-M组相比,Rosc+Oxo-M组Cdk5表达明显被抑制(P<0.05),表明Rosc显著抑制Oxo-M诱导的Cdk5表达。提示抑制Cdk5表达可减轻Oxo-M过度激活胆碱能受体诱导的SH-SY5Y细胞损伤。
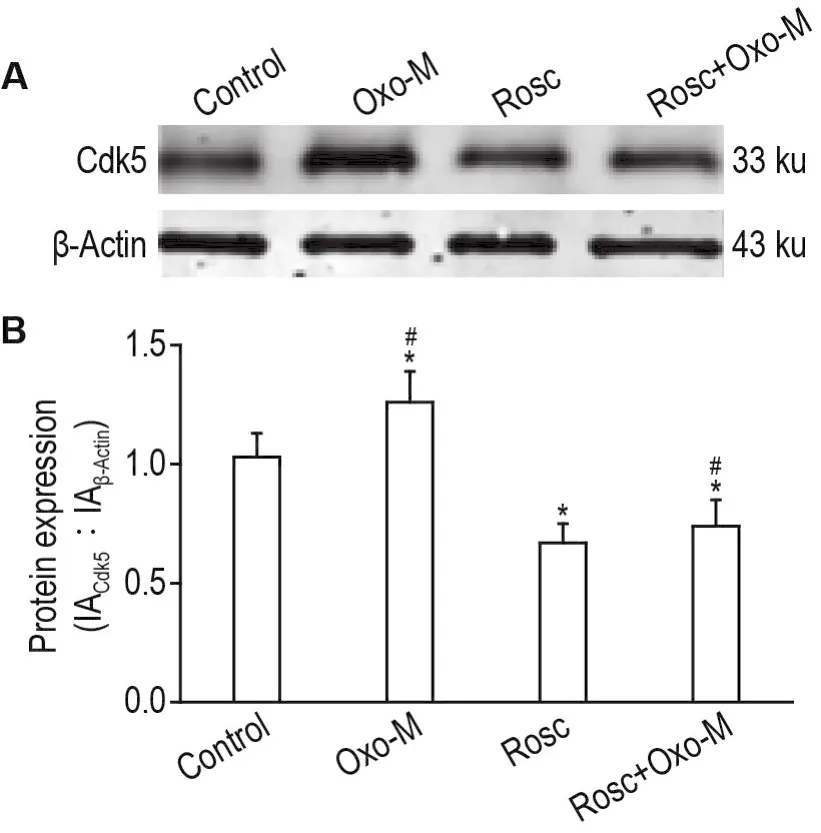
Fig.4 Effect of Rosc on Oxo-M induced Cdk5 expression combined with injury of SH-SY5Y cells detected by Western blotting.See Tab.3 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group;#P<0.05;compared with Oxo-M group.
2.4 DDVP诱导SH-SY5Y细胞损伤并上调Cdk5表达
2.4.1 DDVP对SH-SY5Y细胞存活率的影响
由表4结果可知,与细胞对照组相比,DDVP 1×10-6mol·L-1组细胞存活率无明显变化,DDVP 1×10-5和1×10-4mol·L-1组细胞存活率明显降低(P<0.05),DDVP 1×10-3mol·L-1组细胞存活率仅为(10.0±5.5)%(P<0.01)。故选择DDVP 1×10-5mol·L-1作用SH-SY5Y细胞48 h进行后续实验。
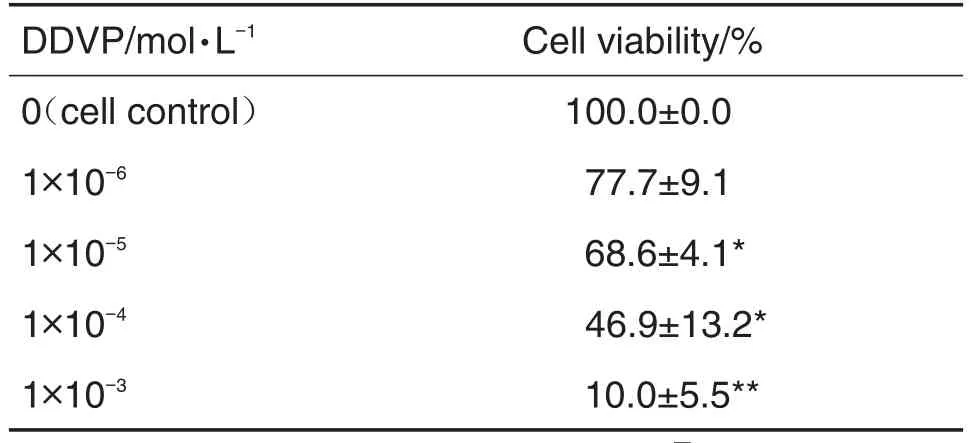
Tab.4 Effect of dimethyl-dichlorovinyl-phosphate(DDVP)for 48 h on SH-SY5Y cell viability
2.4.2 DDVP对SH-SY5Y细胞Cdk5表达的影响
图5结果显示,与细胞对照组相比,DDVP浓度为 1×10-6mol·L-1时Cdk5表达无明显变化,1×10-5和1×10-4mol·L-1时Cdk5表达显著增加(P<0.05)。表明DDVP1×10-5和1×10-4mol·L-1作用SH-SY5Y细胞48 h可引起Cdk5表达增强。

Fig.5 Effect of DDVP for 48 h on Cdk5 expression in SH-SY5Y cells detected by Western blotting.See Tab.4 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group.
2.5 Rosc可降低DDVP诱导的SH-SY5Y细胞损伤
2.5.1 Rosc对DDVP诱导的细胞损伤的影响
结果如表5所示,与细胞对照组相比,DDVP组细胞存活率明显降低(P<0.05),Rosc组和Rosc+DDVP组无明显变化。与DDVP组相比,Rosc+DDVP组细胞存活率明显升高(P<0.05)。提示Rosc可显著减轻DDVP诱导的SH-SY5Y细胞损伤。

Tab.5 Effect of Rosc on DDVP-induced injury in SH-SY5Y cells
2.5.2 Rosc对DDVP诱导的SH-SY5Y细胞Cdk5表达的影响
如图6所示,与细胞对照组相比,DDVP组Cdk5表达显著升高(P<0.05),Rosc组和Rosc+DDVP可显著抑制Cdk5活性(P<0.05)。与DDVP组相比,Rosc+DDVP组Cdk5表达显著降低(P<0.05),表明Rosc可显著抑制DDVP诱导的SH-SY5Y细胞Cdk5表达上调。
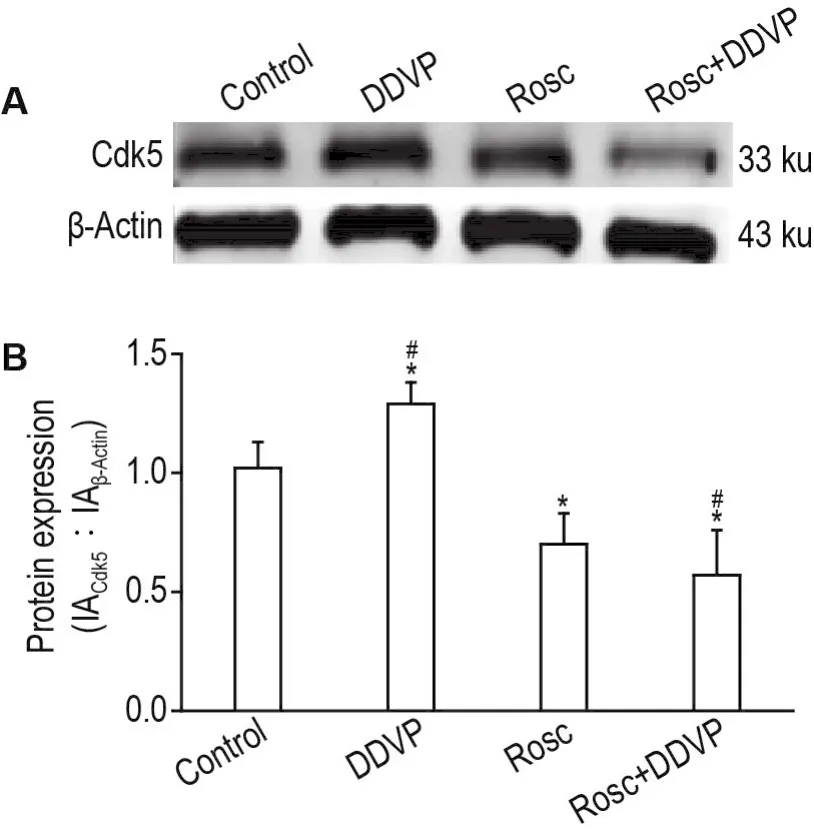
Fig.6 Effect of Rosc on DDVP-induced Cdk5 expression in SH-SY5Y cells detected by Western blotting.See Tab.5 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group;#P<0.05,compared with DDVP group.
2.6 Rosc减轻DDVP诱导的SH-SY5Y细胞凋亡
如图7显示,与细胞对照组相比,DDVP组细胞凋亡率为(64.1±8.4)%,显著升高(P<0.05),Rosc组和Rosc+DDVP组无明显改变。与DDVP组相比,Rosc+DDVP组细胞凋亡率为(34.4±9.5)%,明显降低(P<0.05)。如图8显示,细胞对照组SHSY5Y细胞形态正常,结构完整。DDVP组贴壁细胞表现出皱缩、变圆、染色质浓缩、凋亡小体出现,TUNNEL阳性细胞增多。Rosc组与细胞对照组相比无明显区别。而Rosc+DDVP组TUNNEL阳性细胞显著减少,大部分细胞形态正常,结构较完整。与此提示,Cdk5抑制剂Rosc可以减轻DDVP诱导的SH-SY5Y细胞损伤。

Fig.7 lnhibition of Rosc on DDVP-induced SH-SY5Y cell apoptosis detected by flow cytometry.See Tab.5 for the cell treatment.B was the quantitative result of A.±s,n=3.*P<0.05,compared with cell control group;#P<0.05,compared with DDVP group.

Fig.8 lnhibition of Rosc on DDVP-induced apoptosis of SH-SY5Y cells detected by TUNNEL assay.See Tab.5 for the cell treatment.The black arrows indicate apoptotic cells.
3 讨论
前期研究发现,胆碱能M受体对Cdk5活化存在调控作用[14],但是以原代大鼠纹状体中等棘状神经元为研究载体。本研究选择具有成熟神经元特征、突触结构及轴突囊泡运输功能、分化良好的人神经母细胞瘤细胞SH-SY5Y细胞为模型,研究不同剂量非选择性乙酰胆碱能受体激动剂Oxo-M对Cdk5激酶的表达及SH-SY5Y细胞活性的影响,考察胆碱能M受体长时间激活对SH-SY5Y细胞毒性作用及与Cdk5激酶活性改变的影响,并观察胆碱酯酶抑制剂DDVP对SH-SY5Y细胞的毒性,及伴随Cdk5激酶的表达变化。探讨胆碱能M受体对Cdk5活化是否参与介导DDVP诱导神经细胞损伤过程。
首先,在本研究应用免疫荧光结合激光共聚焦技术可检测到SH-SY5Y细胞中不仅有M1受体表达,而且Cdk5蛋白在SH-SY5Y细胞中大量分布,为实验进一步研究奠定基础。非选择性乙酰胆碱能受体激动剂Oxo-M可有效激活胆碱能M受体,给予不同浓度的Oxo-M处理SH-SY5Y细胞,发现Oxo-M 1×10-8和1×10-6mol·L-1的作用48 h对SH-SY5Y细胞活性无作用,而Oxo-M 1×10-4和1×10-2mol·L-1作用48 h可诱导SH-SY5Y 细胞活性显著降低,结合Western印迹结果表明,Oxo-M 1×10-4mol·L-1可诱导Cdk5蛋白表达增加,同时通过MTT法与Western印迹法结合发现,加入Cdk5激酶抑制剂Rosc后再与Oxo-M共孵育48 h,可抑制Cdk5活性,表明通过降低Cdk5活性可改善Oxo-M抑制细胞活性的作用。综上结果表明,Oxo-M可以激活胆碱能M受体使Cdk5活化,抑制Cdk5活性可改善Oxo-M抑制细胞活性作用。
DDVP是生活、生产中常用有机磷农药,对人中枢神经毒性引发的迟发性损伤更是受到高度重视,其治疗手段有限[15-16]。DDVP及其代谢物中枢中毒机制是通过抑制乙酰胆碱酯酶活性,导致乙酰胆碱无法被分解而大量蓄积于中枢神经而引起的一系列继发性神经损伤。本研究中表明,高浓度Oxo-M对胆碱能M受体的活化作用能诱导Cdk5表达显著升高,从而诱导细胞损伤,推测胆碱酯酶抑制剂DDVP对细胞毒性损伤作用也存在相似致毒机制。使用不同浓度(1×10-6,1×10-5,1×10-4和1×10-3mol·L-1)的DDVP处理SH-SY5Y细胞,随着DDVP浓度升高,细胞毒性呈浓度依赖性增加,其诱导SH-SY5Y细胞凋亡的LD50为(1.62±1.88)×10-5mol·L-1。进一步观察发现,DDVP 1×10-5mol·L-1处理SH-SY5Y细胞48 h引起细胞凋亡的同时,同样上调Cdk5表达,提示Cdk5参与DDVP诱导的细胞损伤。进而通过流式细胞技术和TUNEL检测细胞凋亡,观察Cdk5抑制剂Rosc对DDVP诱导细胞凋亡的影响。结果表明,Rosc与DDVP同时作用后,Cdk5活性被显著抑制,同时DDVP诱导的细胞凋亡显著改善,提示Cdk5介导DDVP的细胞毒性作用。
综上表明,高浓度Oxo-M模拟胆碱能M受体过度激活引发的毒性蓄积作用,使用Cdk5抑制剂Rosc对Cdk5活性抑制后,高浓度Oxo-M对细胞的毒性损伤作用得到缓解,表明Cdk5介导高浓度Oxo-M的细胞毒性作用。胆碱酯酶抑制剂DDVP造成SH-SY5Y细胞染毒模型后,伴发Cdk5活性增加,且细胞凋亡率显著升高。Cdk5抑制剂Rosc显著抑制DDVP诱导的SH-SY5Y细胞凋亡,表明抑制Cdk5活性可缓解DDVP所致神经细胞毒性损伤,并对神经元起到一定的保护作用。本研究为探讨救治DDVP中毒作用机制提供了新的思路。

