ERK 基因过表达对肺癌A549 细胞增殖、迁移和侵袭的影响
杨婷婷, 王雅蓉, 战仕胜, 贾琴琴, 王秀青
(宁夏医科大学临床医学院,银川 750004)
肺癌是世界上最常见的恶性肿瘤,每年诊断出新病例超过180 万,总体生存率很低,只有约15%的患者在初次诊断后5 年内存活[1],而普通的外科手术切除治疗、放化疗并不能减少肺癌的发生率[2-3]。因此,探讨肺癌的发生发展规律对肺癌的治疗具有重大意义。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是丝裂原活化蛋白激酶家族的一个亚族,是一种传递丝裂原信号转导蛋白,其所参与的信号通路与大部分肿瘤细胞增殖、侵袭、迁移及凋亡相关[4]。ERK 序列和结构呈现一个高度保守的状态。ERK的特征在于其激活主要由TEY 残基发挥作用,在生长因子及药物多肽等刺激作用下将信号由细胞外传递到核内,从而调控细胞生理活动。ERK/CJUN 氨基末端激酶(C-JUN nterminal kinase,JNK)信号通路是细胞内调控肿瘤细胞增殖与凋亡的重要通路,其异常激活调控着细胞的凋亡、增殖与分化[5]。以往研究ERK 功能及相关机制采取瞬时转染,考虑到ERK 外源基因在肺癌中高表达等问题不利于研究ERK 活性在肺癌细胞增殖中的具体机制,本研究旨在通过对ERK 进行稳定过表达,探究ERK 过表达后对细胞增殖、侵袭和迁移以及ERK/JNK 通路中相关蛋白的影响,以期为后续研究肿瘤发展相关的信号通路奠定一定基础。
1 材料与方法
1.1 仪器与试剂
人肺腺癌细胞系A549 来源于宁夏医科大学总医院干细胞研究所;PCDH 载体购自美国SBI公司;大肠杆菌菌株DH5α、293T 细胞株购自天根生化科技有限公司;EZNA Total RNA KITI 购自OMEGA 公司;细胞培养试剂RPMI1640、胰蛋白酶、双抗均购自美国Gibico 公司;限制性内切酶NotI 和XbaI、T4 DNA 连接酶购自美国NEB 公司;去内毒素小量提取试剂盒、大量质粒提取试剂盒、琼脂糖凝胶DNA 回收试剂盒购自天根生化有限公司;Protoscript II first strand cDNA 合成试剂盒、Q5 hot start 高保真聚合酶购自NEB 公司;脂质体转染试剂Lipo-3000 购自美国Invitrogen公司;引物及测序由上海生工有限公司完成;P-ERK、ERK、P-CMYC 等单克隆抗体购自Abcam 有限公司。倒置荧光显微镜购自日本Olympus公司;电泳仪、免疫印迹实验转膜仪购自北京市六一仪器厂;PCR 仪购自美国ABI 公司;高压蒸汽灭菌器购自日本TOMY 公司;Multiskan GO 全波长酶标仪购自美国Thermo Fisher 公司;凝胶成像仪购自美国Bio-rad 公司。
1.2 实验方法
1.2.1 合成目的基因ERK 并连接至PCDH 载体 根据Genebank 中人ERK 基因序列,其CDS 区为NM138957.3,全长为1083 bp 设计引物,扩增ERK CDS 序列,根据载体pCDH-CMV-MCS-EF1α-GreenPuro 序列特征引入XbaI 和NotI 的酶切位点和保护碱基,合成目的片段。按照引物设计原则,用primer 5.0 软件设计引物,根据载体酶切位点在寡合苷酸两端分别加上XbaI 和NotI 限制性酶切位点及保护碱基。引物设计如下:上游引物序列5'-CTAGT CTAGAGCCACCA TGGCGGCGGCGGCGGCG-3',下游引物序列5'CTTCGCGGCCGCTTAAGATCTGTATCCT GGCT-3',在A549细胞中提取RNA 并检测质量和浓度,通过RTPCR 技术获取ERK 基因,其反应条件为98 ℃,30 s;98 ℃,10 s;72 ℃,60 s;共35 个循环,72 ℃,2 min;PCR 产物用2%琼脂糖凝胶电泳进行鉴定回收,载体进行双酶切,琼脂糖凝胶纯化,用T4连接酶将酶切片段与线性化载体连接,转化感受态细胞,涂至含氨苄青霉素的LB 培养基,设置空载体质粒涂板进行对照,37 ℃培养箱中培养过夜,次日挑取若干阳性菌落提质粒,用两种限制性内切酶NotI 和XbaI 进行双酶切,琼脂糖凝胶电泳初步鉴定是否重组成功。选取部分阳性质粒进行测序。
1.2.2 用293T 细胞对重组慢病毒载体进行包装 将生长状态良好的293T 细胞接种至100 mm 细胞培养皿中,用Opti-MEM 进行培养,细胞生长至70%~90%汇合度时将重组质粒和包装质粒用lipo3000 共转染293T 细胞,对照组设置为空质粒转染组,用Opti-MEM 稀释Lipo-3000,将四种质粒(测序成功的pCDH-CMV-MCS-EF1α-GreenPuro-ERK 慢病毒重组质粒及其辅助包装原件载体质粒plp1、plp2 和plp/vsvg)与脂质体混合物室温孵育10~15 min,随后加入到293T 细胞培养皿中进行转染,37 ℃孵育细胞6 h 后更换为完全培养基,培养24 h 和48 h 后,收集富含慢病毒颗粒的细胞上清液,离心,去除细胞碎片,然后收集病毒上清液,利用超速离心法:4 °C,82700×g,离心120 min,对其超速离心浓缩,最后得到高滴度的慢病毒超离液。
1.2.3 慢病毒滴度测定 将生长状态良好的293T 细胞消化计数后稀释至1×105/mL,加入96孔板,100 μL/孔,为每个病毒准备6 个孔。放入37°C,5%CO2培养箱中培养。第2 天,准备6 个1.5 mL EP 管,第1 个EP 管中加入10 μL病毒液,然后做3 倍梯度稀释,共6 个稀释度。第3 天,有需要加puromycin 筛选的孔,先吸去100 mL 含病毒培养基,加入100 μL 含1.5 μg·mL-1puromycin 的10% FBS 完全培养基。第5 天,在荧光显微镜下观察结果,观察结果前6 h 需更换新鲜10 %FBS 完全培养基,从孔中吸出80 μL 培养基,然后加入80 μL 新鲜10 % FBS 完全培养基,放入37 °C ,5% CO2培养箱中培养。6 h 后荧光显微镜下观察结果,荧光百分比在10% ~50% 的孔计算病毒滴度。病毒滴度(TU·mL-1)= 细胞数×阳性克隆百分比×感染复数(MOI)×病毒稀释倍数×103。
1.2.4 慢病毒转染A549 细胞株 将A549 细胞分为空白组(A549 细胞)、空载体组(慢病毒空载体转染A549 细胞)、过表达ERK 组(转染过表达ERK 慢病毒的A549 细胞),待A549 细胞生长至对数期后,用胰酶消化并收集,将细胞稀释至细胞密度为1.5×105/mL,接种于六孔板,24 h 后按不同MOI 加入慢病毒,添加polybrene 助染。病毒感染24 h 后,弃去病毒感染液,换新鲜完全培养基。在感染24 h、48 h 后荧光显微镜下观察绿色荧光蛋白的表达并拍照。
1.2.5 Puromycin 筛选稳定表达ERK 的A549 细胞系 因本重组慢病毒载体上带有puromycin 抗性基因,采用puromycin 处理,筛选出成功感染病毒的细胞。利用嘌呤霉素杀灭曲线确定能够杀死含有空载体A549 细胞的最低puromycin 浓度,将A549 细胞接种于24 孔板使第2 天融合率为60%,24 h 后分别加入含不同浓度puromycin 的新鲜培养基,在8 个孔中分别加入终浓度为0 、0.5、1、2、4、6、8、10 μg·mL-1的puromycin。随后每孔用各自浓度的puromycin 继续处理48 h,进一步观察细胞的死亡情况,最终测得能够杀死A549空载体细胞的最低puromycin 浓度为1μg·mL-1。以摸索到的puromycin 浓度处理细胞,48 h 后换新鲜的含有puromycin 的培养基继续培养进行筛选。
1.2.6 筛选细胞的放大培养 利用puromycin 筛选完两代A549 细胞后,待细胞长满后收样做Real-time PCR 检测,检测过表达倍数最高且状态良好的细胞进行扩增,待细胞长满后进行冻存。在冻存细胞系以后需进行复苏验证,本次实验复苏出的A549 细胞ERK 空载体对照稳转细胞株和过表达ERK 稳转细胞系状态良好,细胞存活率高且无污染。
1.2.7 Real-time PCR 检测目标分子mRNA 表达Trizol 法提取细胞中总RNA,利用PCR 逆转录获得cDNA,引物序列见表1。Real-time PCR 反应条件为95 ℃,180 s;94 ℃,15 s;60 ℃,30 s;72 ℃,30 s;共40个循环,随后95℃,10s;65℃,60s;97℃,1 s。
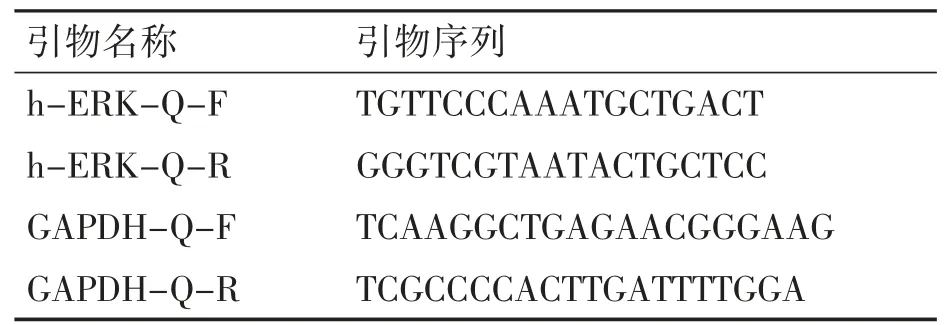
表1 Real-Time PCR 引物序列
1.2.8 Western blot 检测过表达后ERK 变化 用含有浓度1 μg·mL-1的嘌呤霉素培养基传代普通未转染载体的A549 细胞,ERK 过表达后的A549 细胞、含有空载体的A549 细胞,待生长至对数期后收集细胞,裂解,提取总蛋白,按一抗1∶1000 稀释,以β-Tubulin 为内参蛋白,4 ℃孵育过夜,二抗室温2 h,洗膜三次后用ECL 试剂盒显影特异蛋白条带。
1.2.9 CCK-8 增殖实验 生长至对数期的过表达ERK 组、空载体组及空白组A549 细胞,以2×103个/孔接种于96 孔板中,细胞贴壁后,分别在0 h、24 h、48 h、72 h 加入10 μL 的CCK-8 试剂并在37 ℃孵育2 h,检测450 nm 处吸光度值。
1.2.10 划痕实验 在六孔板中接种适宜数量的生长至对数期的过表达ERK 组、空载体组及空白组A549 细胞,待细胞生长至80%左右时,用100 μL 无菌吸头于六孔板中间画一直线,用PBS清洗后加入完全培养基继续培养24 h,拍照并计算细胞迁移率。迁移率(%)=(初始划痕宽度值-24 h 后划痕宽度)/初始划痕宽度×100%。
1.2.11 Transwell 细胞侵袭实验 Transwell 小室中于上室均匀加入100 μL Matrigel 胶,下室加入含20%胎牛血清的RPMI1640 培养液,收集生长至对数期的过表达ERK 组、空载组及空白组A549 细胞,以3×104个接种于小室,37 ℃培养24 h 后取出上室,4%多聚甲醛处理,结晶紫染色并观察。
1.2.12 Western blot 检测ERK/JNK 通路部分蛋白变化 生长至对数期的过表达ERK 组、空载体组及空白组A549 细胞培养至生长密度80%左右时,加入冷PBS 洗两次;加入配制好的预冷Lysis Buffer,冰上裂解30 min,取上清为全蛋白提取物,BCA 法测定蛋白浓度,取等量蛋白上样,按Western blot 正常步骤进行实验,随后根据ECL 化学发光检测试剂盒说明进行操作,置于化学发光仪曝光。
1.3 统计学方法
采用SPSS 17.0 软件进行统计学分析,所有数据均符合正态分布和方差齐性检验。计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析(ANOVA),两两比较采用SNK-q检验,P≤0.05 为差异有统计学意义。
2 结果
2.1 ERK 基因合成及重组载体的构建和鉴定
ERK 基因CDS 区全长1083 bp,经RT-PCR逆转录扩增出目的条带后,经1%琼脂糖凝胶电泳,用紫外凝胶检测仪检测可以看到在1083 bp处有明显DNA 条带,电泳结果与理论结果一致(图1A);经T4 连接酶重组连接后,转化感受态进行涂板,挑取可疑菌落,37 ℃摇菌16~18 h 后提取重组质粒进行初步鉴定,经限制性内切酶XbaI 和NotI 酶切后,可观测到切出目的基因片段(图1B);在细菌培养皿上挑选9 个可疑阳性克隆进行菌落扩增后行初步酶切鉴定,凝胶分析结果显示1~9 号样本得到与预期分子质量大小较一致的条带,其中5 号条带表达较弱(图1C)。随后进行测序,测序结果表明ERK 过表达重组质粒构建成功(图2)。
2.2 慢病毒包装及滴度测定
将慢病毒包装质粒plp1、plp2 和plp/vsvg 与重组质粒共转染293T 细胞后,用荧光显微镜分别观察24 h、48 h 荧光表达情况,转染效率达到80%以上,说明转染成功(图3)。采用有限稀释计数法,在荧光显微镜下观察结果,用荧光百分比在10%~50% 的孔计算病毒滴度,通过感染后的活细胞的数量来计算病毒滴度,测得最终滴度为5×108TU·mL-1。
2.3 慢病毒转染A549 细胞及稳定细胞系的筛选
慢病毒在感染A549 细胞48 h 后,待细胞的融合率达到80%~90%,细胞进行传代,用嘌呤霉素继续筛选。在倒置荧光显微镜下可观察到A549 细胞持续表达绿色荧光,且细胞状态良好,无明显形态学变化(图4)。
2.4 重组质粒过表达效果的鉴定
根据ERK 及GAPDH Real-Time PCR 引物序列(表1),对嘌呤霉素筛选后的A549 细胞提取mRNA 和蛋白并进行Real-time PCR 和Western blot 过表达效果验证。Western blot 蛋白条带灰度分析结果显示,过表达ERK 组A549 细胞中p-ERK、ERK 蛋白表达量均高于空载体组和空白组,且空载体组表达量略低于空白组(P均<0.05),说明p-ERK、ERK 在A549 细胞中有过表达效果。见图5A~B。Real-Time PCR 采用2-△△Ct法分析显示,空白组和空载体组ERK mRNA 表达低于过表达ERK 组A549 细胞(P均<0.05),空白组和空载体组表达差异无统计学意义(P>0.05)。见图5C。
2.5 过表达ERK 对人肺癌A549 细胞增殖能力的影响
CCK8 法检测三组肺癌A549 细胞增殖能力发现,三组不同肺癌细胞其增殖能力随时间变化呈增高趋势,与0 h 比较,24 h、48 h、72 h 后其增殖能力均升高,过表达ERK 组分别与空载体组、空白组相比,在24 h、48 h、72 h 的细胞增殖能力间差异均具有统计学意义(P<0.05),其中过表达ERK 组高于空白组(P<0.05),空白组和空载体组差异无统计学意义(P>0.05),提示过表达ERK可增强肺癌A549 细胞增殖能力(图6)。
2.6 过表达ERK 对人肺癌A549 细胞迁移能力的影响
划痕实验结果显示,过表达ERK 组的细胞迁移率为(0.680±0.034)%,空载体组细胞迁移率为(0.450±0.032)%、空白组细胞迁移率为(0.430±0.030)%,三组细胞迁移率比较差异有统计学意义(F=84.873,P<0.05)。两两比较发现,其中过表达ERK 组高于空白组以及空载体组(P均<0.05),空白组和空载体组比较差异无统计学意义(P>0.05),提示过表达ERK 可增强肺癌A549 细胞迁移能力(图7)。
2.7 过表达ERK 对人肺癌A549 细胞侵袭能力的影响
Transwell 实验结果显示,过表达ERK 组的平均穿膜细胞数较空载体组和空白组明显增多,过表达ERK 组平均穿膜细胞数(215±2)个、空载体组平均穿膜细胞数为(87±5)个、空白组平均穿膜细胞数为(101±4)个,其中过表达ERK 组平均穿膜细胞数均多于空白组、空载体组(P均<0.05),空载体组少于空白组(P<0.05),提示过表达ERK可增强肺癌A549 细胞侵袭能力(图8)。
2.8 Western blot 检测ERK/JNK 蛋白表达
分别提取过表达ERK 组、空白组和空载体组A549 细胞的蛋白进行电泳后对灰度值进行比较,得出肺癌A549 细胞中过表达ERK 组p-90RSK、C-JUN、C-MYC、P-JNK、JNK 蛋白水平相较于空载体组和空白组发生上调(P均<0.05),提示ERK 过表达后对ERK/JNK 相关蛋白的表达也有影响(图9)。
3 讨论
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路是细胞中主要的基本信息传递链[6]。将细胞外的信号传递到细胞核内,从而引发一系列细胞生理活动,并参与细胞的生长、发育、分化和凋亡。迄今为止,在真核细胞中存在六种MAPK 信号通路,其中最主要的三条通路包括ERK/MAPK 信号通路、JNK 转导通路和P38 信号通路,这三者共同影响着细胞的存活与凋亡[7]。
ERK 是ERK/MAPK 信号级联通路的重要组分[8-9],包括ERK1、ERK2 两种亚型,两者具有83%的氨基酸同一性,并且在所有组织中表达呈不同程度,在脑、骨骼肌、胸腺和心脏中具有特别高的水平[10]。 ERK 被多种生长因子激活后,后续可进一步通过受体酪氨酸激酶磷酸化激活Ras-Raf-MEK-ERK 信号通路从而控制肿瘤细胞的一系列功能[6]。研究表明,生长因子诱导的RAFMEK-ERK 通路与肺癌细胞的增殖、侵袭和迁移密切相关,丝裂原刺激后,ERK 可被活性氧(ROS)、Ca2+激活,接受上游的级联反应信号,将细胞外的信号传递到膜内[11],使细胞胞浆蛋白发生磷酸化,并且磷酸化一些核内的转录因子如C-FOS、CJUN、Elk-1、C-MYC 和ATF2 等,从而调控细胞的增殖、分化和凋亡。C-JUN、C-MYC 作为一种原癌基因,在血清,多种生长因子刺激后,作用于胞核DNA 序列,引起DNA 合成发生变化,最终导致细胞发生增殖[8]。核糖体S6 激酶(p90-RSK)是ERK/MAPK 信号级联通路的下游组分,由ERK/MAPK 途径激活,可调节多种细胞过程,包括基因转录、细胞增殖以及细胞生长和分化。在肺癌中,它与促进肺癌细胞的存活密切相关,研究表明,RSK 的激活或过表达是通过促凋亡蛋白Bad 失活抑制细胞死亡[12]。
JNK 是MAPK 信号通路的重要分支,其在基因表达、细胞增殖等细胞调控方面具有重要作用。JNK 未激活时,主要存在于细胞胞浆中,部分存在于细胞核中;激活后,JNK 积聚于核内,并激活下游基因的表达,调控细胞增殖、细胞周期等。目前许多实验都在肿瘤中可观察到JNK 的活性增高,表明JNK 与促进肿瘤细胞增殖有关联,例如在非小细胞肺癌中药物Diversin 通过激活Wnt/JNK 通路对非小细胞肺癌的侵袭转移发挥上调作用[13]。另外,在化学物质二乙基亚硝铵诱导的肝癌中,JNK 持久激活。而JNK1 基因敲除小鼠则对诱导的肝癌敏感性降低[14]。
通过验证慢病毒介导ERK 感染A549 细胞后ERK mRNA 和蛋白水平,说明成功构建ERK过表达稳转细胞株,并且C-JUN、C-MYC、p-90RSK在ERK 过表达后均出现表达上调,且CCK-8 增殖实验、侵袭实验也说明过表达ERK 后,肺癌A549 增殖和侵袭能力增加,说明ERK 过表达后,肺癌细胞A549 的增殖、迁移、侵袭可能与ERK/JNK 信号通路有关。
——一道江苏高考题的奥秘解读和拓展

