影响帕金森病运动亚型的相关因素分析
赵文婷,伊新艳,张 璇
帕金森病(Parkinson’s disease,PD)是一个常见的逐渐进展的中老年运动障碍性疾病,其临床症状包括运动迟缓、僵直、姿势不稳等运动症状,以及便秘、焦虑、抑郁、认知减退等非运动症状。并且各种内源性和外源性因素使帕金森病患者临床表现具有显著的异质性。其中步态和姿势异常(PIGD)亚型[1]进展速度快,致残率高,给帕金森病患者带来极大痛苦。因此,本研究针对步态和姿势异常(PIGD)亚型的患者,进行临床分析研究影响其亚型的相关因素。
1 资料与方法
1.1 研究对象 选择2019年1月至2020年1月就诊于我院帕金森病专科门诊的79例帕金森病患者。入选标准:依据中国帕金森病的诊断标准(2016版)[2]诊断为原发性帕金森病。排除标准:存在严重的认知障碍或精神症状;严重肝肾功能不全等其他脏器衰竭患者。
根据MDS-UPDRS的TD/PIGD评分进行亚型分类[3],累计MDS-UPDRS项目2.10、3.15a、3.15b、3.16a、3.16b、3.17a、3.17b、3.17c、3.17d、3.17e和3.18的震颤项目平均值除以项目2.12、213、3.10、3.11和3.12的轴性项目平均值。如果比值≥1.15的患者归类为TD亚型,比值≤0.90的患者归类为PIGD亚型,比率在0.90到1.1之间患者归类为不确定[4]。按照上述方法排除10例不确定亚型,将69例原发性帕金森病患者分为TD组33例,PIGD组36例。
所有入选患者的临床诊断由从事帕金森病专业的主任医师确定,收集临床资料、量表评定均由两位接受特定培训的神经内科医师完成。研究对象均对本研究知情并签署知情同意书。
1.2 方法 本研究采用统一化的临床问卷量表收集患者的临床资料,并使用相关量表测评患者临床症状严重程度。记录的临床资料包括:性别、发病年龄、受教育程度、病程、家族史、治疗方案、是否患有冠状动脉粥样硬化、糖尿病等其他共病。对患者进行以下量表评估:Hoehn-Yahr量表、MDS-UPDRS量表、非运动症状评价量表(Non-motor symptoms scale,NMSS)、帕金森病睡眠量表(Parkinson’s disease sleep scale,PDSS)、简明智力状态检查(MMSE)、汉密尔顿抑郁量表(HAMD)、汉密尔顿焦虑量表(HAMA)、帕金森病生活质量评价量表(PDQ-39)。

2 结 果
2.1 帕金森病患者一般临床资料 本研究纳入的69例PD患者,年龄平均为(62.80±7.82)岁,男性35例(50.72%),受教育程度以小学(23.19%)为主,病程平均为(2.98±1.42) y,H-Y分级在1~3级之间,每日服用左旋多巴的等效剂量平均为(438.06±180.44)mg(见表1)。
PIGD组发病年龄明显高于TD组(P<0.05)。对发病年龄与PIGD亚型进行相关分析示点二列相关系数为0.383(P<0.05),说明发病年龄与PIGD亚型有低度的相关性。在受教育水平上,TD组明显高于PIGD组,差异具有统计学意义(P<0.05)。PIGD亚型患者常伴随心脑血管疾病,并且共病严重程度高于TD组(P<0.05)。对共病严重水平与PD亚型进行肯德尔相关性分析示两者呈低度的相关性。两组在家族史、病程、服用左旋多巴等效剂量的差异无统计学意义(见表1、表3)。
2.2 PIGD亚型与TD亚型运动症状和非运动症状的比较 PIGD组H-Y分级的中位数为2.5级,四分位间距为2.5级~3级,明显高于TD组(P<0.001),并且MDS-UPDRS评分明显高于TD组(P<0.05)。并且H-Y分级、UPDRS评分与PIGD亚型均有正相关性,这表明PIGD组患者疾病进展速度越快,病情越重,该患者为PIGD亚型的可能性越大。在MDS-UPDRS第Ⅲ部分、第Ⅳ部分评分,两组间差异无统计学意义,说明两种亚型在早中期的运动症状以及运动波动的总体严重程度相同。但PIGD组运动迟缓(P<0.05)、僵直(P<0.05)以及姿势与步态(P<0.001)评分明显高于TD组,并且上述症状与PIGD亚型呈低度正相关性,说明PIGD亚型主要特点以运动迟缓、僵硬、姿势不稳为主,TD亚型震颤症状更为突出。两组UPDRS-II部分、HAMA、HAMD、MMSE、NMSS、PDSS、PDQ-39量表得分差异无明显统计学意义,说明两组在整体生活能力、焦虑、抑郁、认知、睡眠的方面无明显差异(见表2、表3)。
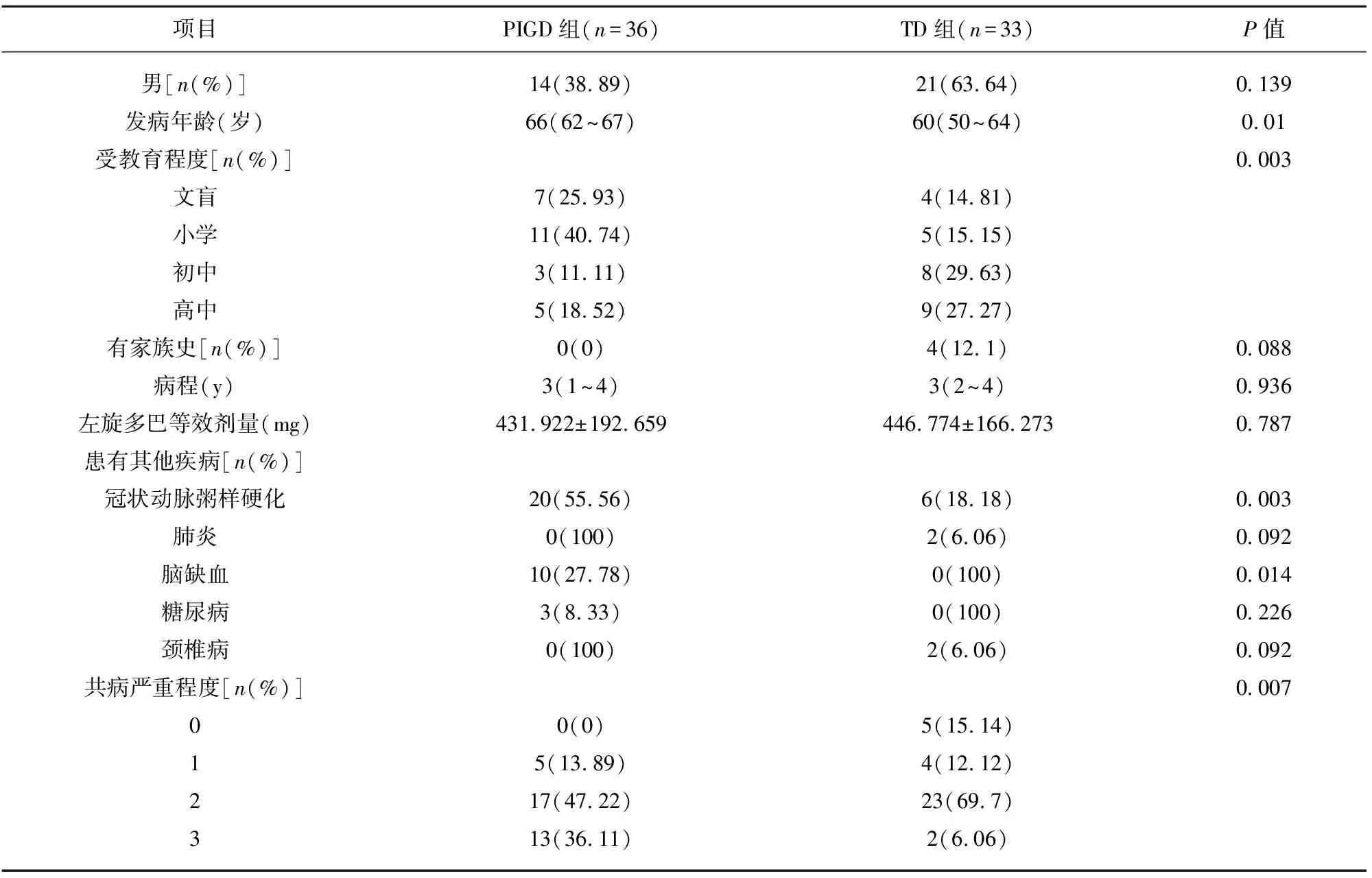
表1 PIGD组和TD组的临床资料
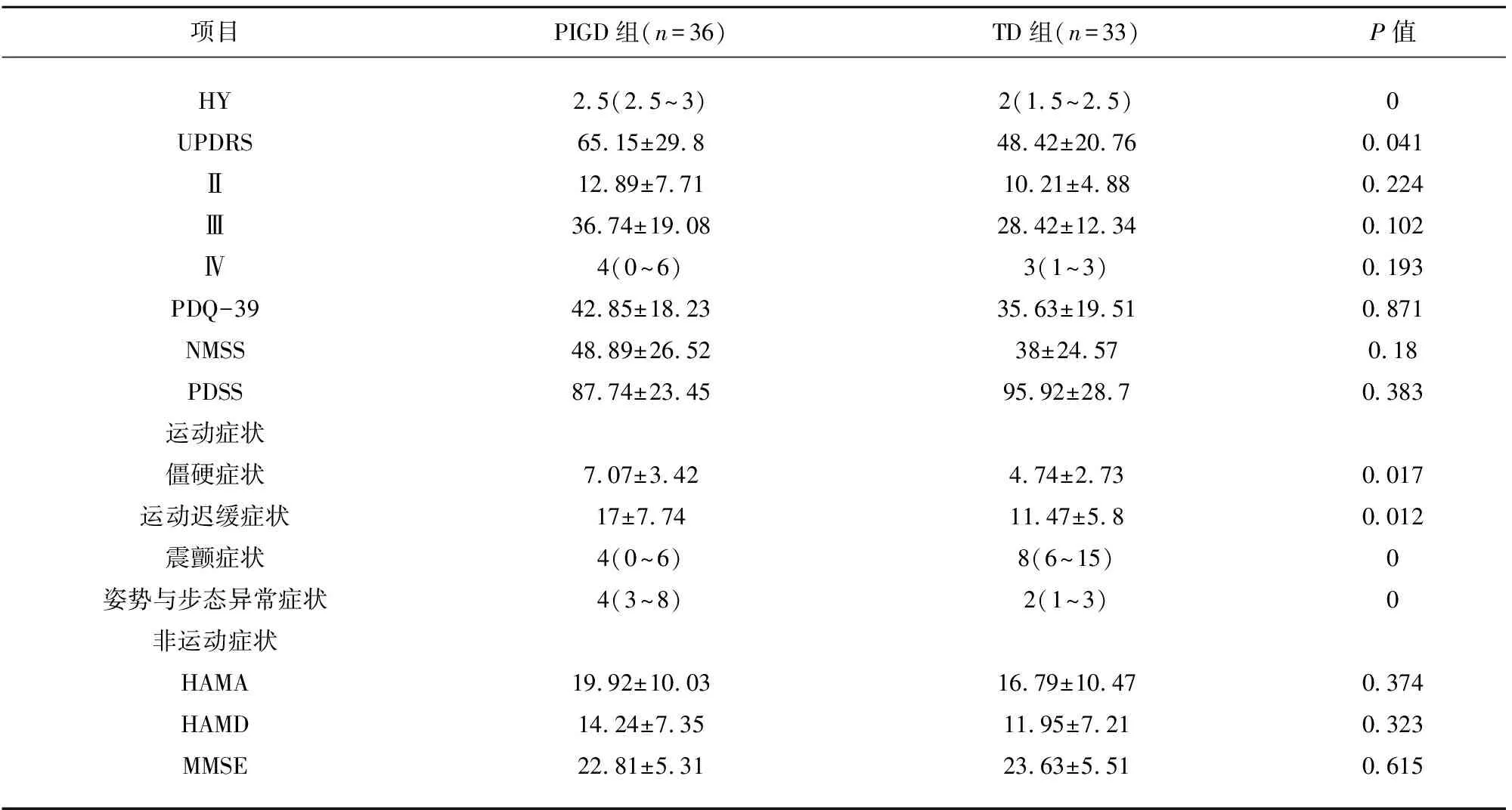
表2 PIGD组和TD组运动症状和非运动症状(分)
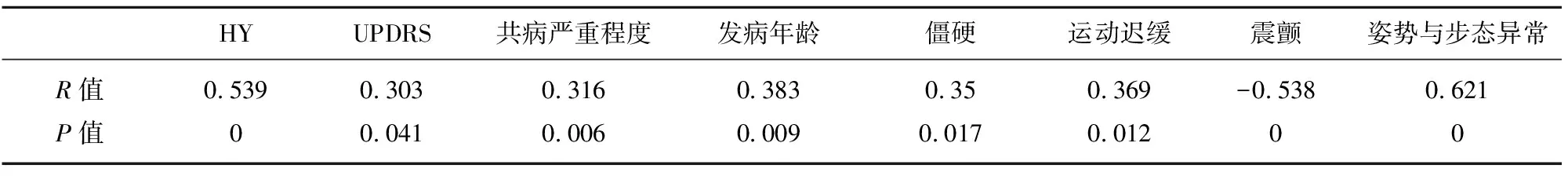
表3 运动症状与PD亚型的相关性
3 讨 论
不同运动亚型常预示患者预后不同。PIGD亚型进展速度快,姿势不稳与步态障碍突出,需尽早予以左旋多巴治疗。其中冻结步态与较长的病程、运动障碍、快速眼动(REM)睡眠行为障碍、乏力和认知障碍密切相关[5]。轴性损害使患者体力不足加重,活动明显受限,尤其在家中较狭窄的空间里行走时,极易出现冻结步态,增加跌倒的风险[6]。因此,轴性损害对PD患者整体活动能力和行走能力产生负面影响[7]。研究表明姿势不稳和步态障碍评分较高的患者更快出现残疾,并且姿势不稳和步态障碍的严重程度是预测PD进展的主要因素[8]。
本研究中两组亚型在非运动症状的差异无统计学意义,但研究显示认知、情感以及步态之间的相互作用会导致姿势和步态障碍的加重[9]。一项针对具有极轻微震颤症状,姿势不稳与步态障碍症状的小部分重叠患者进行横断面研究,发现虽然MMSE和MOCA总评分无明显区别,但是PIGD患者视空间能力减退[10]、执行能力下降[11],并且该领域认知障碍[12]的严重程度与姿势和步态稳定性有关[13]。这可能是由于额叶对突触核蛋白非常敏感所较早表现出症状。并且随着病程延长,PIGD亚型的非运动症状会明显加重[14]。这可能是脑干去甲肾上腺素能和胆碱能异常[15]导致PIGD亚型非运动症状的负担增加[16]。目前仅发现GBA基因变异可影响PD亚型。该基因突变引起PIGD患者的葡萄糖脑苷酶活性明显下降,并且通过中断自噬体对胞质的降解过程,导致错折叠的蛋白无法被降解,引起α-突触核蛋白堆积[17],引起PIGD亚型认知功能和运动症状快速进展。此外,62%TD亚型患者5 y后会出现明显的轴性症状,提示向PIGD亚型转变。这可能由于病理改变从脑干的局部病变向更广泛的神经组织发展[18]。
左旋多巴治疗帕金森病的利弊是有争议的。大多数研究认为左旋多巴能够改善一些运动症状,如震颤和运动迟缓,但同时也会降低姿势和步态稳定性。研究表明高剂量左旋多巴与PIGD亚型步态稳定性的恶化相关。在服用大剂量左旋多巴(>750 mg/d)患者中81%为PIGD亚型。并且与低剂量组(<750 mg/d)相比,患者在服用大剂量的左旋多巴制剂后步态稳定性明显下降。这可能由于患者的运动感受器已受损,从而导致患者无法控制受益于左旋多巴改善的僵直和运动迟缓,引起姿势和步态稳定性的下降。因此,左旋多巴仅能改善非PI GD亚型或者仅需服用小剂量左旋多巴制剂(<750 mg/d)的PIGD亚型患者步态稳定性[19]。
另外,导致PIGD亚型姿势和步态稳定性对左旋多巴治疗不敏感,还可能由于PIGD亚型患者有严重非多巴胺能损伤。有研究表明脑白质病[20]分级是PIGD运动表型独立相关变量,轴性症状与脑白质疏松症状高度相关性[21]。脑白质疏松症导致连接基底神经节和额叶通路病变,还通过涉及步态和平衡功能的皮质-皮质下束来影响轴性症状。这可以解释了左旋多巴治疗震颤、僵直和运动迟缓的效果良好(局灶性黑质多巴胺能细胞的丢失),而对轴性症状和言语障碍没有良好的反应。控制与白质病相关的血管危险因素可能对延迟PD运动功能损害具有重要意义[22]。
多巴胺治疗对运动能力改善的降低还与广泛的皮质萎缩[23]有关。研究发现冻结步态患者的皮质中楔前叶、顶叶和额叶发生明显萎缩。这些患者胆碱能传入神经元和单胺能投射神经元的退化分别引起后皮质和前额叶、颞叶皮质的萎缩。并且纹状体胆碱能神经元和边缘大脑皮质乙酰胆碱转运体表达的减少也参与病理改变。另外,病程延长和年龄相关效应在引起神经病理改变的过程中不同程度地决定了这些皮质萎缩的位置和程度上的差异。综上所述可以解释PIGD患者皮质萎缩的独特模式,以及黑质外路易体[24]和淀粉样蛋白沉积的附加效应[25]。
发病年龄以及是否患有心、脑、肺等共病[26]也是影响PD亚型的因素,在晚发性帕金森病中,脑缺血、冠状动脉粥样硬化心脏病或糖尿病病史的患者与无症状患者相比,PIGD亚型严重程度明显升高。因为高龄和共病是轴性运动的巨大负担。一项队列研究发现,患共病的严重水平是导致患者进展到H-Y 3级的独立预测因子,也是姿势和步态稳定性的危险因素。并且通过发病年龄和基线轴性运动负荷水平可以预测5 y后姿势不稳的发展程度。因此,姿势异常可能是一种早期临床特征,是基于潜在的PD病理级联反应,正是共病与PD病理的协同作用产生了这一症状[27]。
综上,PIGD亚型突出的姿势和步态异常运动症状,导致摔倒风险的增加,使患者日常生活产生负面影响。并且由于大脑皮质与白质的病理改变致使患者对左旋多巴治疗不敏感。而发病年龄和患有共病对PIGD亚型均有影响,因此,今后在研究该人群时联合病理改变,进一步发现并修饰致病的危险因素可影响PD的亚型。

